跑台训练对大鼠心脏窦房结快激活IKr通道的影响
2014-03-16薄冰
薄 冰
(河南大学体育学院运动人体科学教研室,河南开封475000)
窦房结作为心脏的首要起搏点,在心脏规律的电学活动中具有极其重要的作用[1],其中,快激活延迟整流钾离子通道(IKr通道)引导窦房结细胞主要的复极化电流,该通道功能活动的改变可影响窦房结细胞动作电位复极化,进而导致窦房结功能障碍[2-3]。目前,关于运动对窦房结细胞IKr通道的影响鲜见报道,本文在跑台训练大鼠模型上,探讨IKr通道亚基ERG1b 基因表达及通道电流密度变化,揭示运动对于窦房结离子通道及功能的影响。
1 材料与方法
1.1 实验对象与分组
SPF 级雄性SD 大鼠50 只,6 周龄,体质量180±8 g(由河南省实验动物中心提供,合格证号:410118)。动物常规分笼饲养,5 只/笼,国家标准啮齿动物饲料喂养,自由饮食。饲养环境为室温18 ±2 ℃,相对湿度为40%~50%,光照时间12 h。大鼠首先进行3 d 适应性跑台训练,速度10 m/min,时间20 min,跑台坡度为0°。训练结束后,将能够完成跑台训练的大鼠随机分为5 组,每组10 只,包括对照组(C 组)1 组、1 次力竭组(O 组)2 组、两周反复力竭组(R 组)2 组。C 组大鼠不进行任何运动训练,O 组大鼠在正常饲养两周后,进行1 次速度25 m/min,坡度为0°跑台训练至力竭,R 组运动方式及强度同O组,每天1 次跑台训练,每周6 d,共训练2 周。跑台训练组大鼠分别于训练结束后0 h 及24 h 取材,O组以O-0 h 及O-24 h 命名,R 组以R-0 h 及R-24 h命名[4]。
1.2 实验方法
1.2.1 实时荧光定量PCR 检测mRNA:腹腔注射10%水合氯醛(1 mL/100 g 体质量)麻醉大鼠,参照文献分离窦房结组织[5-6],Trizol 法提取总RNA 并反转录RNA 合成为cDNA,保存于-20 ℃备用[7]。
通过互联网GenBank 查找基因序列,应用Primer5 软件进行引物设计,设计完成的引物由Invitrigin公司合成,引物序列见表1。
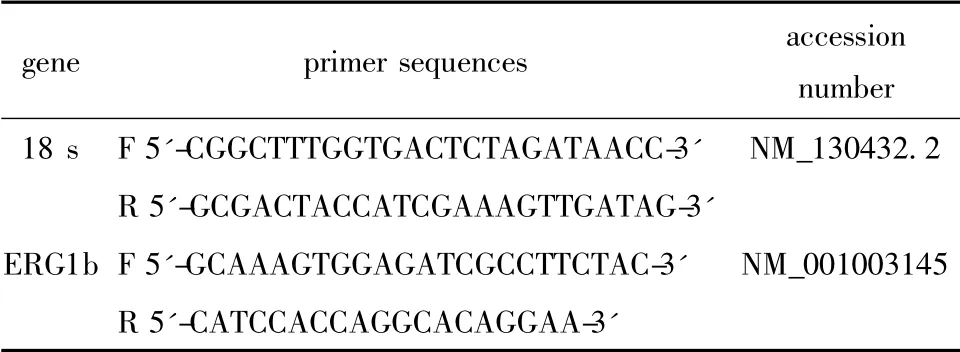
表1 Real-time PCR 基因引物序列Table 1 Sequence of primers for real-time PCR
取实时荧光定量PCR 专用96 孔板,解冻引物和cDNA,依次加入:引物F/R(上下游引物终浓度均为10 μmol/ L)1 μL、相对应的cDNA 1 μL,RealqPCR Master Mix 12 μL、H2O 11 μL,共25 μL,封膜。预热ABI7900HT 定量PCR 仪,进行实时荧光定量PCR 实验,反应条件如下:95 ℃10 min,95 ℃15 s,60 ℃1 min(生成扩增曲线);95 ℃15 s,60 ℃60 s,95 ℃15 s(生成熔解曲线),上述反应共40 个循环[7-9]。观察熔解曲线,判断PCR 特异性;以2-△△Ct作为计算公式,分析各组间mRNA 的表达差异,每个反应重复3 次。
1.2.2 Western blot 检测蛋白质表达:采用Novagen跨膜蛋白提取试剂盒按说明书操作提取大鼠窦房结组织跨膜蛋白(Cat No.71772-3)。提取蛋白质后,加入2 ×SDS 上样缓冲液煮沸,10% SDS-PAGE中电泳,转移至PVDF 膜。取下膜,用5% BSA 室温封闭1 h,TBST(洗涤缓冲液)洗膜5 min 后加入稀释浓度为1∶1 000 的一抗(兔ERG 多克隆抗体,Cat.No.ab92513),4 ℃孵育过夜,TBST 洗膜5 ×5 min,然后加入辣根过氧化物酶标记的二抗,室温孵育1 h,TBST 洗膜5 ×5 min。在暗室中,取ECL 显色液A、B 液等体积混合,将转印膜用混合液润湿均匀,压在暗盒中固定,显影定影3 min。用扫描仪进行胶片扫描,图像分析采用Quantity one 软件进行吸光度积分值分析。
1.2.3 大鼠窦房结细胞膜IKr通道电流密度测定:参照文献[10],急性分离大鼠心脏窦房结细胞(图1),选取大鼠单个窦房结细胞为研究对象,采用全细胞膜片钳记录大鼠窦房结细胞IKr电流(图6),具体操作步骤参照文献[8-9]。实验结果以通道电流密度数值表示,电流密度为电流强度与膜电容的比值(pA/pF),其中电流强度为实验所测量电流峰值,膜电容为实验中记录到的单个细胞电容值。
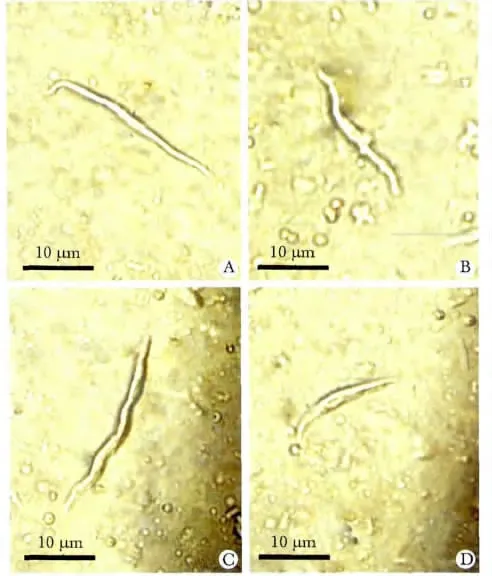
图1 酶消化分离后不同形态大鼠窦房结细胞Fig 1 Morphlolgy of isolated mouse sinoatrial node cells(scale bar=10 μm)
1.3 统计学分析
2 结果
2.1 IKr通道亚基ERG1b mRNA 表达
与C 组相比,O-0h 组ERG1b mRNA 相对表达量升高(P<0.01),O-24 h 组无变化;R-0 h 及R-24 h组表达量下降,低于C 组及O-0 h(P<0.01,P<0.01),两组间无明显差异(图2,3)。
图2 各组大鼠窦房结ERG1b real-time PCR 熔解曲线Fig 2 The dissociation curve of ERG1b real-time PCR of different groups in sinoatrial node
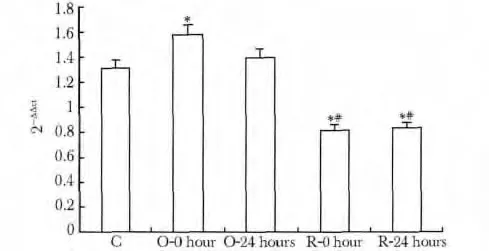
图3 大鼠窦房结IKr通道亚基ERG1b mRNA相对表达量比较Fig 3 ERG1b mRNA expression level in IKr channel of rats sinoatrial node(±s,n=8)
2.2 IKr通道亚基ERG1b 蛋白质表达
与C 组相比,一次跑台训练组吸光度值无明显差异;与C 及O-0h 组相比,R-0h 及R-24 h 组吸光度值明显下降(P<0.01,P<0.01)(图4,5)。
2.3 各组大鼠窦房结IKr通道电流密度
与对照组相比,O-0 h 及O-24 h 组电流密度无明显变化,R-0h 及R-24 h 组电流密度较对照组及一次训练两组明显下降(P<0.01)(表2,图6,7)。
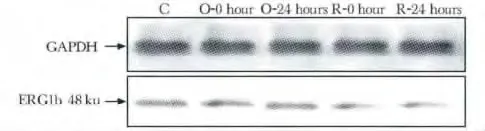
图4 各组大鼠窦房结IKr通道亚基ERG1b蛋白质表达电泳图Fig 4 The electrophoresis of ERG1b protein expression level in IKr channel of rats sinoatrial node

图5 各组大鼠窦房结IKr通道亚基ERG1b 蛋白质表达量比较Fig 5 ERG1b protein expression level in IKr channel of rats sinoatrial node (±s,n=8)
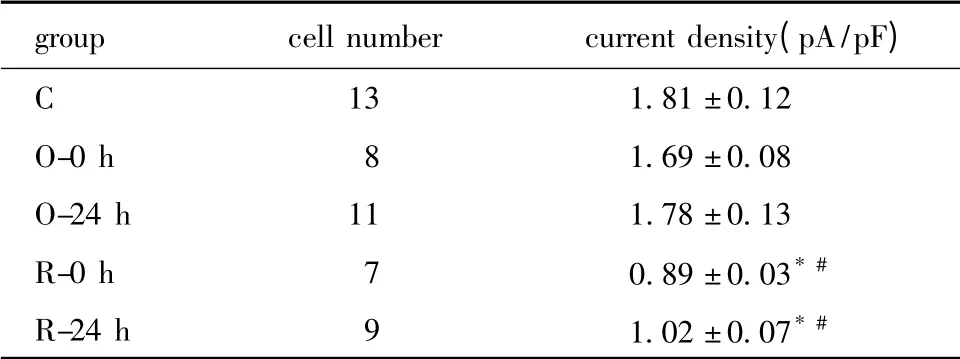
表2 各组大鼠窦房结细胞IKr通道电流密度Table 2 The current density of IKr channel of different groups in sinoatrial node cells
3 讨论

图6 C 组及R-0 h 组大鼠窦房结细胞IKr原始电流图Fig 6 IKr original traces of different groups in sinoatrial node cells IKr
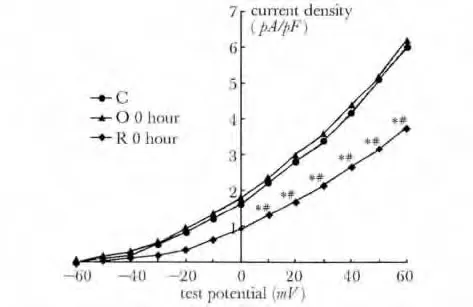
图7 对照组、一次力竭即刻组、反复力竭即刻组大鼠窦房结细胞膜上IKr通道IKr I-V 曲线Fig 7 IKr current-voltage (I-V)relationship of different groups in sinoatrial node cells
快激活IKr通道在窦房结细胞动作电位复极化过程中引导外向K+电流,在动作电位复极化控制及起搏活动中发挥重要作用,构成心脏窦房结IKr通道主要为ERG1b 基因[11]。本研究用两周跑台训练的大鼠模型探讨运动对大鼠窦房结IKr通道亚基ERG1b 基因表达及通道IKr电流密度的影响,发现一次跑台训练对ERG1b 基因表达无明显影响,两周力竭训练后该亚基mRNA 及蛋白质表达量减少,运动结束后24 h 内其变化趋势稳定,可见,两周反复大强度运动能够抑制ERG1b 基因表达,这种下调可能引起IKr通道介导的IKr电流密度减少,结合电生理实验结果可知,R-0 h 组电流密度较对照组明显下降,并且在运动结束后24 h 无明显变化,这与ERG1b 基因表达的变化趋势类似,提示ERG1b 亚基的变化与IKr通道的变化密切相关,反复力竭运动对于IKr通道亚基基因表达及电流密度均可产生抑制作用。
有报道纳摩尔剂量的E-4031 阻断兔窦房结自律细胞中IKr后,可使细胞的静息电位稳定于-30 mV和-40 mV 之间,最大舒张电位的正向变化可减少起搏电流If 的活化,同时增加电压依赖性ICa,L和ICa,T在舒张期去极化的失活,导致动作电位幅度和上升速度减少,从而引起起搏活动的减慢并终止窦房结细胞的自律活动[12]。
本研究证实,反复力竭运动可引起大鼠窦房结细胞膜IKr通道亚基ERG1b 基因表达及IKr电流密度下降,这可能成为运动引发窦房结功能障碍及运动性猝死发生的离子通道机制之一[13]。
[1]Yaniv Y,Lakatta EG.Pacemaker gene mutations,bradycardia,arrhythmias and the coupled clock theory[J].J Cardiovasc Electr,2013,24:28-29.
[2]Oehmen CS,Giles WR,Demir SS.Mathematical model of the rapidly activating delayed rectifier potassium current I(Kr)in rabbit sinoatrial node[J].J Cardiovasc Electr,2002,13:1131-1140.
[3]Ono K,Ito H.Role of rapidly activating delayed rectifier K+ current in sinoatrial node pacemaker activity[J].Am J Physiol,1995,269:453-462.
[4]王凯,潘珊珊,王庆棠.心肌SarcKATP 通道kir6.2 亚基在运动预适应心肌保护效应中变化的研究[J].体育科学,2012,32:60-66.
[5]Monfredi O,Dobrzynski H,Mondal T,et al.The anatomy and physiology of the sinoatrial node-a contemporary review[J].Pacing Clin Electrophysiol,2010,33:1392-1406.
[6]Sánchez-Quintana D,Pizarro G,López-Mínguez JR,et al.Standardized Review of Atrial Anatomy for Cardiac Electrophysiologists[J].J Cardiovasc Trans Res,2013,6:122-144.
[7]杨红霞,常芸.力竭运动后不同时相大鼠心脏窦房结ADAMTS-1 的变化[J].中国运动医学杂志,2011,30:437-441.
[8]薄冰,常芸.力竭运动对大鼠窦房结超级化激活环核苷酸门控通道的影响[J].中国运动医学杂志,2012,31:792-800.
[9]薄冰,常芸.力竭运动对大鼠窦房结ATP-敏感型钾离子通道的影响[J].中国运动医学杂志,2012,31:861-867.
[10]Rose RA,Lomax AE,Kondo CS,et al.Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node:a role for the NPR-C receptor[J].Am J Physiol Heart Circ Physiol,2004,286:1970-1977.
[11]Vandenberg JI,Perry MD,Perrin MJ,et al.hERG K+channels:structure,function,and clinical significance[J].Physiol Rev,2012,92:1393-1478.
[12]Verheijck EE,van Ginneken AC,Bourier J,et al.Effects of delayed rectifier current blockade by E-4031 on impulse generation in single sinoatrial nodal myocytes of the rabbit[J].Circ Res,1995,76:607-615.
[13]Hashem SI,Claycomb WC.Genetic isolation of stem cellderived pacemakeR-nodal cardiac myocytes[J].Mol Cell Biochem,2013,383:161-171.
