干扰SULT2B1下调MMP-2抑制Hepa1-6肝癌细胞的体外迁移与侵袭
2014-03-16杨晓明李晓波殷莲华
杨晓明,李晓波,殷莲华
(1.宁夏医科大学基础医学院病理生理学系,宁夏银川750004;2.复旦大学基础医学院生理与病理生理学系,上海200032)
基质金属蛋白酶-2(matrix metalloproteinase,MMP-2)、MMP-9 过表达及活性增强引起细胞外基质的降解是肝癌细胞侵袭和转移的关键环节[1]。羟基类固醇硫酸基转移酶(hydroxysteroid sulfotransferases)2B1 (SULT2B1)是一种催化氧化固醇硫酸化反应的关键酶。研究表明,SULT2B1 在肝脏中的生长、分化和代谢中起到重要的调控作用[2-4]。本实验前期研究发现,SULT2B1 可促进肝癌细胞的体内外增殖[5]。但SULT2B1 能否调节MMP-2 和MMP-9 的表达水平影响肝癌细胞的侵袭与迁移能力?本研究以Hepa1-6 细胞系为研究对象,探讨SULT2B1 与肝癌细胞侵袭、迁移生物学行为的关系,分析其可能的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞系:小鼠肝癌细胞系(Hepa1-6)源自American Type Culture Collection (ATCC)。
1.1.2 实验试剂:DMEM 培养基和胎牛血清(Gibco公司)、Trizol Reagent(Invitrogen 公司)、RevertAIdTMFirst Strand cDNA Synthesis Kit #1622(Fermentas 公司)、SYBR GREEN supermix(Bio-rad 公司);BCA-100 蛋白质定量试剂盒(上海申能博彩生物科技有限公司)、RIPA 蛋白裂解液(上海碧云天生物)、ECL化学发光检测试剂盒(北京康维世纪)、0.25%胰蛋白酶(杭州吉诺生物公司)、Transwell 24 孔板(Corning Costar 公司)、Matrigel 胶和明胶(Sigma 公司)、SULT2B1 兔多克隆抗体(Abcam 公司)、Tubulin 兔多克隆抗体(Bioworld 公司)、山羊抗兔IgG 抗体、山羊抗兔FITC 标记IgG 抗体(Santa Cruz 公司)、DAPI染色液(武汉博士德生物);SULT2B1 慢病毒干扰载体(SULT2B1-LV)和对照病毒载体(GFP-LV)由上海吉凯基因化学有限公司合成;引物由上海桑尼公司合成。
1.2 实验方法
1.2.1 细胞培养:Hepa1-6 细胞用含10%胎牛血清的DMEM 培养液培养,待细胞培养至铺满瓶底后用含0.25%的胰蛋白酶消化液消化细胞,每3~4 天换液,培养条件为37 ℃、5% CO2、饱和湿度。
1.2.2 Hepa1-6 细胞免疫荧光染色:将Hepa1-6 细胞接种在玻底皿中,4%多聚甲醛溶液固定10 min,PBS 漂洗,0.5% Triton-100 穿孔15 min,1% 牛血清白蛋白封闭30 min,加入SULT2B1 兔多克隆一抗(1∶200),同时设置正常IgG 兔多克隆抗体为代替一抗的阴性对照,4 ℃孵育过夜,加入FITC 标记羊抗兔二抗,37 ℃孵育30 min,5 μg/mL DAPI 染核2 min,激光共聚焦显微镜下观察并采集图片。
1.2.3 慢病毒干扰载体感染Hepa1-6 细胞:实验分设干扰组和对照组,根据病毒滴度,分别于无血清培养基中加入SULT2B1-LV 和GFP-LV 病毒悬液,感染指数(multiplicity of infection,MOI)为100,按照说明书操作,混匀后于37 ℃,5% CO2培养箱内培养。
1.2.4 Transwell 迁移与侵袭实验:Transwell 迁移实验中,在上室中分别加入经GFP-LV 和SULT2B1-LV处理的Hepa1-6 细胞(1 ×105个),用500 μL 无血清DMEM 培养液重悬,下层加入含10% FBS 的DMEM 培养基,每组设3 个复孔。孵育12 h 将小室取出,甲醇固定20 min,PBS 漂洗,每孔加入500 μL 1%结晶紫染色。PBS 漂洗,用棉签擦去微孔膜上层未穿过膜的细胞,倒置显微镜下放大200 倍对迁移至膜下层的细胞拍照。膜上的结晶紫用33%冰醋酸100 μL 洗脱,酶标仪在570 nm 处测定结晶紫洗脱液的吸光度值反应穿膜细胞数。Transwell 侵袭实验中,小室滤膜上室面均匀涂1∶2 的DMEM 稀释的Matrigel 胶(50 mg/L),使用前加入少量无血清的DMEM 培养液,水化,余步骤同Transwell 迁移实验。
1.2.5 明胶酶谱法检测干扰SULT2B1 的TCM 中MMP-2 和MMP-9 的活性:Hepa1-6 细胞经载体处理后,更换为无血清的DMEM 培养液,继续培养12 h,离心,收集细胞上清作为肿瘤条件培养基(tumor conditioned medium,TCM)。取干扰组和对照组的TCM 上清各15 μL 于含0.1%明胶的7.5%聚丙烯酰胺凝胶在非变性条件下进行电泳,电泳结束后胶体置于洗脱液(2.5% Trton X-100)中振荡洗涤后,移入缓冲液(50 mmol/L pH 7.5 Tris-HCl,10 mmol/L CaCl2,200 mmol/L NaCl,1 μmol/L ZnCl2)中温育18 h。0.1%考马斯亮蓝染色,并在脱色液(冰醋酸∶异丙醇∶水=10∶10∶80)中脱色,胶上出现清晰、透亮的负染条带,即为明胶酶的活性部位,用Tanon Gis 软件对负染条带扫描并分析。
1.2.6 Real-time PCR 检测 Hepa1-6 细胞中SULT2B1、MMP-2、MMP-9、TIMP2 的mRNA 表达:引物片段由上海桑尼生物有限公司合成(表1)。Trizol 法提取细胞总RNA,反转录合成cDNA。Realtime PCR 反应体系为:cDNA (4 mg/L)5 μL、SYBR GREEN supermi × 10 μL、上下游引物各1 μL、加ddH2O 至20 μL。反应条件为94 ℃预变性3 min,94 ℃变性30 s、退火60 ℃30 s、72 ℃延伸30 s,40 cycles。β-actin 作为内参照。反应结束计算实验组相对于对照组基因表达量。
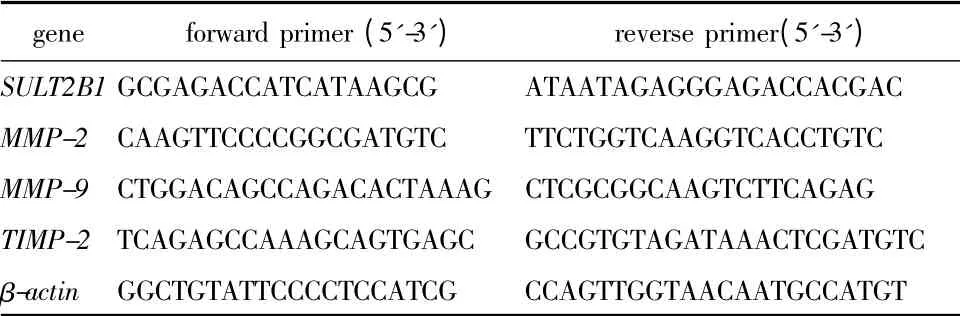
表1 Real-time PCR 引物序列Table 1 Primer sets used for real-time PCR
1.2.7 Western blot 检测Hepa1-6 细胞中SULT2B1的表达水平:采用RIPA 裂解缓冲液冰上裂解细胞,BCA 法测定蛋白浓度,10% SDS-PAGE 凝胶电泳、转膜(PVDF 膜)、封闭后,分别用SULT2B1 抗体(1∶500)、Tubulin 抗体(1∶5 000)孵育,4 ℃冰箱过夜,次日复温0.5 h 后,HRP 标记的山羊抗兔IgG 抗体(1∶2 000)37 ℃孵育45 min,化学发光法检测目的蛋白的相对表达量。
1.3 统计学分析
2 结果
2.1 SULT2B1 在Hepa1-6 细胞中的表达与定位
激光共聚焦显示SULT2B1 主要表达于Hepa1-6细胞的胞质中(绿色荧光),胞核无表达(图1)。
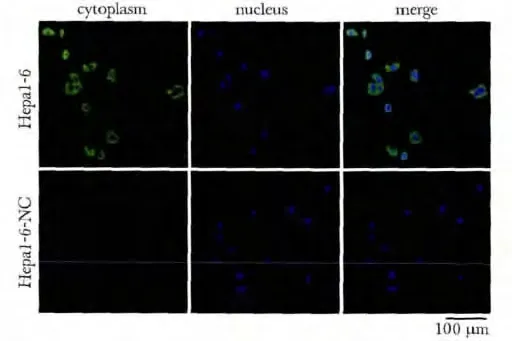
图1 SULT2B1 在Hepa1-6 细胞中的表达与定位Fig 1 SULT2B1 expression and localization in Hepa1-6 cells (Scale bar=100 μm)
2.2 慢病毒介导的SULT2B1 干扰载体感染Hepa1-6 细胞
荧光显微镜显示,感染GFP-LV 和SULT2B1-LV的Hepa1-6 细胞荧光强度较好,均能稳定表达绿色荧光蛋白(图2)。
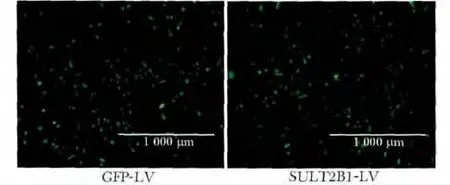
图2 慢病毒介导的SULT2B1 干扰载体感染Hepa1-6 细胞Fig 2 Hepa1-6 cell infected wih GFP-LV and SULT2B1-LV (Scale bar=1 000 μm)
2.3 Hepa1-6 细胞SULT2B1 干扰效果的检测
与对照载体(GFP-LV)相比,干扰载体(SULT2B1-LV)可使SULT2B1 的mRNA 水平降低81.2%(P<0.05)(图3A),蛋白水平降低43.5%(P<0.05)(图3B)。
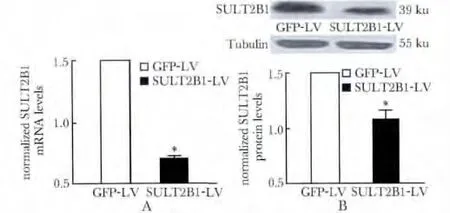
图3 Hepa1-6 细胞SULT2B1 干扰效果的检测Fig 3 Efficiency of SULT2B1 interfenrence in Hepa1-6 cells
2.4 SULT2B1 干扰抑制Hepa1-6 细胞的迁移与侵袭
与GFP-LV 对照组相比,SULT2B1-LV 可使Hepa1-6 细胞穿过未铺和铺Matrigl 胶的Transwell 小室滤膜的细胞数目分别降低53.5%(P<0.05)(图4A)和72.5%(P<0.05)(图4B)。
2.5 干扰SULT2B1 对Hepa1-6 细胞MMP-2、MMP-9、TIMP2 基因表达水平的影响
与GFP-LV 对照组相比,SULT2B1 干扰可使MMP-2 的表达水平降低54.5%(P<0.05)、TIMP-2的表达水平升高1.44 倍(P<0.05),但不影响MMP-9 的表达水平(图5)。
2.6 干扰SULT2B1 对Hepa1-6 细胞的TCM 中MMP-2 和MMP-9 活性的改变
与对照组相比,干扰SULT2B1 的TCM 可使MMP-2 的活性降低60.5%(P<0.05)(图6A),但对MMP-9 的活性无明显影响(图6B)。
3 讨论
SULT2B1 在不同组织中的定位存在差异性。在人T47D 和MCF-7 乳腺癌细胞中,SULT2B1 主要存在于胞质和完整的胞核中[6]。而在人的正常前列腺上皮细胞,良性前列腺增生,前列腺癌和LNCaP前列腺癌细胞中SULT2B1 蛋白位于胞质中[7]。本研究显示SULT2B1 主要定位于Hepa1-6 细胞的胞质,这可能与SULT2B1 在不同组织或细胞中不同的生物学功能有关。尽管SULT2B1 与子宫内膜癌[8]、乳腺癌[9]、食管癌[10]和肝癌[5]的关系已有若干报道,但其作用机理仍不清楚。本实验前期研究发现,干扰SULT2B1 主要通过上调FAS,抑制BCL2、MYC、降低cyclin B1 的表达水平及蛋白稳定性,引起细胞周期G2/M 期阻滞,抑制肝癌细胞的体内外增殖[5]。本研究结果表明,干扰SULT2B1 可抑制Hepa1-6 细胞的迁移与侵袭能力,其作用主要与降低MMP-2 的表达与活性,增强TIMP-2 的表达水平有关。
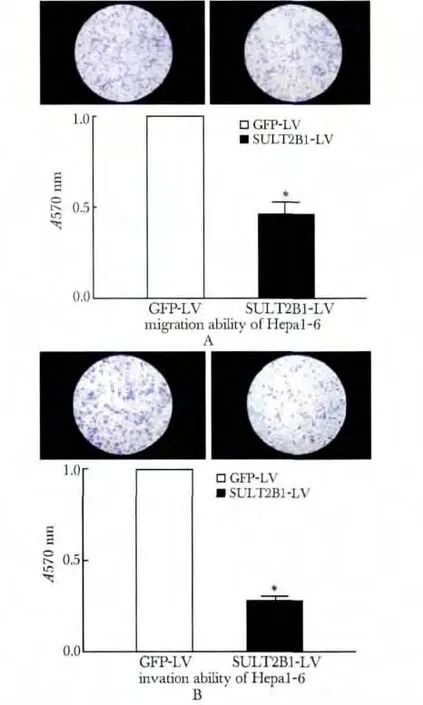
图4 SULT2B1 干扰抑制Hepa1-6 细胞的迁移与侵袭Fig 4 SULT2B1 interfenrence suppressed Hepa1-6 cell migration and invasion capability (×200)
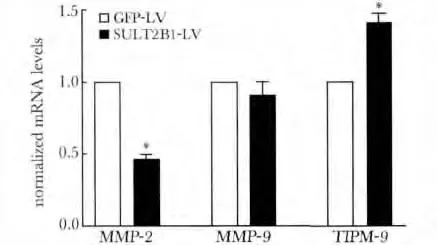
图5 干扰SULT2B1 对Hepa1-6 细胞MMP-2、MMP-9、TIMP2 基因表达水平的影响ig 5 The effect of SULT2B1 interference on the mRNA levels of MMP-2,MMP-9 and TIMP2 in Hepa1-6 cells

图6 干扰SULT2B1 对Hepa1-6 细胞TCM 中MMP-2 和MMP-9 活性的改变Fig 6 Analysis of MMP-2 and MMP-9 activities with SULT2B1 interference conditioned medium in Hepa1-6 cells
MMP-2 和MMP-9 是MMPs 家族中的重要成员,是参与ECM 降解的主要蛋白酶类。研究表明,HCC 中MMP-2 和MMP-9 呈过度表达,与HCC 血管的形成、侵袭和转移密切相关,高MMP-2、MMP-9 表达的患者预后不良[11-12]。本研究中,SULT2B1 与MMP-9 关系不大,主要通过下调MMP-2 的表达,达到抑制Hepa1-6 细胞侵袭与迁移的作用。有研究报道,MMP-2 的表达与HCC 癌灶大小、临床分期密切相关,有侵袭转移的癌组织阳性表达显著高于无转移者,提示MMP-2 阳性表达者预后不良且在肝癌的侵袭及转移中起重要作用[11]。
SULT2B1 下调MMP-2 抑制Hepa1-6 肝癌细胞的体外侵袭与迁移,可能是其影响肝癌细胞恶性生物学行为的机制之一,但SULT2B1 调控MMP-2 表达的具体作用机制还有待进一步阐明。
[1]Chen JS,Huang XH,Wang Q,et al.Sonic hedgehog signaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metalloproteinase (MMP)-2 and MMP-9 in liver cancer[J].Carcinogenesis,2013,34:10-19.
[2]Lo SG,Celli N,Caboni M,et al.Down-regulation of the LXR transcriptome provides the requisite cholesterol levels to proliferating hepatocytes[J].Hepatology,2010,51:1334-1344.
[3]Zhang X,Bai Q,Xu L,et al.Cytosolic sulfotransferase 2B1b promotes hepatocyte proliferation gene expression in vivo and in vitro[J].Am J Physiol Gastrointest Liver Physiol,2012,303:344-355.
[4]Zhang X,Bai Q,Kakiyama G,et al.Cholesterol metabolite,5-cholesten-3 beta-25-diol-3-sulfate,promotes hepatic proliferation in mice[J].J Steroid Biochem Mol Biol,2012,132:262-270.
[5]Yang X,Xu Y,Guo F,et al.Hydroxysteroid Sulfotransferase SULT2B1b Promotes Hepatocellular Carcinoma Cells Proliferation in vitro and in vivo[J].PLoS One,2013,8:60853.doi:10.1371/jounal.pone.0060853.
[6]Falany CN,He D,Dumas N,et al.Human cytosolic sulfotransferase 2B1:isoform expression,tissue specificity and subcellular localization[J].J Steroid Biochem Mol Biol,2006,102:214-221.
[7]He D,Meloche CA,Dumas NA,et al.Different subcellular localization of sulphotransferase 2B1b in human placenta and prostate[J].Biochem J,2004,79:533-540.
[8]Hevir N,Sinkovec J,Rizner TL.Disturbed expression of phase I and phase II estrogen-metabolizing enzymes in endometrial cancer:lower levels of CYP1B1 and increased expression of S-COMT[J].Mol Cell Endocrinol,2011,331:158-167.
[9]Fu J,Weise AM,Falany JL,et al.Expression of estrogenicity genes in a lineage cell culture model of human breast cancer progression[J].Breast Cancer Res Treat,2010,120:35-45.
[10]Hyland PL,Freedman ND,Hu N,et al.Genetic variants in sex hormone metabolic pathway genes and risk of esophageal squamous cell carcinoma[J].Carcinogenesis,2013,34:1062-1068.
[11]McKenna GJ,Chen Y,Smith RM,et al.A role for matrix metalloproteinases and tumor host interaction in hepatocellular carcinomas[J].Am J Surg,2002,183:588-594.
[12]Qin LX,Tang ZY.The prognostic molecular markers in hepatocellular carcinoma[J].World J Gastroenterol,2002,8:385-392.
