β-catenin过表达对骨肉瘤细胞TE85迁移、侵袭及凋亡的影响
2014-03-16罗光金迭小红
罗光金,康 权,毕 杨,迭小红,刘 敏,仇 超,罗 庆
(重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室儿科学重庆市重点实验室重庆市儿童发育重大疾病诊治与预防国际科技合作基地重庆医科大学附属儿童医院儿科研究所干细胞实验室,重庆400014)
目前有关Wnt/β-catenin 信号通路对骨肉瘤恶性生物学行为的影响存在不同的观点,传统的观点认为Wnt/β-catenin 信号通路在骨肉瘤中处于激活的状态,抑制Wnt/β-catenin 通路能抑制骨肉瘤细胞的增殖、侵袭、和促进凋亡[1-3],而近年来有文献报道Wnt/β-catenin 信号通路在骨肉瘤中处于失活的状态,激活Wnt/β-catenin 信号通路能抑制骨肉瘤细胞增殖,且此信号通路活性的缺乏可能导致了骨肉瘤的发展[4]。本实验旨在通过过表达Wnt/β-catenin 信号途径中最关键的信号因子β-catenin,探讨β-catenin对骨肉瘤细胞TE85 迁移、侵袭以及凋亡的影响。
1 材料与方法
1.1 细胞与重组腺病毒
人骨肉瘤细胞系143B、MG63、TE85,人胚肾HEK293 细胞,表达β-catenin 的重组腺病毒Adβcatenin,和表达GFP (green fluorescent protein)的重组腺病毒AdGFP(均本课题组保存)。携带Lef1/Tcf4 的结合位点的报告基因重组腺病毒AdTop-luc(美国芝加哥大学分子肿瘤实验室何通川教授惠赠)。
1.2 主要试剂
DMEM 高糖培养基、胎牛血清(Gibco 公司);胰蛋白酶(碧云天公司);细胞裂解液和RNA 提取试剂盒(百泰克公司);反转录试剂盒及PCR Mix(天根公司);兔来源β-catenin 一抗及羊抗兔二抗(Proteintech Group 公司);鼠来源β-actin 一抗(Santa Cruz 公司);小室、基质胶及Annexin V-PE/7-AAD 双染细胞凋亡检测试剂盒(BD 公司);polybrene (Sigma 公司);ECL化学发光液(Bio-Rad 公司);引物由Primer premier 6.0 软件设计,华大基因公司合成。
1.3 细胞培养
HEK293、143B、MG63 及TE85 细胞用含10%胎牛血清的DMEM 高糖培养基于37 ℃、5% CO2温育箱中培养,待贴壁生长至80%~90%的汇合率时,用胰蛋白酶进行消化、传代。
1.4 RNA 提取及RT-PCR
用RNA 提取试剂盒提取各组细胞RNA(步骤按说明书),反转录合成cDNA,以其为模板,能特异扩增β-catenin 的引物(正向:5'-TGGTTGCCTTGCTC AACA-3',反向:5'-AGCTTGGGGTCCACCACT-3')及内参GAPDH 的引物(正向:5'-CAGCGACACCCACT CCTC-3',反向:5'-TGAGGTCCACCACCCTGT-3')进行降落聚合酶链式反应,反应程序为:94 ℃3 min,94 ℃30 s,65~55 ℃30 s,72 ℃1 min,每循环降低1 ℃,共10 个循环;92 ℃30 s,56 ℃20 s,72 ℃1 min,25 个循环;72 ℃3 min,4 ℃forever。PCR 产物经2%琼脂糖电泳80 V,30 min,凝胶成像仪上观察拍照。
1.5 总蛋白提取及Western blot
细胞增殖汇合达80%时弃去培养基,冷PBS 洗2 遍,细胞直接刮下吸入1.5 mL 无酶离心管,加入裂解液RIPA(提前加入终浓度为1 mmol/L 的蛋白酶抑制剂PMSF)200 μL,冰上裂解30 min 后,4 ℃、13 000 r/min 离心5 min,吸取上清至1.5 mL 无酶离心管中,用BCA 法做标准曲线测蛋白浓度,10%分离胶、5%浓缩胶进行电泳,湿转法转膜,5%脱脂牛奶封闭1 h,一抗(1∶1 000)于4 ℃孵育过夜,TBST 洗膜3 次,二抗(1 ∶2 000)于室温孵育1 h,TBST 洗膜3 次,ECL 发光试剂发光。
1.6 重组腺病毒Adβ-catenin 及AdGFP 扩增
293 细胞接种于100 mm 养皿,细胞达60%~80%汇合时,加入适量病毒原液,24 h 后观察荧光表达,3~4 d 后约60%细胞漂浮后离心收集细胞,离心管内留适量上清液,经反复冻融3 次后,高速离心收集上清液得到较高滴度的重组腺病毒,分装于-80 ℃保存备用。
1.7 TE85 细胞分组处理
设空白对照组(blank 组)、Adβ-catenin 感染组(β-catenin 组)和AdGFP 感染组(GFP 组),TE85 细胞经传代培养,达60%~70%汇合时,无血清培养基换液,分别加入相应适量的腺病毒和终浓度为10 g/L的转染增强剂polybrene,24 h 后观察β-catenin 组和GFP 组荧光表达情况,补加相应腺病毒,以使48 h 后观察荧光表达一致(感染率约60%)。
1.8 荧光素酶报告基因检测
TE85 感染AdTOP-luc 36 h 后,接种于24 孔板,待细胞贴壁后,设blank 组、β-catenin 组、GFP 组,分别加入适量的相应腺病毒,每组3 个复孔,48 h 后吸弃培养基,加入报告基因细胞裂解液,离心收集上清液,吸50 μL上清与20 μL 底物混匀后,10 s 内在单管式荧光检测仪上读数,每个样本检测间隔时间保持一致,余下的裂解液用BCA 法测蛋白浓度标化读数值。
1.9 划痕实验检测迁移能力
不同组细胞在6 孔板中处理3 d 后,细胞汇合度接近100%,进行划痕(确保每组划痕宽度一致),分别在不同时间点镜下观察划痕愈合情况,选0 和72 h 测量不同部位划痕宽度计算划痕愈合率,划痕愈合率(%)=(0 h 划痕宽度-72 h 划痕宽度)/0 h划痕宽度×100%,实验重复3 次。
1.10 Transwell 检测侵袭能力
基质胶(冰上操作)与无血清培养基按1∶3 混合后,Transwell 上室分别加入60 μL 混合液,37 ℃培养箱过夜,上室分别加入100 μL (约1 ×105个细胞)不同处理组的TE85 无血清细胞悬液,下室加入500 μL 含20%FBS 培养基,每组设3 个复孔,60 h后取出小室,吸去上室培养基,用湿棉签轻拭去上室细胞,结晶紫染色5 min,PBS 洗净,显微镜下观察拍照,以上实验重复3 次。
1.11 流式细胞术及DAPI 染色检测细胞凋亡
TE85 细胞接种于6 孔板,经处理3 d 后,PBS 洗2 遍,4%多聚甲醛固定20 min,吸弃固定液,加入终浓度为0.001 g/L 的DAPI 染液,避光5 min,荧光显微镜下观察拍照。
TE85 细胞接种于6 孔板,经处理3 d 后,按Annexin V-PE/7-AAD 双染细胞凋亡检测试剂盒说明书步骤操作,进行流式分析细胞凋亡,实验重复3 次。
1.12 统计学分析
2 结果
2.1 RT-PCR 及Western blot 检测β-catenin 在骨肉瘤细胞中表达情况
在3 种经典的骨肉瘤细胞143B、MG63 及TE85中,β-catenin 的mRNA(图1A)和蛋白(图1B)的表达在TE85 细胞中相对较低(P<0.05)(图1)。
2.2 RT-PCR 检测Adβ-catenin 感染TE85 细胞后β-catenin 的表达
TE85 细胞经重组腺病毒Adβ-catenin 处理组即β-catenin 组,与未处理组即blank 组和空载体组即GFP 组相比,β-catenin 基因mRNA 表达明显增加(P<0.05)(图2)。

图1 β-catenin 在3 种骨肉瘤细胞中的表达Fig 1 The mRNA and protein expression of β-catenin in different osteosarcoma cells

图2 TE85 细胞经重组腺病毒感染后β-catenin基因表达情况Fig 2 The mRNA expression of β-catenin in TE85 cells after infection
2.3 荧光素酶报告基因检测Adβ-catenin 感染TE85 细胞后激活下游转录因子的活性
β-catenin 组荧光素酶报告基因读数显著高于blank 组及GFP 组(P<0.05)(图3)。
2.4 划痕实验检测3 组细胞迁移能力
划痕72 h 后,β-catenin 组划痕愈合率为(31.47±3.19)%,明显低于blank 组(76.94 ±20.42)% 及GFP 组(53.56 ±31.60)%(P<0.05)(图4)。

图3 TE85 细胞经重组腺病毒感染后β-catenin/TCF4 转录因子活性Fig 3 The β-catenin/TCF4 activity in TE85 cells after infection
2.5 Transwell 实验检测3 组细胞侵袭能力
经处理3 d 后,β-catenin 组穿膜细胞数为(103.0 ±10.5),明显低于GFP 组(226.7 ±8.5)和blank 组(240.3 ±18.5)(P<0.05)(图5)。
2.6 DAPI 染色和流式细胞术检测凋亡
DAPI 染色结果显示,3 组细胞凋亡均少见,β-catenin组与blank 组及GFP 组比较无明显差异(图6)。

图4 划痕实验检测3 组TE85 细胞迁移能力Fig 4 Wound migration of different TE85 cells after infection(×40)
如图7 所示,空白对照组(blank group)、空载体对照组(GFP group)和实验组(β-catenin group)凋亡率分别为:(3.81 ± 3.01)%、(7.45 ± 3.62)% 和(5.46 ±3.79)%,各组间无统计学差异。
3 讨论
Wnt/β-catenin 信号通路是目前已知的在胚胎发育以及肿瘤(包括骨肉瘤)的发生发展中扮演着重要的角色的信号通路[5-7]。本实验前期通过基因芯片发现:在干细胞成骨分化为每一特定阶段调控异常而产生骨肉瘤细胞中,都有β-catenin,即Wnt 信号通路关键调控基因的差异表达。过表达β-catenin能增强BMP9 诱导骨髓间充质干细胞分化[8],近年来有文献报道激活Wnt/β-catenin 信号通路能促进骨肉瘤细胞成骨分化及抑制骨肉瘤细胞增殖[4],说明激活Wnt/β-catenin 信号通路可能会改变骨肉瘤的恶性表型。
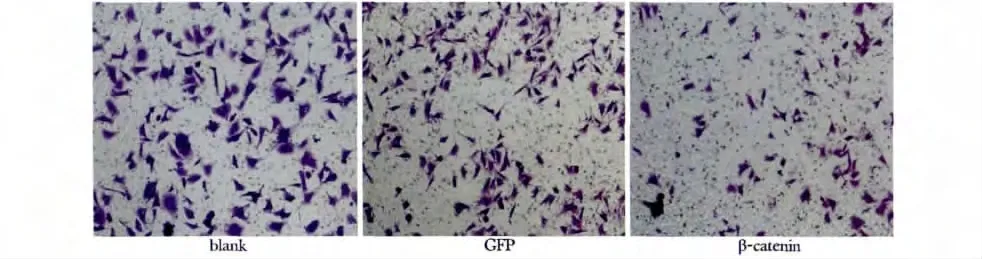
图5 Transwell 实验检测3 组TE85 细胞侵袭能力Fig 5 Invasion ability of different group TE85 cells(×100)

图6 DAPI 染色检测TE85 细胞经重组腺病毒处理后凋亡的影响Fig 6 Apoptosis of TE85 cells infected with recombinant adenoviruses(DAPI staining,×200)

图7 流式细胞术检测TE85 细胞经重组腺病毒处理后凋亡的影响Fig 7 Apoptosis of TE85 cells infected with recombinant adenoviruses
然而,关于Wnt/β-catenin 信号通路对骨肉瘤生物学行为的影响,目前国内外文献报道存在不同的观点,多数通过抑制Wnt/β-catenin 信号通路来探讨其作用及机制,如通过转染Wnt 受体阻滞剂DKK-3后能降低骨肉瘤细胞SaOS2 的侵袭能力[1],干扰β-catenin基因表达能抑制骨肉瘤细胞MG63 侵袭能力,并促进细胞凋亡[3],然而,近年来有文献报道激活Wnt/β-catenin 信号通路反而能抑制骨肉瘤细胞的增殖[4],而目前关于激活Wnt/β-catenin 信号途径后对骨肉瘤细胞恶性生物学行为的报道尚少见。
因此,本实验选取了骨肉瘤细胞中内源性βcatenin 表达相对较低的TE85 细胞,通过重组腺病毒Adβ-catenin 感染TE85 细胞,探讨过表达β-catenin 对骨肉瘤细胞TE85 迁移、侵袭及凋亡的影响。流式细胞术以及DAPI 染色实验结果发现过表达β-catenin对骨肉瘤细胞TE85 的凋亡无明显作用,而划痕和Transwell 实验证明过表达β-catenin 能抑制TE85 细胞迁移和侵袭,说明β-catenin 能抑制骨肉瘤细胞TE85 的恶性生物学行为,与近年来的文献报道Wnt/β-catenin 信号通路在骨肉瘤中的失活可能导致骨肉瘤发展的观点相符[4],最近的研究表明,β-catenin 在骨肉瘤细胞核内的表达较低,可以作为区分两种具有不同生物学特性的良、恶性肿瘤细胞(成骨细胞瘤与骨肉瘤)的标志物[9],说明过表达β-catenin 可能作为骨肉瘤的一个潜在治疗靶点。
然而,细胞信号通路对增殖、凋亡、遗传等的调节可能存在不同的调控机制[10],而迁移和侵袭是导致肿瘤易发生转移的重要特性,将通过下一步研究β-catenin 对骨肉瘤细胞迁移、侵袭等恶性生物学行为的相关机制,探索β-catenin 对骨肉瘤细胞的调控方式,为骨肉瘤的治疗带来新的希望。
[1]Hoang BH,Kubo T,Healey JH,et al.Dickkopf 3 inhibits invasion and motility of Saos-2 osteosarcoma cells by modulating the Wnt-beta-catenin pathway[J].Cancer Res,2004,64:2734-2739.
[2]Liu Y,Wang W,Xu J,et al.Dihydroartemisinin inhibits tumor growth of human osteosarcoma cells by suppressing Wnt/beta-catenin signaling[J].Oncol Rep,2013,30:1723-1730.
[3]张帆,陈安民,郭风劲,等.siRNA 抑制β-catenin 表达在骨肉瘤MG63 细胞系中的作用[J].中国癌症杂志,2010,20:801-805.
[4]Cai Y,Mohseny AB,Karperien M,et al.Inactive Wnt/beta-catenin pathway in conventional high-grade osteosarcoma[J].J Pathol,2010,220:24-33.
[5]Li C,Shi X,Zhou G,et al.The canonical Wnt-beta-catenin pathway in development and chemotherapy of osteosarcoma[J].Front Biosci (Landmark Ed),2013,18:1384-1391.
[6]Wodarz A,Nusse R.Mechanisms of Wnt signaling in development[J].Annu Rev Cell Dev Biol,1998,14:59-88.
[7]Polakis P.The oncogenic activation of beta-catenin[J].Curr Opin Genet Dev,1999,9:15-21.
[8]Tang N,Song WX,Luo J,et al.BMP-9-induced osteogenic differentiation of mesenchymal progenitors requires functional canonical Wnt/beta-catenin signalling[J].J Cell Mol Med,2009,13:2448-2464.
[9]Wan Y,Zhao W,Jiang Y,et al.beta-catenin is a valuable marker for differential diagnosis of osteoblastoma and osteosarcoma[J].Hum Pathol,2014,45:1459-1465.
[10]Coleman WB,Tsongalis GJ.Molecular mechanisms of human carcinogenesis[J].EXS,2006,96:321-349.
