白蛋白对急性重症胰腺炎大鼠血管内皮细胞作用的实验研究
2014-03-15崔华雷王晓晔
杨 宏,崔华雷,王晓晔,董 亮,董 迎,田 琪
白蛋白对急性重症胰腺炎大鼠血管内皮细胞作用的实验研究
杨 宏,崔华雷,王晓晔,董 亮,董 迎,田 琪
目的:通过大鼠体外实验探讨白蛋白与血浆胰蛋白酶损伤血管内皮的完整性的关系,初步证实白蛋白的保护作用。方法:分离并培养大鼠血管内皮细胞,将血管内皮细胞接种于96孔板中,待血管内皮细胞铺满96孔板底部,换用无血清DMEM 100 μL并加入10组含不同白蛋白浓度的培养液50 μL(浓度从10%~0.02%),各孔均含浓度为0.125%的胰蛋白酶,反应1 h,通过MTT法测定各组细胞的OD值。结果:MTT实验结果显示白蛋白浓度与相应血管内皮细胞OD值呈正相关。Y代表OD值,X代表板孔中白蛋白浓度,回归方程为:Y=0.021X3-0.084X2+0.140X+0.397。结论:白蛋白对胰蛋白酶造成的血管内皮细胞损伤有保护作用,白蛋白浓度与对血管内皮细胞的保护作用成正相关。
胰腺炎;白蛋白;血管内皮细胞
近几年来,急性胰腺炎的发病率逐渐上升,而重症急性腺炎(severe acute pancreatitis,SAP)的死亡率仍高达20%~30%[1]。面对SAP早期患者的高死亡率,最新研究表明:胰蛋白酶损伤血管内皮屏障是造成远隔脏器受各种活化酶进一步损伤及引起全身炎症反应的关键环节。并通过瀑布样级联反应使胰腺炎病人从局限性的病变发展成为全身炎症反应综合征SIRS和MODS[2-3]。白蛋白作为人体血浆胶体渗透压的重要组成部分,对快速提高SAP的胶体渗透压抢救休克,减轻胰周水肿[4],改善肠功能[5-6]。这一点已在临床上达成共识,但是白蛋白对改善早期SAP的关键环节的作用尚缺乏实验依据,本研究通过探讨白蛋白对SAP血管内皮细胞的保护作用,为临床合理应用白蛋白治疗SAP提供实验依据及理论指导。
1 材料与方法
1.1 实验动物 SD大鼠3只,雄性,体质量230~250g,由北京大学医学部实验动物科学部提供(许可证号:SCXK(京)2011-0012),大鼠于实验前在天津市儿童医院外科实验室适应性饲养1周,普通饲料喂养,自由饮水,饲养温度22℃~25℃,相对湿度40%~60%。实验过程中对SPF级动物的处置符合动物伦理学标准。
1.2 大鼠血管内皮细胞培养与传代 SD大鼠(150 g)鼠尾2个,制备鼠尾胶。大鼠1只(150 g),无菌条件下取胸主动脉一段,置于50 mL鼠尾胶覆盖的培养瓶中,加入含有20%新生牛血清的DMEM培养液,置于37℃、5%CO2、饱和湿度的孵育箱中静止培养6 d后,弃主动脉并换液[7]。原代培养约12~14 d,0.125%胰蛋白酶消化加入含20%新生牛血清的DMEM培养液适量,制成细胞悬液,依照细胞的量按1∶3或1∶4传代培养,隔天换液1次[8]。
1.3 MTT法测定不同浓度白蛋白对胰蛋白酶造成血管内皮细胞损伤的保护作用 取培养第3~5代内皮细胞,调整细胞密度至5×104/mL,以每孔200 μL接种于96孔板,用含15%的胎牛血清DMEM培养。至细胞铺满板孔底部时弃去培养液,加无血清DMEM培养基100 μL,给予白蛋白倍比稀释浓度(10%、5%、2.5%、1.25%、0.625%、0.3125%、0.156 25%、0.078 125%、0.039 062 5%、0.019 531 25%)各50 μL,共10个浓度,按白蛋白浓度由高到低依次设为1~10组,每孔再分别加入浓度为0.125%的胰蛋白酶溶液50 μL,震荡混匀,并设空白组(不加血管内皮细胞)和对照组(不加胰蛋白酶和白蛋白),5%二氧化碳培养箱中培养1 h。每孔加入20 μLMTT溶液(5 mg/mL),37℃继续培养4 h。终止培养,弃去培养液,每孔加入150 μL的DMSO溶液,震荡10 min,在490 nm波长下用全自动酶标仪测定各孔的OD值.每一浓度及空白孔和对照空设8个复孔。
1.4 实验结果的统计学处理 用SPSS13.0统计软件进行统计,各组OD值以均数±标准差(±s)表示,OD值与白蛋白浓度行相关性分析用双变量相关分析,取P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度白蛋白作用下,各组细胞OD值变化
加入不同浓度的白蛋白后,各组细胞测得的OD值见表1。
2.2 不同浓度白蛋白与OD值相关性分析 为便于观察各组OD值趋势,根据上表数据,以-log(板孔中白蛋白浓度)为横坐标,以各组对应的OD值为纵坐标,绘制散点图,如图1。随着板孔中白蛋白浓度的增高,OD值随之升高,-log(板孔中白蛋白浓度)与OD值成负相关。用SPSS 13.0统计软件Spearman相关分析板孔中白蛋白浓度与OD值的相关系数r= 0.972,P<0.01,两者存在显著正相关关系。
2.3 不同浓度白蛋白与OD值回归分析 通过SPSS 13.0统计软件行曲线拟合,选择11种模型,根据结果选择最佳模型。比较11种模型的拟合结果,以Cubic(三次模型)和Quadratic(二次模型)决定系数R2(R Square)最高,分别为0.975和0.965,选择三次模型,Y代表OD值,X代表板孔中白蛋白浓度,回归方程为:Y=0.021X3-0.084X2+0.140X+0.397F= 97.594,P<0.01,拟合的曲线见图2。
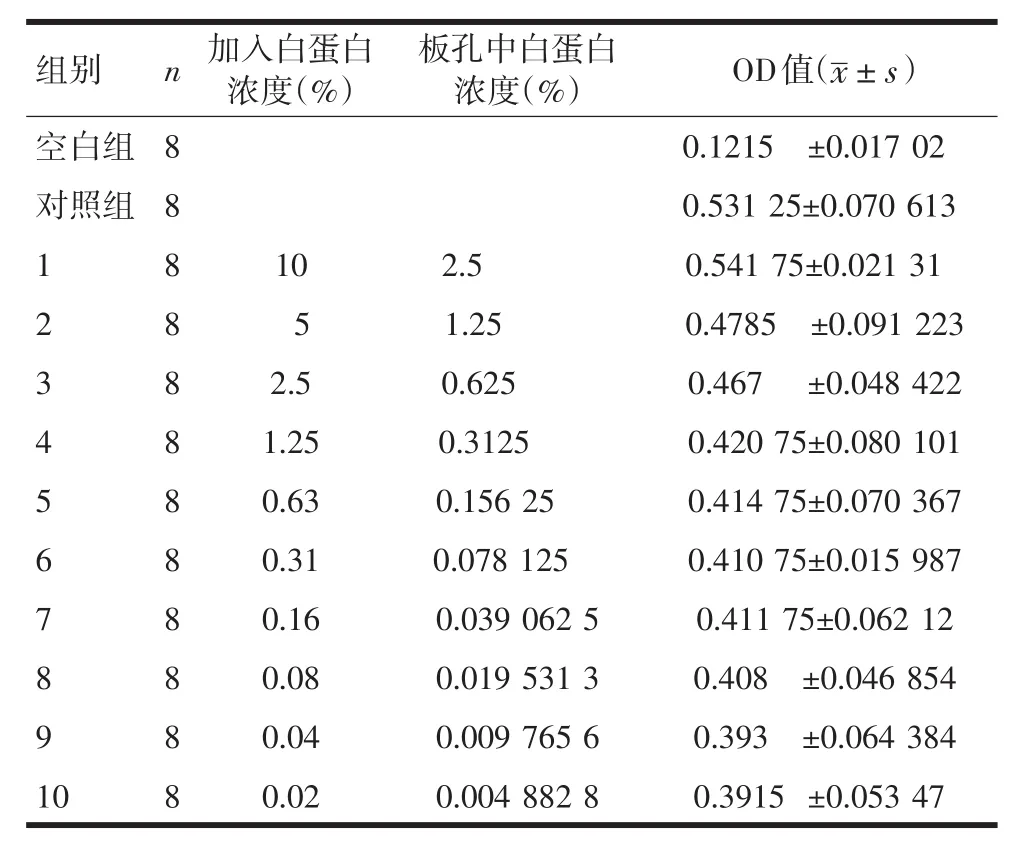
表1 不同浓度白蛋白作用下各组OD值
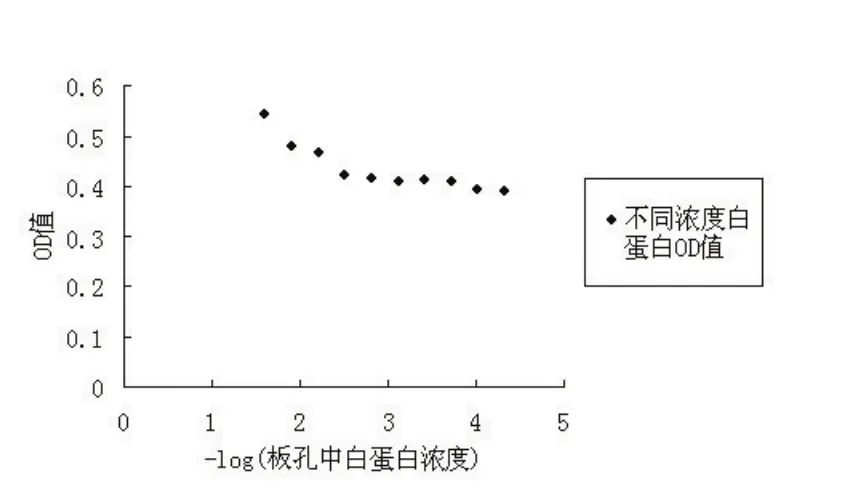
图1 -log(板孔中白蛋白浓度)与对应OD值散点图
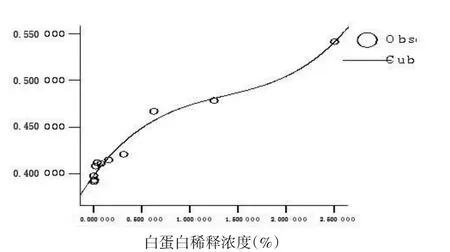
图2 不同白蛋白浓度与对应OD值散点图及回归曲线
3 讨论
SAP是普外科常见的危重疾病之一,具有病情复杂,变化快,病死率高等特点,在SAP的发病过程中,胰腺腺泡是胰腺炎最早发生形态学变化的场所[9-10],腺泡细胞酶原颗粒的过早激活是SAP的最早期事件[11],胰蛋白酶原异常激活变为胰蛋白酶,继而引起各种消化酶原的激活,胰蛋白酶首先消化血管内皮细胞膜表面的蛋白质,包括周边蛋白和整合蛋白,其损伤会造成血管内皮细胞的功能障碍;其次胰蛋白酶可以消化血管内皮细胞间连接蛋白,造成血管内皮细胞间连接受损,破坏血管内皮细胞的屏障功能,使其通透性增高。并与其它激活的消化酶共同作用,造成胰腺实质及邻近组织的病变,细胞的损伤和坏死。胰腺消化酶和胰腺炎症、坏死的产物又可通过血液循环和淋巴管途径,输送到全身,引起多器官功能障碍[12],因此,在SAP早期,胰蛋白酶损伤血管内皮屏障是造成远隔脏器受各种活化酶进一步损伤及引起全身炎症反应的关键环节。目前,国内外关于SAP的治疗主要有以下几方面:⑴抑制胰液分泌,主要药物有生长抑素、奥曲肽;⑵抑制胰酶活性,主要药物有乌司他丁、加贝脂、抑肽酶等;⑶抑制胃酸分泌,主要为H2受体拮抗剂和H+-K+-ATP酶抑制剂;⑷应用抗菌药物预防感染;⑸改善微循环及营养支持;⑹血液透析治疗;⑺手术引流胰周坏死组织,减少坏死物质吸收。但在临床实践中,首诊SAP患者往往已经进入MODS早期,激活的胰蛋白酶已经进入血液循环并损伤血管内皮屏障,此时,上述治疗方案中用于抑制胰酶分泌的措施不能终止已释放入血的胰酶对组织的损伤,更无法修复功能已经下降组织的完整性。血液透析及抗炎症反应药物只能抑制和消除炎症因子的“瀑布样反应”,不能从根本上解决受到损伤的组织器官的修复问题。手术治疗也只是起到引流坏死物质,因此,在SAP治疗过程中,如何及时纠正损伤组织、器官的生理机能,并提供有利于机体修复的物质,使机体尽快回复正常生理功能,是目前临床工作中亟待解决的问题,也是国内外相关研究的焦点之一。
白蛋白又称清蛋白,是一种中分子量的胶体,呈球状,能溶于水。血清白蛋白是血清中含量最丰富的蛋白质,白蛋白在治疗MODS中主要作用是:⑴有效扩充血容量和维持胶体渗透压,其中25%的白蛋白100 mL可增加血浆容量450 mL;⑵具有人工胶体液无法比拟的运输(胆红素、游离脂肪酸)功能和与阴离子、阳离子、活性的或有毒的游离物质可逆结合的能力;⑶是自由基清除剂;⑷具有改善羊模型中成人呼吸窘迫综合症的预后。临床上SAP患者往往伴有低蛋白血症[13],有临床研究表明[14],低蛋白血症对SAP的病理生理发展过程有促进作用,血浆白蛋白水平与胰腺炎病情、并发症呈负相关,血浆白蛋白水平越低,患者预后越差。低白蛋白血症的发生机制尚不明确,传统观点认为低蛋白血症与血浆蛋白外渗、消化吸收障碍和高分解状态有关,而此过程中血浆白蛋白的下降也可能是胰蛋白酶对血浆白蛋白消耗的结果,本实验通过加入不同浓度白蛋白至胰蛋白酶作用下的血管内皮细胞,并测定不同组的OD值,结果显示:随着白蛋白浓度的增高,各组OD值逐渐增高,两者呈正相关,可以得到结论:白蛋白对胰蛋白酶造成的血管内皮细胞损伤有保护作用,减少胰蛋白酶对血管内皮的损伤,从根本上有效预防早期SAP向MODS的发展。是提高SAP治疗效果的一个崭新的突破点,为临床更好的应用白蛋白治疗SAP提供理论依据。
[1]Mudda na V,Whitcomb DC,Papachislou GI.Current management and novel insights in acute pancreatitis[J].Expert Rev Gastroenterol Hepatol,2009,3(4):435-444.
[2]Nishio A,Asada M,Uchida K,et al.The role of innate immunity in the pathogenesis of experimental autoimmune pancreatitis in mice[J].Pancreas,2011,40(1):95-102.
[3]Rakonczay Z,Jr.,Hegyi P,Takacs T,et al.The role of NF-kappaB activation in the pathogenesis of acute pancreatitis[J].Gut, 2008,57(2):259-267.
[4]王小红,沈云志,薛祥龙,等.白蛋白在急性胰腺炎伴胰周渗出治疗中的应用[J].中国现代医药杂志,2008,10(6):92-93.
[5]曾钧发,肖宏,桂培根.早期肠内营养添加谷氨酰胺对老年重型颅脑损伤患者免疫功能和营养代谢的影响[J].中南医学科学杂志,2012,40(5):490-492.
[6]Hegasi R,Raina A,Graham T,et al.Early jejuna feeding initiation and clinicai outcomes in patient with severe acute pancreatitis[J]. JPEN J Parenter Enteral Nutr,2011,35(1):91-96.
[7]Kobayashi M,Inoue K,Warabi E,et al.A simple method of isolating mouse aortic endothelial cells[J].J Atheroscler Thromb,2005,12(3):138-142.
[8]Lincoln DW,2nd,Larsen AM,Philips PG,Bove K.Isolation of murine aortic endothelial cells in culture and the effects of srx steroids on their growth.In Vitro Cell Dev Biol Anim 2003,39(3-4): 140-145.
[9]Wang GJ,Li Y,Zhou ZG,et al.Integrity of the pancreatic duct-acinar system in the pathogenesis of acute pancreatitis[J]. Hepatobiliary Pancreat Dis Int,2010,9(3):242-247.
[10]Wang GJ,Gao CF,Wei D,et al.Acute pancreatitis:etiology and common pathogenesis[J].World J Gastroenterol,2009,15(12): 1427-1430.
[11]Gukovsky I,Pandol SJ,Gukovskaya AS.Organellar dysfunction in the pathogenesis of pancreatitis[J].Antioxid Redox Signal,2011,15(10):2699-2710.
[12]Zhang XP,Tian H.Pathogenesis of pancreatic encephalopathy in severe acute pancreatitis[J].Hepatobiliary Pancreat Dis Int,2007,6(2):134-140.
[13]李祖铭.急性胰腺炎患者血清白蛋白、葡萄糖、钙水平的变化及临床意义[J].内科急危重症杂志,2010,16(3):149-150.
[14]薛平,黄宗文,李永红.重症急性胰腺炎早期低白蛋白血症的临床研究[J].中西医结合学报,2005,3(6):443-445.
(收稿:2013-08-20 修回:2014-05-12)
(责任编辑 王 丰)
Experimental Study on Effects of Albumin on Vascular Endothelial Cells in Rats with Acute Severe Pan-creatitis
YANG Hong,CUI Hua-lei,WANG Xiao-ye,et al.
Department of Minitraumatic Surgery,Tianjin Children’s Hospital,Tianjin(300074),China
Objective To investigate the relationship of vascular endothelial injury under the effect of trypsin in vitro,and to confirm the protective effect of albumin on vascular endothelial injury initially.MethodsRat vascular endothelial cells(VECs)were isolated and cultured.Cells in the 3rd-5th generations were plated in 96-well microplate.Serum free medium(100 μL)were used when the VECs overspread the bottom of the microplate.Ten different concentrations of albumin(50 μL)were added in the microplate(diluting the concentration of albumin from 10%to 0.02%using the doubling dilution method).Each concentration was tested in 8 wells in the presence of 0.125%trypsin.Cells were incubated for 1 hour,the cell proliferation ability was measured by MTT.ResultsWith the increasing concentrations of albumin,OD value increased gradually.The OD values had a positive correlation with the concentrations of albumin.ConclusionAlbumin can protect the vascular endothelial injury induced by trypsin,and the protective effect of albumin on VEC has a positive correlation with albumin concentrations.
Acute pancreatitis;albumin;vascular endothelial cells
Q95-33;R657.5+1
A
1007-6948(2014)04-0397-04
10.3969/j.issn.1007-6948.2014.04.019
天津市儿童医院微创外科(天津 300074)
崔华雷,E-mail:chlfjp@sina.com
