毛蚶水解产物抗氧化活性分析
2014-03-14李婷菲叶斌
李婷菲,叶斌
(1.广东省食品药品职业技术学校,广东广州510663;2.广东食品药品职业学院,广东广州510520)
毛蚶水解产物抗氧化活性分析
李婷菲1,叶斌2,*
(1.广东省食品药品职业技术学校,广东广州510663;2.广东食品药品职业学院,广东广州510520)
通过正交试验得到中性蛋白酶、碱性蛋白酶和木瓜蛋白酶的最佳水解条件,根据该条件制得毛蚶蛋白酶水解产物,检测三种酶的DH值及分析各水解产物的氨基酚成分,通过水解产物对DPPH等自由基清除率和还原力的检测,分析其抗氧化活性。结果表明:碱性蛋白酶水解能力最强,其酶解产物中拥有最多的可溶性肽,且体现出较强的抗氧化活性,是毛蚶抗氧化活性肽生产的最佳选择。
毛蚶;水解产物;抗氧化;蛋白酶
随着自由基生命科学研究的不断进展,能阻止自由基反应传播,终止自由基反应的抗氧化剂研究已成为现代生命科学研究的热点。其中,来自食物蛋白水解的抗氧化肽就是其中一类具有抑制生物大分子过氧化或清除体内自由基产物的功能,减轻它们对机体的损伤的活性物质。目前,鉴于陆生资源的日益匮乏,对抗氧化活性肽的研究也由以陆地蛋白资源为主转为大力开发海洋抗氧化多肽。抗氧化多肽的活性,主要来自其分子量和结构,而酶法水解已成为从海洋蛋白中释放抗氧化多肽的一个有效途径,有研究表明,许多海洋产物通过蛋白酶水解所得的活性肽,具有显著的抗氧化活性,曾庆祝等[1]报道扇贝的木瓜蛋白酶酶解产物中分子量为9 ku的活性肽具有很强的羟自由基清除活性,其清除率SA为72.7%;扇贝的枯草杆菌蛋白酶酶解产物中分子量8 ku的活性肽对羟自由基的清除率可达73.6%。中国毛虾的SM98011酶解液通过超滤得到分子量小于3 ku的超滤液,研究发现酶解液和该超滤液对·OH的抑制率分别为42.38%和67.95%[2]。
毛蚶,分布于西太平洋日本、朝鲜、中国沿岸,属海产经济贝类,是一种常见的食物和药物资源。在中医上,用于治疗肿瘤、贫血和消炎已有几百年的历史。有研究证明,毛蚶的水解产物对被四氧嘧啶诱导的高血糖小鼠具有降血糖活性,对高血脂症实验小鼠模型有降血脂的作用[3]。王勇[4]等也从毛蚶中分离纯化出有抗氧化活性成分的糖肽。
然而,关于毛蚶蛋白酶水解产物的抗氧化活性研究尚未见报道,本文选择了三种蛋白酶,以毛蚶为原料对蛋白水解条件进行优化,测定了水解产物的氨基酸含量和组成,并检测了抗氧化活性,为毛蚶酶解产物的营养及药用价值提供研究依据。
1 材料与方法
1.1 材料与仪器
毛蚶产自山东青岛;中性蛋白酶、碱性蛋白酶、木瓜蛋白酶:广西庞博生物工程有限公司;二苯代苦味胼基自由基(DPPH)标准品:美国Sigma公司;其他试剂均为国产分析纯。
组织捣碎机:上海标本模型厂;DF-Ⅱ集热型磁力加热搅拌器:江苏金坛市医疗仪器厂;pHS-25数显酸:上海虹益仪器仪表有限公司;CR21G高速冷冻离心机:日本日立公司;Heto-FD1.0-60E低压冷冻干燥机:Heto-Helten公司;UV2450紫外分光光度计:Shimadzu公司;ICS-2500离子色谱分析仪:美国戴安公司。
1.2 方法
1.2.1 毛蚶蛋白酶解工艺过程
取清洗沥干的毛蚶,按比例1∶1(g/mL)加入蒸馏水后,采用组织捣碎机12 000 r/min捣碎3min制备样品匀浆。然后用0.25mol/LNaOH将匀浆调节到所需pH,按比例加入蛋白酶。酶解过程需维持反应体系的温度及pH恒定。反应完毕后,将水解液加热到90℃灭酶15min[5],冷却后4℃冷冻离心20min(15000 r/min),上清液冷冻干燥,保存备用。同时取部分样品匀浆,同样条件下冷冻离心,收集上清液,即为毛蚶的可溶性蛋白粗品,冷冻干燥后保存备用。
1.2.2 正交试验
3种蛋白酶选择温度、pH、酶用量和酶解时间作为实验因素,采用了L9(34)正交表对中性蛋白酶,碱性蛋白酶和木瓜蛋白酶的水解条件进行了优化。各因素和水平见表1。
1.2.3 酶解液水解度(DH)的测定
水解过程中采用pH-stat法测定和控制水解过程,在水解过程中不断加NaOH以保持反应体系pH恒定。水解度(DH)根据消耗的碱量进行计算。根据下式计算DH[6-7]:

式中:B为滴定所消耗的碱体积,mL;Nb为碱液浓度,(mol/L);Mp为水解反应中蛋白质总量,g;α为α-氨基的平均解离常数[8];htot为底物蛋白质中的肽键总数(mmol/克蛋白质),取8.0[9]。
1.2.4 抗氧化活性研究
1.2.4.1 对DPPH自由基的清除能力
将待测样品配制成20mg/mL的溶液,分别取7份不同体积的样品,用反渗透水稀释成2mL,备用。采用Shimada[10]所用的方法检测,同时做空白对照。样品对DPPH的清除率计算公示如下:

式中:S为样品加DPPH的吸光度;C为蒸馏水加DPPH的吸光度;SB为样品加蒸馏水的吸光度;CB为蒸馏水加蒸馏水的吸光度。
1.2.4.2 对H2O2的清除作用[11]
精密称取7份不同重量的待测样品,用0.1mol/L的磷酸缓冲液(pH7.4)定容至5mL后,取3.4mL上述溶液,加入0.6mL 4mol/LH2O2溶液,放置10min后,混合液在230 nm下测定吸光值,以不加样品的H2O2溶液作对照。每个浓度做3个平行。对H2O2的清除率计算公式如式1。其中,S为样品加H2O2的吸光度;C为蒸馏水加H2O2的吸光度;SB为样品加蒸馏水的吸光度;CB为蒸馏水加蒸馏水的吸光度。
1.2.4.3 还原力测定
精密称取7份不同重量的待测样品,根据Oyaizu[12]所报道的方法测定。每个浓度做3个平行。
1.2.5 氨基酸含量测定
采用离子色谱分析仪分析蛋白酶水解产物的氨基酸种类及含量,根据文献介绍方法[2-13],对总氨基酸测定样品和游离氨基酸测定样品进行前处理。分析条件为色谱柱:Amino PACPA10,2×250mm;柱温:30℃;进样体积:25μL;流速:0.25mL/min;流动相:A.去离子水;B.0.25mol/LNaOH;C.NaAC。
2 结果与分析
2.1 3种蛋白酶酶解毛蚶条件的优化
选择温度、pH、酶用量和酶解时间作为实验因素,以酶解液水解度(DH)为指标,采用正交表L9(34)对3种蛋白酶水解毛蚶蛋白的条件进行了优化。实验结果如表1所示,其中N、A、P分别代表中性蛋白酶、碱性蛋白酶和木瓜蛋白酶,水解度是3个平行实验结果的平均值。(P<0.05)
根据上表可知,中性蛋白酶、碱性蛋白酶和木瓜蛋白酶的最佳水解温度为40、45和55℃,水解时间是5、4和6 h,E/S值是6.0%、5.0%和5.0%,pH为7.5、9.0和6.5。我们根据此最佳水解条件,对样品进行处理,并对3种蛋白酶的水解产物进行抗氧化活性测定。
2.2 最佳水解条件下水解度(DH)的分析
3种蛋白酶按最佳条件对毛蚶进行酶解,并计算得出各个时间段的DH值。同时不加入外源蛋白酶进行对照,研究毛蚶的内源酶在水解过程中的作用。结果如图1所示。水解度是三次平行实验的平均值。

表1 3种蛋白酶的正交试验结果及分析Table1 Results and analysis of orthogonal experiment of three proteases

图1 3种蛋白酶和内源酶水解过程中的水解度曲线Fig.1 The curve of DH during the enzyme hydrolysis of three protease and endogenous enzyme
3种蛋白酶水解过程中的水解度曲线与报道过的水解度曲线相符合[14],碱性蛋白酶在水解过程中DH值一直高于其他两种蛋白酶,可见其水解能力优于其他两种蛋白酶。在3种反应温度下,毛蚶内源酶的水解度曲线没有明显的区别,且数值都小于2,可见内源酶对毛蚶蛋白的酶解作用相当弱,可以忽略不计。
2.3 抗氧化活性
2.3.1 DPPH自由基清除活性[15]
本文比较了中性蛋白酶、碱性蛋白酶和木瓜蛋白酶分别作用于毛蚶所得的产物的清除DPPH自由基的能力,其中抗坏血酸为阳性对照。清除率为3次平行实验结果的平均值(P<0.05)。结果如图2所示。
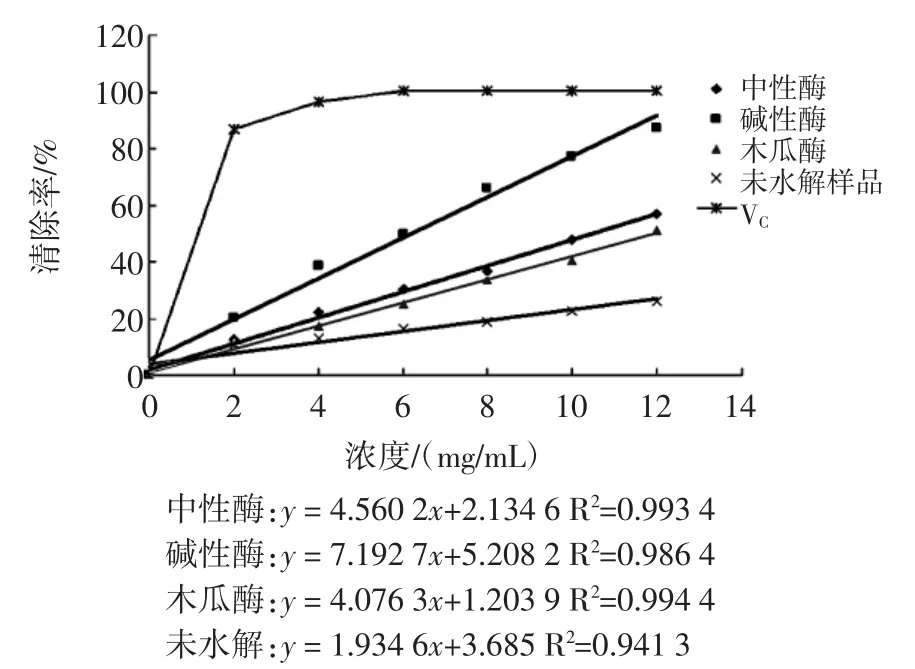
图2 酶解产物及毛蚶对DPPH自由基的清除作用比较Fig.2 The comparison of Scavenging effect on DPPH free radical of different concentrations of A.subcrenata.and its hydrolysates
由结果可以看出,毛蚶及其酶解产物对DPPH自由基都具有一定的清除能力,且其清除作用与浓度相关,其中,碱性蛋白酶酶解产物的上升趋势较为明显。
根据线性方程,我们可得出碱性蛋白酶酶解产物对DPPH自由基清除作用的EC50值最低,即其清除作用最强,且优于报道过的牡蛎酶解产物的清除活性[16]。
2.3.2 H2O2的清除作用
如图3所示,毛蚶在酶解前就具有较强的H2O2清除作用,碱性蛋白酶和木瓜蛋白酶的酶解对其清除H2O2的活性有所提高,但值得一提的是,中性蛋白酶酶解产物的活性反而低于毛蚶的活性,这表明中性蛋白酶的酶解作用使得毛蚶本身所具有的一些活性蛋白或多肽结构发生改变从而失活。

图3 酶解产物及毛蚶对H2O2的清除作用比较Fig.3 The comparison of Scavenging effect on H2O2of different concentrations of A.subcrenata.and its hydrolysates
2.3.3 还原力
还原力为3次平行实验结果的平均值(P<0.05)。由图4可看出,所测样品与吸光度之间同样存在剂量效应关系。酶解产物与毛蚶相比其还原力有所提高,3种酶解产物的还原力相似,与前两种氧化活性测试结果不同的是,中性蛋白酶解产物的还原力优于其他两种酶解产物。这说明酶解产物中清除DPPH自由基、清除H2O2和起还原作用的成分各不相同。酶解产物含有大量多肽,活性多肽的种类和含量也相应提高,样品的某一种抗氧化活性测试结果不理想,不代表不具有抗氧化功能,应测试多种体系,有利于开发酶解产物的多种活性。

图4 酶解产物及毛蚶还原力的比较Fig.4 Reducing power of different amounts of A.subcrenata.and its hydrolysates
2.3.4 酶解产物的氨基酸分析
本实验采用了高效离子交换色谱-积分脉冲安培法对毛蚶及水解产物进行氨基酸种类及含量的测定,结果如表2所示。
三种酶解产物的氨基酸种类相似,主要有氨基酸,甘氨酸,亮氨酸,谷氨酰胺和天冬酰胺。其中,碱性蛋白酶水解产物有更多的可溶性肽,这与Gbogouri[18]的报道结果一致,即DH越高,水解物的溶解性越佳。从表2可见,碱性蛋白酶水解产物游离氨基酸含量不少,但肽含量也相当高,说明碱性蛋白酶对毛蚶同时起着端基酶和内切酶的作用,中性蛋白酶酶解产物富含游离氨基酸,但肽的数量较少,这意味着对于毛蚶来说,中性蛋白酶更适用于其氨基酸的生产,而不是活性肽。
实验表明,大多数抗氧化活性成分为肽[19],这些活性成分在体内和肠道中的比大分子成分更容易被吸收,这与我们的实验结果相似,如表2所示,碱性蛋白酶解产物有较多的肽,抗氧化活性也较明显,因此我们可以认为,相比其他两种蛋白酶,碱性蛋白酶适用于毛蚶抗氧化活性肽的生产。
3 结论
本文选择了3种酶(中性蛋白酶,碱性蛋白酶和木瓜蛋白酶)用于毛蚶的水解研究,通过正交试验,得到最佳酶解条件。3种酶解产物都具有较强的还原能力以及清除DPPH自由基和过氧化氢的活性,其中,碱性蛋白酶酶解产物中拥有最多的可溶性肽,且体现出较强的抗氧化活性,因此,我们认为碱性蛋白酶是生产毛蚶抗氧化活性肽的最佳选择,这为进一步研究毛蚶抗氧化组分,并为其在营养保健品和药物的研制提供了实验依据。
[1]曾庆祝,许庆陵,林鲁萍,等.扇贝边活性肽的分离及其对羟自由基的清除活性研究[J].中国食品学报,2004,4(3):10-15
[2]Hailun He,Yiulan Chen,Caiyun Sun.Preparation and functional evaluation of oligopeptide-enriched hydrolysate from shrimp(Acetes chinensis)treated with crude protease from Bacillus sp.SM98011 [J].Bioresource Technology,2006,97:385-390
[3]Dou CG,Yan YQ,Zhang Z.Experimental studies on hypoglycemia and hypolipid effects of hydrolysate of Arca subcrenata[J].Chin.J Mar.Drugs1996,15(1):13-15
[4]王勇,杨静,孙峋.毛蚶提取物的抗氧化活性分析[J].中国海洋药物,2008,27(3):11-14
[5]Vilailak K,Soottawat B,Duangporn K,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degreeofhydrolysisand enzyme type[J].Food Chemistry,2007,102(4):1317-1327
[6]FGueˊrard,LDufosseˊ,DDe La Broise,etal.Enzymatic hydrolysis of proteins from yellowfin tuna(Thunnus Albacares)wastes using Alcalase[J].Journal of Molecular Catalysis B:Enzymatic,2001,11: 1051-1059
[7]Guerard,F Guimas,L Binet,A.Production of tuna waste hydrolysates by acommercial neutral protease preparation[J].J Mol Catal B-Enzym,2002(19/20):489-498
[8]于娅.牡蛎活性肤的制备及生物活性研究[D].无锡:江南大学, 2004
[9]Yokoyama K,Chiba H,Yoshikawa M.Peptide inhibitors for angiotensin I converting enzyme from thermolysin digest of dried bonito[J].Biosci.Biotech.Biochem,1992,56(10):1541-1545
[10]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion[J].JAgric Food Chem,1992,40:945-8
[11]Ruch h J,Cheng S J,Klauning JE.Prevention of cytotoxity and inhibition of interecellular communication by antioxidant catechin isolated from Chinese green tea[J].Carcinogenesis,1989,10:1003-1008
[12]Oyaizu M.Studies on products of browning reactions:antioxidative activities of products of browning reaction prepared from glucosamine[J].Jpn JNutr 1986,44:307-15
[13]Jin-shuiWang,Mou-ming Zhao,Qiang-zhong Zhao.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Food Chemistry,2007,101(4):1658-1663
[14]李祺福,李长友,欧阳高亮,等.中国鲎鲎素对人胃腺癌BGC-823细胞形态和超微结构的影响[J].厦门大学学报:自然科学版,2000,39(6):837-843
[15]Yamaguchi T,Takamura H,Matoba T,et al.HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J].Biosci.Biotech.Bioch,1998,62: 1201-1204
[16]欧成坤.酶法制备牡蛎生物活性肽新工艺研究[D].无锡:江南大学,2005
[17]高俊玲,崔建忠,孙树勋.氧自由基检测技术的研究进展[J].华北煤炭医学院学报,1999,1(5):403-404
[18]Gbogouri,G A Linder,M Fanni,J Parmentier,M.Influence of hydrolysis degree on the functional properties of salmon byproduct hydrolysates[J].J Food Sci,2004,69:615-622
[19]Meisel H.Overview on milk protein-derived peptides[J].Int Dairy J,1998(8):363-373
Investigation of Antioxidant Activities of Hydrolysates from Arca subcrenata Lischke
LI Ting-fei1,YE Bin2,*
(1.Guangdong Food and Drug Vocational-technical School,Guangzhou 510663,Guangdong,China;2.Guangdong Food and Drug Vocational College,Guangzhou 510520,Guangdong,China)
An orthogonal design was used to optimize hydrolysis conditions of three proteases, and the hydrolysis experiments were conducted under the optimal conditions of three enzymes. We get DH values and the amino acid compositions of the hydrolysates. Antioxidative activities of hydrolysates were assayed by measuring the reducing power, scavenging activities against DPPH free radical and hydrogen peroxide. The results showed that hydrolysates prepared with Alcalase had an excellent solubility, the highest DH and antioxidant activity, which was the optimal enzyme for A. subcrenata to produce the active ingredients.
Arca subcrenata Lischke;hydrolysates;antioxidant activity;protease
10.3969/j.issn.1005-6521.2014.010.010
2013-10-03
李婷菲(1982—),女(汉),讲师,主管药师,硕士研究生,研究方向:海洋药物开发。
*通信作者:叶斌(1980—),男,硕士研究生。
