明胶抗氧化肽的分离、纯化及其清除羟自由基活性的研究
2014-03-14张小强陈雪峰
张小强,陈雪峰
(1.咸阳师范学院体育系,陕西咸阳712000;2.陕西科技大学生命科学与工程学院,陕西西安710021)
明胶抗氧化肽的分离、纯化及其清除羟自由基活性的研究
张小强1,2,陈雪峰2
(1.咸阳师范学院体育系,陕西咸阳712000;2.陕西科技大学生命科学与工程学院,陕西西安710021)
为制备具有抗氧化活性的明胶肽,本实验采用不同的酶水解明胶,并对酶解产物采用超滤技术分离,利用分光光度法检测超滤后所得多肽组分对羟基自由基(·OH)的清除能力;进一步对抗氧化活性较强的组分利用葡聚糖SephadexC-25阳离子交换色谱、SephadexG-50凝胶过滤色谱和C18反向高效液相色谱进行分离、纯化,并对其各组分清除·OH活性进行了研究,最后对所得洗脱组分中具有最强清除自由基活性的多肽组分的分析氨基酸组成,结果显示:组分中甘氨酸、蛋氨酸、苯丙氨酸、赖氨酸含量较高的肽具有较好的抗氧化活性,·OH清除率达到55.37%。
明胶抗氧化肽;羟自由基;抗氧化活性;纯化
明胶是一种来自于胶原的非均匀肽类混合物,蛋白质含量高达80%以上,高纯度、低热量的营养物质。富含甘氨酸(37.38%)和脯氨酸(15.47%),非极性氨基酸含量合计占69.23%[1],可广泛应用于食品加工业。国内外的研究发现,明胶活性肽比其它蛋白源肽具有更高的抗氧化活性和抗疲劳功效[2-6]。但是,这些研究只是对明胶酶解物进行了抗氧化活性的测定,并未对酶解产物进行分离、纯化和氨基酸组成分析。本实验采用不同酶水解明胶后对酶解产物进行超滤、葡聚糖Sephadex G-25凝胶柱层析等分离、纯化,并对其各组分清除·OH活性进行了研究,对抗氧化活性最佳的肽段进行氨基酸组成分析,以期从分子量分布和氨基酸组成上对其抗氧化活性进行构效研究,期望对明胶活性肽在食品、医药等领域内的应用提供一些实验依据。
1 材料与方法
1.1 材料与仪器
食品级明胶:山东淄博宝恩生物科技有限公司馈赠;胰蛋白酶、碱性蛋白酶、中性蛋白酶(Wolsen);木瓜蛋白酶:北京奥博星生物科技有限公司;SP-Sephadex C-25阳离子交换树脂和Sephadex G-50凝胶:购自Amersham Pharmacia公司。
Minimate TFFsystem型超滤机:英国PALL公司;Dionex高效液相色谱仪(配P680液相色谱泵,UVD170U检测器,autoscience TMAT-330柱温箱,Chromeleon6.0 software色谱工作站):美国戴安公司;BS-224型电子天平(精度0.000 1 g):德国Sartorius公司;835-50型氨基酸自动分析仪:日本日立制作所;PHS-3C型台式PH计:上海精密科学仪器有限公司;可见紫外分光光度计Spectrum 752型:上海光谱仪器有限公司;高速离心机J-25I型:美国BECKMAN公司;LGJ-10型真空冷冻干燥机:巩义予华实验仪器有限公司。
1.2 研究方法
1.2.1 明胶肽的酶法制备
依据相关文献[7-11]、酶结构特点和pH分类,用缓冲液在80℃溶解明胶,然后在酶最适活力下水解明胶,具体工艺如表1,水解完成后80℃加热15min灭酶,水解液用10%TCA除蛋白,高速冷冻离心机离心、过滤,澄清后取上清液备用。
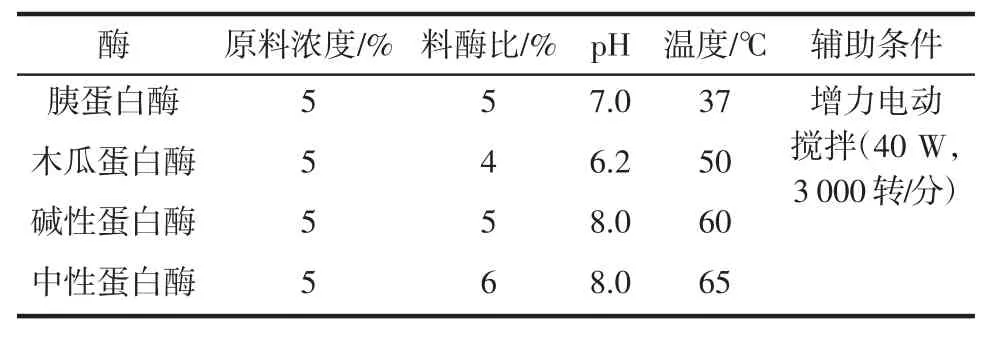
表1 不同酶解明胶工艺条件Table1 Enzymatic gelatin process conditions
1.2.2 对羟自由基的清除能力测定
羟基自由基(OH·)是己知的机体内存在寿命较长,对健康危害较大,氧化性最强的自由基,几乎可以和所有大分子成分发生反应。机体产生途径和方式较多,除Fenton、Haberweiss反应外,H2O2也可变为OH·。体外检测,能产生OH·的体系有Fenton反应体系、还原性谷胱甘肽-H2O2体系、烟酰胺嘌呤磷酸二核甘酸-H2O2体系、邻菲罗琳-抗坏血酸-H2O2体系、抗坏血酸-Cu2+体系等。1997年,金鸣等建立了以D536变化测定OH·氧化作用的比色测定方法。该方法主要依据OH·使邻二氮菲-Fe2+氧化为邻二氮菲-Fe3+,使邻二氮菲-Fe2+在536 nm处的最大吸收峰消失,根据536nm处吸光度变化判断受试物清除OH·的活性,评估其抗氧化能力。
清除率I(%)=(A样-A损)/(A未损-A损)×100
损伤管:取0.5mL 1mmol/L邻二氮菲的无水乙醇溶液加入1mL 0.15mol/L的磷酸盐缓冲液(pH7.4)和0.5mL去离子水。充分混匀后加入0.5mL 0.75mmol/L的FeSO4,混匀后再加入0.5mL 0.01%(v/v)的H2O2,37℃水浴60min后在536 nm下测其吸光值A损。未损伤管:以0.5mL的去离子水代替H2O2重复上述操作,在536nm测其吸光值A未损。样品管:以0.5mL的样品取代等体积的去离子水重复上述操作,在536 nm测其吸光值A样。清除率越大抗氧化活性越强。
1.2.3 明胶抗氧化肽稳定性的测定
活性肽体内外生理活性往往存在差异,为了检验胃肠道消化酶对制备的明胶肽抗氧化活性的影响,采用体外模拟消化过程分析活性肽在机体的稳定性,参考朱振宝的研究方法[12]用6 mol/L HCl调节酶解物溶液的pH在2.4,按照5%的浓度加入胃蛋白酶,在37℃条件水浴下搅拌器辅助反应3 h,80℃灭酶15min。随后调节pH在8.2,加入5%的胰蛋白酶,37℃水浴条件下搅拌器辅助反应3 h,80℃灭酶15min,用HCl和NaOH将酶解液调节至pH 7.0,冷却至室温,离心取上清液测定其羟自由基清除率,并与模拟前的抗氧化活性比较,检测明胶肽的稳定性。
1.2.4 明胶抗氧化肽的超滤分离
参考刘成梅[13]和朱夕波[14]的研究技术,在处理压力为30Psi,膜渗透通量为8.0LHM,渗透增量为0.10g/min,膜效能为3.0g/m2·min的超率操作条件下,分别用<10K,10 K~20 K,20 K~50 K,50 K~100 K,>100 K的超滤膜分离制备酶解液浓度为2%的明胶酶解液,并检测不同组分的OH·清除率。
1.2.5 明胶抗氧化肽的色谱分离与纯化
在超率筛选的基础上,取明胶酶解产物用pH4.0、20mmol的醋酸-醋酸钠缓冲液稀释到相同pH后先进行SephadexG-25柱层析,色谱条件:亲和层析柱(1.0 cm×20 cm),先用0.45μm微孔滤膜过滤明胶酶解液,再用0.02mol/L的醋酸-醋酸钠缓冲液(pH 4.0)进行充分平衡。自动上样,上样浓度为15mg/mL,上样量200μL,待未结合多肽洗脱后,分别用NaCl浓度为0.01、0.05、0.1mol/L和0.5mol/L的0.02mol/L、pH4.0的醋酸-醋酸钠缓冲液进行梯度洗脱。流速为1.5mL/min,收集出现活性肽峰的洗脱液,每管10min,225 nm检测,并分析不同组分清除OH·活性。进一步将亲和层析筛选的明胶酶解物样品溶解在少量的双蒸水中,进行Sephadex G-75柱层析,色谱条件:凝胶色谱柱Sephadex G-50(1.6 cm×100 cm),先用去离子水平衡。自动上样后再用去离子水进行洗脱,直至所有肽被洗脱出来。进样浓度为5mg/mL,进样量10μL,流速为0.5mL/min,分别收集生理活性肽洗脱峰,每管20min,225 nm检测,并测定其OH·清除率。最后将凝胶层析制备的样品采用RP-HPLC进行进一步分离、纯化检测,色谱条件:C18反相色谱柱(4.6mm×250mm),检测波长225 nm,流动相:A液,0.1%TFA;B液,0.1%TFA+100%CH3CN,利用体积分数为5%~100%的乙腈进行梯度洗脱,流速1.0mL/min。
1.2.6 氨基酸组分分析
经上述分离、纯化制备的抗氧化活性肽组分,用6mol/L的HCl在115℃下完全水解24 h。将水解液全部转移至旋转蒸发仪内蒸干,用0.1mol/L的HCl溶解并调节氨基酸浓度在0.4 nmol/L~10 nmol/L。采用氨酸酸自动分析仪进行氨基酸组成分析。
2 结果分析与讨论
2.1 明胶不同酶解物清除OH·功效和稳定性的比较
明胶活性肽的最终功效必须经过人体试用才能实现真正的应用。目前的研究表明,生理活性肽在体外和体内、动物实验和人体间表现出不同的活性。体内和体外的活性差异主要表现在两方面:一是在体外有很高的活性,但在体内却功效一般。原因可能是生理活性肽经口服后,被消化道存在的酶进一步降解,导致多肽结构发生变化或者胃肠道的pH、温度、其他物质的存在等不利于其活性的发挥,从而使生理功效降低;另一种情况是体外活性很低的肽进入机体后表现出很强的活性,可能的原因是活性肽被摄入体内后经胃肠道的消化酶进一步将服用的活性肽降解成了功效更显著的短肽,也可能是胃肠道的环境更适合其活性的发挥,也可能其特殊的从链结构自我保护不容易再被进一步水解等。总之,为了检测活性肽在体内功效的稳定性,实验室经常采用通过体外模拟肠胃道系统消化过程的方法分析,由于胃蛋臼酶、胰酶复合酶水解模式最接近人体自然生理消化过程,所以采用此模式检测制备的抗氧化明胶多肽在体内消化的稳定性。
利用胰蛋白酶、中性蛋白酶、碱性蛋白酶和木瓜蛋白酶酶解明胶制备的活性肽对OH·清除率初试分别为:93%、71%、73%、61%。模拟体内消化后上述酶解物OH·清除率分别为91.88%、43.57%、35.14%、29.29%。由此可知,经过胃蛋白酶和胰蛋白酶模拟体内消化后的明胶抗氧化多肽清除活性,中性蛋白酶、碱性蛋白酶和木瓜蛋白酶酶解明胶产物都有所下降,存在统计学差异,而清除·OH的活性比较稳定,因此确定采用胰蛋白酶水解明胶,利用·OH清除率分析其抗氧化活性。
2.2 明胶抗氧化肽超滤分离不同组分OH·清除率的结果与分析
国内外学者研究发现,明胶肽具有抗氧化活性,而且抗氧化能力强弱与活性肽分子量大小有关。明胶酶解物是多种肽等的不均一混合物,生理活性肽的分子量分布范围比较大,为了确定抗氧化能力最强的明胶肽分子量大小和抗氧化功效,首先利用超滤技术对制备的明胶肽进行了初步分离,并检测了不同组分的OH·清除率,结果如表2。

表2 超滤对明胶多肽分子量分布(%)及OH·清除率的影响Table2 OH·radical scavenging activities of geltain peptides with different MW s
由各组分清除·OH自由基能力(表2)可知,明胶肽的抗氧化活性与其分子量大小密切相关,分子量越低活性肽抗氧化活性越强,分子量小于10K的短肽抗氧化活性尤为明显。因此筛选分子量小于10K的组分作为进一步分离的样品。
2.3 明胶抗氧化肽色谱分离不同组分OH·清除率的结果与分析
从明胶酶解产物中制备的抗氧化多肽,通过超滤初步分离后,经强阳离子交换色谱SP-Sephadex C-25,Sephadex G-50凝胶过滤和C18高效液相色谱等分离、纯化步骤,最终得到了两个不同的多肽组分,不同阶段各个不同组分均具有较强的抗氧化活性,明胶活性肽分离结果如图1~图3所示。
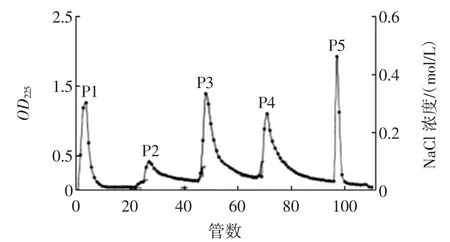
图1 明胶水解产物的SP-Sephadex C-25离子交换色谱图Fig.1 Elution profile of gelatin hydrolysate on SP-Sephadex C-25 column

图2 明胶的Sephadex G-50凝胶过滤色谱图Fig.2 Elution profile of gelatin on Sephadex G-50 column

图3 明胶的C18反相高效液相色谱图Fig.3 Elution profile of fraction gelatin on C18HPLC column
①将超滤分离筛选的分子量小于10 K的组分上阳离子交换色谱纯化,收集得到组分1~5,他们对OH·清除率分别为:25.7%、43.57%、39.25%、32.74%、47.53%。其中组分2和5清除活性较高,结合酶解物浓度(组分2浓度为0.02mol/L,组分5浓度为0.4mol/L),筛选组分2为进一步分离的样品。②将阳离子交换色谱分离收集的组分2浓缩后上到Sephadex G-50凝胶过滤层析色谱柱上,225 nm测量吸光值,结果如图2所示。检测各个不同组分的OH·清除率,在相同的浓度下清除率分别为:47.83%、48.32%、49.15%、49.02%和55.37%,其中组分5抗氧化活性最强,筛选为下一步分离的样品。③应用C18反相柱对凝胶过滤层析制备的具有较强抗氧化活性的肽段进行分离,获得两个组分,结果如图3所示。两个组分的高分辨率RPHPLC图谱均呈现单一主峰,无拖尾和重叠,因此可以认定收集肽段组成比较单一,纯度较高,作为分析样品继续进行氨基酸组成分析。④多肽的抗氧化活性与其氨基酸组成和种类有关,目前的研究发现某些单一的氨基酸Phe和Glu[1]、Gly和Asp[16]、His和Lys[17]也有某些抗氧化活性,但其活性远远低于由其所组成的抗氧化肽,即肽的活性远远大于其氨基酸的活性,可能的原因在于肽链内氨基酸间的短程相互作用,组成活性中心、构建了“空穴”,增强了其与自由基的接触,降低了环境的影响[18]。Boli[19]的实验证实:Met、Tyr、Phe和His是四种有自由基清除效果的关键氨基酸,多肽中以上四种氨基酸含量较多时抗氧化活性较强。本研究利用氨基酸分析仪测定筛选的两个组分的氨基酸组成,结果发现,组分1每100毫克样品中含有氨基酸较多的分别为Gly(102.77ng)、Glu(47.69ng)、Phe(39.82ng)、Asp(26.18 ng)、His(13.56 ng)和Lys(13.26 ng);组分2的主要组成氨基酸为Gly(524.77 ng)、Glu(524.32 ng)、Lys(324.39 ng)、Phe(183.11 ng)、His(62.36 ng)和Met(48.77 ng)。这个结果和现有的研究结果比较一致,另外,除了氨基酸种类、数量影响生理活性肽的抗氧化功效外,活性肽中氨基酸的排列顺序也可能决定着功能肽的抗氧化性能,有必要对筛选的组分测定氨基酸顺序,进一步从构效关系研究其在体内的抗氧化作用机制和分子机理。
3 结论
应用不同酶水解明胶,利用OH·清除率评估抗氧化功效,采用超滤、Sephadex C-25、Sephadex G-50、C18色谱等技术逐步筛选明胶酶解产物对其进行分离,并对每个分离阶段收集制备的不个组分进行羟自由基清除活性测定,最终结果发现:组分中甘氨酸、蛋氨酸、苯丙氨酸、赖氨酸等含量较高的肽具有较好的抗氧化活性,OH·清除率在浓度为2%时达到55.37%,预示明胶肽可以作为一种良好的抗氧化剂在食品中应用。
[1]张小强,董文宾.猪皮明胶抗氧化多肽酶法制备的响应面优化[J].食品科技,2013,38(1):159-163
[2]张小强,董文宾.猪皮明胶肽抗小鼠外周肌肉疲劳作用的研究[J]食品科技,2013,38(2):79-82
[3]张闽,董文宾,张小强,等.猪皮明胶肽体内抗氧化功效的研究[J].中国酿造,2012,31(11):70-72
[4]Anusha G P Samaranayaka,Eunice C Y Li-Chan.Food-derived peptidic antioxidants:A review of their production,assessment,and potential applications[J].Journal of fuctional food,2011,27(3):229-254
[5]M C Gomez,B Gimenez,M E Lopez,et al.Functional and bioactive properties of collagen and gelatin from alternative sources:A review [J].Food Hydrocolloids,2011,25(6):1813-1827
[6]BHalliwell,R Aeschbach,J Loliger,et al.The Characterization of Antioxidants[J].Fd Chem,2005,33(7):601-617
[7]孟欢,罗儒显.木瓜蛋白酶水解明胶制备多肽的工艺研究[J].广东化工,2010,37(1):36-38
[8]张勤.酶法从鲜猪皮中提取生物活性肽[D].西安:西北大学硕士学位论文,2005:6
[9]余霞.猪皮胶原蛋白酶解液的抗氧化活性及其分离纯化研究[D].成都:四川农业大学硕士学位论文,四川成都,2011:6
[10]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学博士学位论文,山东青岛,2006:6
[11]余东华.猪皮蛋白两步酶解及其产物性质研究[D].武汉:华中农业大学硕士学位论文,湖北武汉,2011:6
[12]朱振宝.杏仁蛋白源ACE拟制肽制备及其降血压功能的研究[D].西安:陕西师范大学博士学位论文,2010:6
[13]刘成梅,梁汉萦,刘伟,等.罗非鱼鱼皮多肽的超滤分离及其抗氧化活性研究[J].食品科学,2008,29(5):227-230
[14]朱夕波.鲨鱼皮和猪皮胶原蛋白抗氧化活性肽的特性研究[D].上海:上海海洋大学硕士学位论文,2008:6
[15]Ranathunga S,Rajapakse N,Kim SK.Purification and characterization of antioxidative peptide derived from muscle of congereel(Conger myriaster)[J].Eur Food Research,2006,222:310-315
[16]Ren JY,Zhao MM,Shi J.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chem,2008,108:727-736
[17]Mitsuta H,Yasumoto K,Iwami K.Antioxidative action of indole compounds during the autoxidation of linoleic acid[J].J Japa Soci Food Nutri,1996,19:210-214
[18]Nam KA,You SG,Kim SM.Molecular and Physical Characteristics of Squid(Todarodes pacificus)Skin Collagens and Biological Properties of Their Enzymatic Hydrolysates[J].Food Sci,2008,73:249-255
[19]Boli.Isolation and identification of antioxidative peptides from porcine collagen hydrolysateby consecutive chromatography and electrospray ionization-mass spectrometry.Food chemistry[J].2006, 207:992-1006
Study of Scavenging Effecton on OH Radical,Separation and Purification of Gelatin Antioxidant Peptides
ZHANG Xiao-qiang1,2,CHEN Xue-feng2
(1.Depertment of P.E.Xianyang Normal University,Xianyang 712000,Shaanxi,China;2.College of life﹠Engineering,Shaanxi University of Science and Technology,Xiˊan 710021,Shaanxi,China)
We used four different kinds of commercial protease to hydrolyze gelatin,and measure the antioxidant activity of hydrolysate such as their abilities to scanvage OH·radicals.Peptides derived from geltain was separated by ultra-filtration technology.The result showed that the trypsin hydrolysate had the best antioxidant activity.Furthermore,we used SP-Sephadex C-25 cation exchange chromatography and Sephadex G-50 gel filtration chromatography to separate the trypsin hydrolysate and get an elution peak part with strong activities of scanvaging OH·radicals.The result of experiment indicates that the OH·scavenging rate of the hydrolyzate was up to55.37%.They contained the key amino acid for the antioxidation,such as Glu,Met,Phe,Lys et al.
gelatin polypeptide;OH·;antioxidant;purification
10.3969/j.issn.1005-6521.2014.010.003
2013-04-11
咸阳师范学院专项科研基金重点项目(13XSYKY065)
张小强(1970—),男(汉),工程师,博士,研究方向:食品功能因子和作用机理。
