姜黄素通过抑制ERK1/2磷酸化减弱ET-1诱导的大鼠VSMCs增殖
2014-03-13孙秀才盛艳华冯建章
孙秀才,施 霞,曾 辉,孟 娟,盛艳华,冯建章
(1.深圳市第三人民医院心内科,广东深圳518112;2.广东省心血管病研究所心内科)
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖是动脉粥样硬化、高血压病、支架内再狭窄等多种心血管疾病的共同病理特征。各种生长因子、细胞因子与血管平滑肌细胞表面的受体结合,在细胞内引起一系列复杂的级联反应,致使外界刺激转变为胞内信号并被逐级放大,最终导致DNA合成和细胞的分裂增殖[1-3]。丝裂素活化蛋白激酶(mitogen-activated protein kinase,MAPK)是细胞内多种促细胞增殖信号传递的交汇点和信息的共同通路,在细胞增殖中起关键作用。由内皮素-1(endothelin,ET-1)等许多促VSMCs增殖的有丝分裂刺激都是通过ERK1/2途径起作用[4-5]。姜黄为姜科植物Curcuma longa L的根茎,姜黄素(curcumin)是姜黄的主要有效成分,为天然的酚类抗氧化剂,具有多种分子靶向作用,包括转录因子、生长因子以及受体,细胞活素、酶和基因调控的细胞增殖和凋亡[5-6]。有研究表明[7]姜黄素能抑制血管平滑肌细胞的增殖。为探讨其分子机制,本研究以体外培养的大鼠VSMCs为模型,观察姜黄素对ET-1诱导VSMCs增殖及ERK1/2信号通路的影响。
1 材料与方法
1.1 主要材料
DMEM培养基、胰蛋白酶、胎牛血清购于Gibco公司,内皮素-1、姜黄素购自 Sigma公司,3H-胸苷(放射性比活度28Ci/mmol)中国原子能科学院提供。ERK1/2 Assaykit,NEB公司产品。其他试剂均为国产分析纯。
1.2 VSMCs的原代培养
参照王道生[8]贴块法进行。选用10周龄Wistar kyoto大鼠(中山大学实验动物中心提供)断头处死,取胸主动脉中膜以贴块法培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2孵箱中培养,1周后可见细胞从组织块边缘爬出,2~3周出现致密细胞层,此时即可传代,传代细胞光镜下呈典型的“峰与谷”样生长,细胞抗β-actin抗体鉴定为血管平滑细胞。实验所用的血管平滑肌细胞均为第4~6代的细胞。
1.3 血管平滑肌细胞增殖率的测定
取对数生长期的VSMCs,以2×105/mL细胞浓度接种于6孔培养板,每孔1 mL,每组3孔。以不含血清的细胞培养液培养24 h,使细胞处于静止期后,内皮素组加入ET-1 10-8mol/L,姜黄素组加入ET-1 10-8mol/L与浓度分别为 10-6mol/L、10-5mol/L、10-4mol/L姜黄素,并设对照组。按上述分组处理后孵育24 h,取出6孔板,制成1 mL细胞悬液,取18 μL,假如0.1%胎盼兰 2 μL,染色,在显微镜下用细胞计数板计数活细胞数,每孔计3次,取3孔的均数为细胞计数的结果。
1.4 3H-胸腺密啶掺入(3H-TdR)法测定血管平滑肌的DNA合成量
选择生长良好的第4代培养VSMCs,用0.25%胰酶消化、计数,以2×105/孔的密度接种于96孔板中。用无血清的培养液继续培养24 h,使VSMCs获得同步的细胞生长停止。按组分别加入 ET-1 10-8mol/L,ET-1 10-8mol/L与浓度为10-6mol/L、10-5mol/L、10-4mol/L的姜黄素,并设对照组。培养16 h后,每孔再加入1 mci/mL3H胸腺密啶,孵育12 h后,弃去培养基,PBS冲洗两次,给予胰蛋白酶消化,加入冷PBS终止反应。以0.45 mm微孔滤膜负压抽滤收集细胞,生理盐水和10%三氯醋酸冲洗滤膜,滤膜烘干后置闪烁瓶中,加入闪烁液(PPO/POPOP/二甲苯/无水乙醇)静置过夜,在液闪计数仪上测定3H放射强度,结果以CPM表示。重复测定3次,取均数。
1.5 ERK1/2表达的免疫印迹测定
应用ERK1/2检测试验剂盒进行检测。取静止的VSMCs按组分别分别加入ET-1 10-8mol/L,浓度为10-5mol/L的姜黄素,ET-1 10-8mol/L与浓度为10-5mol/L的姜黄素,并设对照组。反应24 h后,移除原孵育液终止反应。加入100 μL SDS样品缓冲液溶解细胞,迅速刮取细胞并移至试管中,置于冰上。超声处理15s以去除DNA和减少样品粘滞度。在95~100℃中加热5 min,冰上冷却。离心5 min,取蛋白质上清20 mL用10%SDS聚丙烯酰胺电泳分离蛋白质,将已分离的区带用电转移仪转移到PVDF膜上,室温下,用25 mL TBS洗硝化纤维膜5 min。室温下,在25 mL终止缓冲液中孵育膜1 h。15 mL TBS洗膜5 min,共3次。膜中加入适当比例的-抗(1∶1 000稀释)孵育,4℃过。15 mL TBS洗膜,5 min×3次。膜中加入适当比例的二抗孵育1 h。15 mL TBS洗膜5 min×3次。室温下,用10 mL LumiGLO孵育膜1 min,轻搅动。倒掉过剩液体,用薄膜包好,用化学发光法检测蛋白印记条带,结果用影像软件Smartview分析。
1.6 统计学处理
各组数据以均数±标准差表示,多组资料的两两比较用t检验,数据应用SPSS 15.0软件处理,以P<0.05为差别有统计学意义。
2 结 果
2.1 姜黄素对ET-1刺激的血管平滑机细胞增殖及DNA合成的影响
与对照组比较,ET-1组VSMCs计数、3H-TdR的掺入量明显增加(P<0.01),ET-1刺激了VSMCs的增殖和DNA的合成;3个不同剂量的姜黄素组VSMCs计数、3H-TdR与ET-1组比较,均显著降低(P<0.05)。说明ET-1刺激VSMCs增殖,而姜黄素能抑制ET-1刺激VSMCs的增殖。姜黄素抑制ET-1诱导VSMCs增殖呈剂量依赖关系(见表1)。
表1 姜黄素对ET-1诱导血管平滑肌细胞增殖和DNA合成的影响(±s)
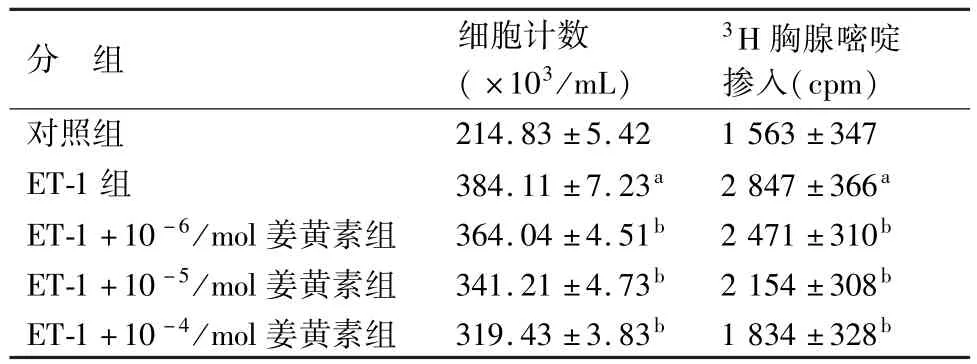
表1 姜黄素对ET-1诱导血管平滑肌细胞增殖和DNA合成的影响(±s)
与对照组比较,a:P<0.01;与ET-1组比较,b:P<0.05
分 组 细胞计数(×103/mL)3H胸腺嘧啶掺入(cpm)对照组214.83±5.42 1 563±347 ET-1组 384.11±7.23a 2 847±366a ET-1+10-6/mol姜黄素组 364.04±4.51b 2 471±310b ET-1+10-5/mol姜黄素组 341.21±4.73b 2 154±308b ET-1+10-4/mol姜黄素组 319.43±3.83b 1 834±328b
2.2 姜黄素对VSMCs磷酸化ERK1/2活性表达的影响
用免疫印迹法检测VSMCs磷酸化ERK1/2的表达,以对照组磷酸化ERK1/2表达的相对值为1,各组磷酸化ERK1/2表达相对值见图1。浓度为10-8mol/L的ET-1刺激VSMCs后,与对照组比较,VSMCs磷酸化ERK1/2活性的表达显著增加(P<0.05);无ET-1存在时,浓度为10-5mol/L的姜黄素组与对照组比较,对磷酸化ERK1/2的表达无影响(P>0.05)。在浓度为10-8mol/L的ET-1刺激后,10-5mol/L的姜黄素对VSMCs磷酸化ERK1/2的表达有显著的抑制作用(P<0.05),提示姜黄素抑制ET-1诱导的VSMCs增殖与阻断磷酸化ERK1/2的表达有关。
3 讨 论

图1 姜黄素对血管平滑肌细胞ERK1/2磷酸化的影响
血管平滑肌细胞是动脉血管壁的主要成份,血管平滑肌细胞向内膜下迁移及过度增生,分泌细胞基质是动脉粥样硬化和支架内再狭窄的病理基础[1,2]。细胞的增殖在细胞数量表现为细胞个数的增加,而细胞本身的生物学行为则表现为蛋白质的合成增加、DNA的复制。其中DNA合成是细胞分裂增殖的主要标志,细胞增殖越快,DNA合成亦越快。胸腺嘧啶是DNA合成的原料,当DNA合成时,3H-TdR掺入率增高,3H-TdR掺入率是反映细胞DNA合成,细胞增殖状态敏感和理想的指标。我们的研究结果显示:经ET-1刺激后,VSMCs计数增多,3H-TdR掺入率明显增加(P<0.05),而不同剂量的姜黄素则能显著抑制VSMCs个数的增多和3HTdR掺入率的增加,提示姜黄素能抑制ET-1诱导的血管平滑肌细胞的增殖。
丝裂素活化蛋白激酶(MAPK)家族是一组广泛存在细胞内具有丝氨酸和苏氨酸双磷酸化能力的蛋白激酶。MAPKs是与细胞增殖关系最为密切的细胞内信号转导蛋白激酶,是细胞外信号与细胞核之间信息转导的共同通路[5,9]。在哺乳动物的细胞中并存多条MAPK信号转导通路,其中ERK1/2(P44/P42 MAPK)途径被认为是经典的MAPK信号转导通路,是细胞因子、生长因子介导细胞增殖效应中最重要的途径[10-11]。ERK1/2在细胞信号转导方面有二大特征:①活化的MAPK通过转位方式进入细胞核,激活其下游底物,主要是一些编码核转录因子的早反应基因(如原癌基因c-fos、c-myc、c-jum和Eng-1等)表达,调控细胞生长反应,导致次级反应基因(如基因ANF、MHC、MLC-2等)的异常表达,影响细胞功能;②MAPK可将多个不同受体系统(如G蛋白 耦联受体和蛋白酪氨酸激酶受体)介导的信号加以整合,起着多种信号的交汇点或共同通路作用。VSMCs增殖与MAPK的激活有关[12-13]。ET-1是VSMCs增殖的强力刺激剂,已发现ET-1引起VSMCs增殖是通过促进MAPK活性上调而实现的[14-15]。
本研究发现,ET-1诱导VSMCs的增殖伴有磷酸化ERK1/2表达的上调,与文献[14]报道一致。姜黄素在抑制ET-1诱导的VSMCs增殖的同时,也抑制磷酸化ERK1/2的表达。表明姜黄素抑制ET-1诱导的VSMCs的增殖,可能与下调细胞增殖信号传导通路中关键的分子—ERK1/2的表达,从而阻断增殖信号在胞内的级联反应有关。
最近Kapakos等[16-17]报道姜黄素可以通过PKB、ERK1/2等通路抑制胰岛素、内皮素等引起的A10血管平滑肌细胞增殖,说明姜黄素的作用有更复杂的机理,2013年Yu等[18]报道了sek-1,skn-1,sir-2.1等通路介导了姜黄素参与氧化应激抵抗,如此看来,姜黄素的更广泛的作用还需要继续深入研究。
[1] Motterlini R,Foreti R,Bassi R,et al.Curcumin,an antioxidant and anti-inflammatory agent induces heme oxygenase-1 and protects endothelial cells against oxidative stress[J].Free Radic Biol Med,2000,28(8):1303-1312.
[2] Ross R.The pathogensis of atherosclerosis:perspective for the 990s[J].Nature,1993,362(29):801-809.
[3] Dzau VJ,Braun-Dullaeus RC,Sedding DG.Vascular proliferation and atherosclerosis:new perpective and therapeutic strategies[J].Nat Med,2002,8(11):1249-1256.
[4] Yu PJ,Ferrari G,Pirelli L,et al.Vascular injury and modulation of MAPK:a targeted approach to therapy of restenosis[J].Cell Signal,2007,19:1359-1371.
[5] Begum N,Hockman S,Manganiello VC.Phosphodiesterase 3a(PDE3A)deletion suppresses proliferation of culture murine vascular smooth muscle cells via inhibition of mitogen-activated protein kinase signaling and alterations in critical cell cycle regulatory protein[J].Biol Chem,2011,286(29):26238-26249.
[6] 宋露萍,廖端芳.姜黄素治疗动脉粥样硬化性心血管疾病的研究进展 [J].中南医学科学杂志,2013,41(4):417-420.
[7] Pae Ho,Jeong GS,Jeong SO,et al.Roles of heme oxygenase-1 in curcumin-induced growth inhibition in rat smooth musle cell[J].Exp Mol Med,2007,39(3):267-277.
[8] 徐叔云,卞如濂,陈修,等.药理实验方法[M].3版.北京:人民卫生出版社,2001:573-576.
[9] 许研,刘海梅,徐进文,等.ERK1/2蛋白在17β-雌二醇抑制睾酮诱导的心肌细胞肥大反应中的作用[J].中国动脉硬化杂志,2012,20(10):876-880.
[10] Dong LH,Wen JK,Miao SB,et al.Baicalin inhibits PDGF-BB-stimulated vscular smooth muscle cell proliferation through suppressing,PDGFB-ERK signaling and increase p27 accumulation and prevents injury-induced neointimal hyerplasia[J].Cell Res,2010,20(11):1252-1262.
[11] Lin SJ,Shyue SK,Shih MC,et al.Superoxide dismutase and catalase inhibit oxidized low-density lipoprotein-induced human aortic smooth muscle cell proliferation:role of cell-cycle regulation,mitogen-activated protein kinase,and transcription factors[J].Atherosclerosis,2007,190(1):124-349.
[12] Raman M,Chen W,Cobb MH.Differential regulation and properties of MAPKs[J].Oncogene,2007,26(22):1439-1455.
[13] Boutros T,Chevet C,Metrakos P.Mitogen-activated protein kinase phosphatase regulation:roles in cell growth,death and cancer[J].Pharmacol Rev,2008,60(3):261-310.
[14] Landau D,Eshet R,Troib A,et al.Increased renal Akt/mTOR and MAPK signaling in type1 diabetes in t he absence of IGF type 1 receptor activation[J].Endocrine,2009,36(1):126-134.
[15] Merkus D,Duncker DJ,Chilian WM.Metobolic regulation of coronary vascular tone:role of endothelin-1[J].Am J Physiol Heart Circ Physiol,2002,283(5):191-192.
[16] Kapakos G,Youreva V,Srivastava AK.Attenuation of endothelin-1-induced PKB and ERK1/2 signaling,as well as Egr-1 expression,by curcumin in A-10 vascular smooth muscle cells[J].Can J Physiol Pharmacol,2012,90(9):1277-1285.
[17] Youreva V,Kapakos G,Srivastava AK.Insulin-like growth-factor-1-induced PKB signaling and Egr-1 expression is inhibited by curcumin in A-10 vascular smooth muscle cells[J].Can J Physiol Pharmacol,2013,91(3):241-247.
[18] Yu CW,Wei CC,Liao VH.Curcumin-mediated oxidative stress resistance in Caenorhabditis elegans is modulated by age-1,akt-1,pdk-1,osr-1,unc-43,sek-1,skn-1,sir-2.1,and mev-1[J].Free Radic Res,2014,48(3):371-379.
