酶差速脱壁法联合差速贴壁法分离人颊黏膜上皮干细胞△
2014-03-12张鸿黄挺
张鸿 黄挺
临床上严重的角膜缘干细胞缺乏最终导致患者失明,自体角膜缘干细胞移植治疗角膜缘干细胞衰竭效果较好,然而数量有限。口腔黏膜上皮细胞移植较角膜缘细胞移植存在容易生长新生血管的缺点[1],异体角膜缘移植术后排斥率较高,倘若将异体角膜缘干细胞与自体口腔颊黏膜上皮干细胞联合培养,在前者微环境下诱导后者分化为角膜上皮干细胞,或许既能减少新生血管形成,降低排斥反应,又能获得良好的术后长期疗效。尽管目前关于分离培养口腔上皮细胞的研究很多,然而探讨如何有效分离人颊黏膜上皮干细胞的研究较少。本实验则采用酶差速脱壁法联合差速贴壁法分离人颊黏膜上皮干细胞,为转分化成角膜上皮干细胞的后续研究成功获取种子细胞。
1 材料与方法
1.1 材料
1.1.1 取材及主要试剂 人颊黏膜上皮材料来源于捐献器官的供体,供体年龄为20~50岁。Epilife培养基、中性蛋白酶DispaseⅡ、TrypLE Express消化液(美国Gibco);兔抗人P63多克隆抗体、兔抗人CK13多克隆抗体、Delight山羊抗兔二抗(美国Bioworld);兔抗人CK12单克隆抗体(英国Abcam);Hoechst33342(美国Sigma)。
1.1.2 主要仪器 恒温CO2细胞培养箱(美国NAPCO公司);微量移液器(Eppendorf公司);NiKon ECLIPSE 80i荧光显微镜(日本);Olympus-CK40倒置相差显微镜(日本);Olympus-GT51显微照相系统(日本)等。
1.2 方法
1.2.1 原代培养 将双抗处理过的人颊黏膜组织块用眼科剪修剪去多余黏膜下组织,清洗后置于1.2 U·mL-1DispaseⅡ中,4℃冰箱消化16 h。显微无齿镊分离表层上皮和上皮下层,将表层上皮置于2.5 g·L-1胰蛋白酶溶液中,37℃消化10~15 min。终止消化并吹打成单细胞悬液,离心后加入Epilife无血清培养基,调整细胞密度约500×103个·mL-1,接种培养。48 h后首次换液,以后每2~3 d换液。培养2 d后每日在倒置相差显微镜下观察细胞形态及生长状况,至细胞长满培养皿备用。
1.2.2 传代培养 原代细胞长满培养皿后进行传代,漂洗细胞3次后加入37℃预热的TrypLE Express消化液消化获得单细胞悬液,离心,此步将细胞分为两组,第1组直接加入Epilife培养基培养,第2组行CFSE荧光标记后再加入Epilife培养基培养,1∶2比例进行传代。48 h后换液,以后每2~3 d换液,培养7~8 d传代。
1.2.3 绘制生长曲线 对生长状况较好的第2代CFSE标记组细胞及未经CFSE标记组细胞自培养48 h开始计数,连续8 d,绘制生长曲线。
1.2.4 分离培养人颊黏膜上皮干细胞 预先用DMEM配备浓度为20 mg·L-1的纤维结合蛋白,铺满整个培养皿进行包被,1 h后吸去上层液体,紫外灯照射2 h,超净台吹干待用。酶差速脱壁法:第1代细胞长满培养皿后,用TrypLE Express消化液消化1 min,立即吸出脱壁细胞加入培养基终止消化,离心制成5×105个·mL-1细胞悬液。差速贴壁法:将酶差速脱壁法制得的细胞悬液加入到纤维结合蛋白预先包被的培养皿中,快速吸附20 min后弃去未贴壁细胞,已贴壁细胞上加入培养液开始培养,48 h后换液,以后每2~3 d换液,每天在倒置显微镜下观察细胞的生长情况。每次传代均联合酶差速脱壁法及差速贴壁法进行分离纯化。
1.2.5 免疫荧光鉴定 细胞分为两组,第Ⅰ组是未经联合分离法传代的第2代细胞,第Ⅱ组则是经联合分离法传代的第2代细胞。预先将第2代细胞制成细胞爬片,2~3 d后进行免疫荧光分析,冰丙酮固定10 min,PBS漂洗3次,每次5 min,50 g·L-1BSA封闭30 min,加入BSA稀释的一抗,于4℃过夜,PBS漂洗3次,每次5 min,加入BSA稀释的二抗,于37℃杂交45 min,PBS漂洗3次,每次5 min,Hoechst33342染色2 min,抗淬灭封片剂封片,荧光显微镜观测P63、CK12、CK13的表达。
2 结果
2.1 原代培养 DispaseⅡ及胰蛋白酶双酶消化法获得的人颊黏膜上皮细胞在倒置显微镜下观察,贴壁前为漂浮的体积较小的圆形细胞,折光性强,胞浆透亮,边界轮廓清晰、光滑,5 min后可见部分细胞开始贴壁。12 h后颊黏膜上皮细胞均匀贴壁于60 mm直径塑料培养皿,细胞由圆形伸展为卵圆形,细胞大小变为贴壁前2倍左右,大部分细胞形态相似、边界清晰,核圆而清楚,少部分细胞贴壁后形状不规则、折光性差、较卵圆形细胞更大。48~72 h细胞成簇样生长,可见核分裂象。3~4 d细胞开始生长旺盛,8~9 d后细胞基本达到融合,细胞形态、大小差异小,呈典型铺路石样,未见明显成纤维细胞生长。
2.2 传代培养
2.2.1 未经CFSE标记组细胞 原代细胞长满培养皿后,倒置显微镜下观察到细胞5~10 min开始贴壁。随着培养时间延长,细胞体积逐渐增大,胞核与胞浆比值降低,细胞增殖能力逐渐减弱。第1-2代细胞形态与原代细胞相似,细胞呈卵圆形、短梭状,小部分细胞形态不规则,可见多角形、圆形细胞,未见明显成纤维细胞(图1)。第3-4代细胞贴壁后折光性明显下降,胞浆颜色加深,核浆比变小,细胞增殖缓慢,卵圆形、短梭状细胞减少,圆形细胞、不规则细胞、巨细胞增多。第5代细胞形态不规则,以巨细胞为主,视野中未见早期的卵圆形、短梭状细胞,部分细胞伸出伪足和周围细胞连接,细胞逐渐走向衰老,胞内空泡、颗粒增多,细胞边界模糊。
2.2.2 CFSE标记组细胞 荧光染色后的细胞置倒置显微镜下观察到,细胞5~10 min开始贴壁;荧光倒置显微镜下观察到,贴壁细胞呈现绿色荧光,细胞形态可辨,与普通倒置显微镜下对比,可见到细胞的CFSE荧光染色率达到100%。经CFSE荧光染色的颊黏膜上皮细胞在体外传代,其形态、生长速度与未经CFSE染色的颊黏膜上皮细胞一致。人颊黏膜上皮细胞第1-2代,细胞绿色荧光较强,边界荧光清楚,形态可辨,荧光标记率达100%。人颊黏膜上皮细胞第3-4代,出现巨细胞。传至第5代,细胞扁平散大,边界模糊,形态不规则,胞内黑色颗粒明显增多,荧光较前代稍微减弱,但荧光标记率仍>98%。

Figure 1 Morphology of passage 2 cells 第2代细胞形态学
2.3 绘制生长曲线 CFSE标记组细胞与未经CFSE标记组细胞在无血清Epilife培养基下的生长状况较为一致,均生长迅速,3~7 d呈对数增长,之后进入平台期,增殖减慢(图2)。

Figure 2 Growth curves of groups marked with or without CFSE CFSE标记组与未标记组细胞生长曲线
2.4 分离培养人颊黏膜上皮干细胞 经酶差速脱壁法获取的细胞悬液,加入纤维结合蛋白预先包被的塑料培养皿内,在倒置相差显微镜下可见部分细胞贴壁,贴壁细胞分散均匀、圆形、折光性较强,快速贴附20 min后,吸去未贴壁细胞。24 h后显微镜下观察到小部分细胞悬浮,进行换液,其余细胞伸展为卵圆形,细胞较小,折光性强。隔日换液,培养3~4 d,克隆形成(图3),培养6~7 d细胞铺满培养皿,呈典型铺路石状。而对20 min后未贴壁细胞单独培养时可见最早贴壁的细胞较大,折光性稍差,体外培养48 h仍无克隆样生长。
2.5 免疫荧光鉴定 未经联合分离法传代的第2代细胞免疫荧光鉴定发现,CK13阳性、P63阴性、CK12阴性。经联合分离法传代的第2代细胞免疫荧光鉴定发现,P63阳性(图4)、CK13阳性、CK12阴性。
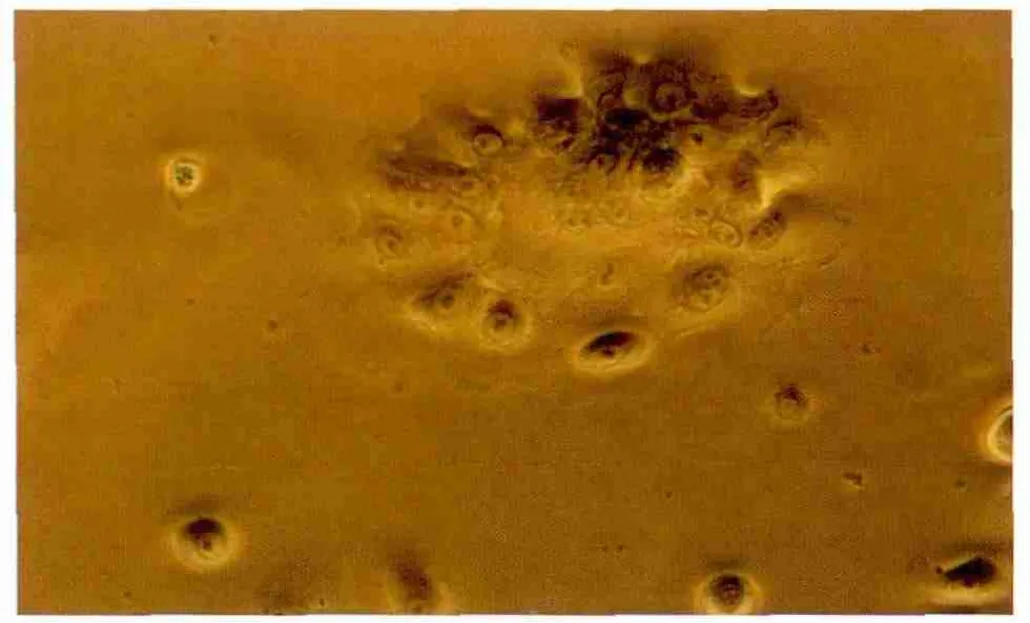
Figure 3 A clone of buccal mucosal epithelial stem cells 颊黏膜上皮干细胞形成小克隆

Figure 4 Positive staining of P63 in passage 2 cells cultured with combined partition methods 经联合分离法传代的第2代细胞免疫荧光P63阳性
3 讨论
组织工程的成熟发展为人口腔黏膜上皮细胞体外培养体系的建立奠定了基础。将体外培养的口腔黏膜上皮细胞种植在一系列载体上形成复层上皮[2-3]或者直接构建膜片[4],是组织工程口腔黏膜的研究热点。既往实验联合载体支撑、血清培养基和滋养层细胞进行培养,这些因素在一定程度上促进了细胞不同程度的分化,同时也增加了动物源性污染及免疫排斥反应的可能性[5]。本实验在采用经典的Dispase II和胰蛋白酶双酶消化法获得上皮细胞悬液后,加入到Epilife无血清培养基及无动物源性滋养层细胞的培养体系中进行培养。在传代培养中,用TrypLE Express消化液取代传统的胰蛋白酶。TrypLE Express是一种非动物源性的消化酶,它的作用性质温和,对细胞造成的损伤更小,能够应用在有血清或者无血清培养基培养的不同细胞。然而,在对口腔黏膜上皮组织块消化的步骤中,TrypLE Express消化下来的细胞较少,因而我们仅仅将TrypLE Express应用在传代消化的过程中,可能是因为培养皿上培养的细胞较组织块上黏附的细胞相对容易获取所致。此法培养的口腔黏膜上皮细胞中未见明显成纤维细胞生长,细胞贴壁迅速,活性良好,而且细胞数量丰富,生长旺盛,第1-2代细胞形态大小较均一,共可传代5次。
在后续研究联合培养异体角膜缘干细胞与自体口腔黏膜上皮干细胞之前,本实验需要一种荧光标记物对这两种细胞进行区分。活细胞染料CFSE可以不可逆地和细胞内蛋白的Lysine残基或其他氨基发生结合反应从而标记这些蛋白,它有着非常广泛的应用[6-7]。本实验尝试应用CFSE对颊黏膜上皮细胞进行标记及体外培养,在荧光显微镜下观察到细胞标记率达到100%,传代5次以后在荧光倒置显微镜下仍可见到绿色荧光,第5代细胞标记率仍>98%。与未进行染色标记的颊黏膜上皮细胞比较,我们发现两种情况下的上皮细胞在细胞形态、生长曲线、传代次数方面极其相似,是本实验中理想的荧光标记示踪物。
寻找到合适的荧光标记示踪物之后,我们对口腔黏膜上皮干细胞的分离纯化技术进行探讨。干细胞的分离方法有密度梯度离心法、差速贴壁法、酶差速脱壁消化法、流式细胞仪分选、磁珠分离[8]等。其中密度梯度离心法、流式细胞仪、磁珠分离技术相对耗时耗力,分离的某些干细胞活性欠佳,或者获得的数量较少,这些都会影响进一步的实验。快速吸附法可以分离干细胞与滋养层细胞、成纤维细胞,并且不会影响干细胞的多能性,还具有操作简单、耗时短、吸附干细胞多、细胞活性不受影响的特点。酶差速脱壁法具备类似的优点。利用干细胞的这些特性[8-9],本研究采用酶差速脱壁消化法与差速贴壁法结合的联合分离法。在应用差速贴壁法技术的过程中,不可或缺的则是包被培养皿的材料,例如胶原、明胶、纤维结合素、纤维结合素-胶原复合体、多聚赖氨酸、层粘连蛋白等。其中吸附作用最好的是Ⅳ型胶原,它对上皮干细胞吸附性好,促进更多克隆形成,在回收后可以重复利用,并且不影响干细胞的黏附性[10-11]。但是胶原价钱昂贵,因而在实验或者临床上的应用受到了一定限制。Hirayama等[12]报道,纤维结合蛋白包被的培养皿培养的口腔黏膜上皮细胞较羊膜载体培养的细胞移植有更高的成功率,术后能获得更好的最佳矫正视力及更少新生血管生长。因此本实验利用纤维结合蛋白包被培养皿的差速贴壁法联合酶差速脱壁法对颊黏膜上皮干细胞进行分离纯化,取得了一定的效果。
在未采用联合分离法进行传代培养以及采用了该联合分离法之后,我们进一步在免疫学上对细胞的干细胞特性进行了鉴定。未经联合分离法传代的第2代颊黏膜上皮细胞细胞免疫荧光检测到CK13阳性、P63阴性、CK12阴性,证明了所培养的细胞是口腔非角化上皮细胞。本研究中口腔黏膜组织并非现场取材培养而是来源于尸体,从异地取材到实验室处理需要一定的时间,加上干细胞的比例本来就低以及在消化过程中又损失了一定数量的干细胞,这些原因导致培养的干细胞较分散,密度非常低。极少的干细胞位于较大密度的高分化的上皮细胞内,受周围细胞及细胞外基质的影响较大[13],加速了干细胞特性的丧失,上述原因可能导致了干细胞标记物P63的阴性表达。而通过联合分离法传代的第2代颊黏膜上皮干细胞,极大提高了干细胞吸附聚集的密度,免疫荧光检测到P63阳性、CK13阳性、CK12阴性,证明联合分离法获得了一定数量的干细胞。本次实验中发现并非所有细胞都为干细胞,这可能与干细胞体外最佳培养条件未知、分离纯化次数不够、干细胞在体外培养过程中仍有一定程度分化等原因有关。
目前为止,关于口腔黏膜上皮干细胞的研究报道较少。Nakamura等[3]首次发表口腔黏膜上皮干细胞体外培养及移植于眼表的文章,但是该研究中扩增培养的是细胞混合液,并未说明细胞来源于口腔的具体位置,也未进行干细胞的分离纯化。本实验初步证明了CFSE荧光标记人颊黏膜上皮细胞的高效性、安全性,通过将酶差速脱壁法与差速贴壁法相结合的联合分离法,为转分化角膜上皮干细胞获得了一定数量呈克隆增殖的干细胞[14]。这为联合培养异体角膜缘干细胞及自体颊黏膜上皮干细胞并诱导后者分化为角膜上皮干细胞的后续研究提供了依据,为干细胞转分化技术在角膜缘干细胞缺乏患者中的应用提供新的研究思路。
1 Kanayama S,Nishida K,Yamato M,Hayashi R,Sugiyama H,Soma T,et al.Analysis of angiogenesis induced by cultured corneal and oral mucosal epithelial cell sheets in vitro[J].Exp Eye Res,2007,85(6): 772-781.
2 Izumi K,Feinberg SE,Terashi H,Marcelo CL.Evaluation of transplanted tissue-engineered oral mucosa equivalents in severe combined immuno-deficient mice[J].Tissue Eng,2003,9(1):163-174.
3 Nakamura T,Kinoshita S.Ocular surface reconstruction using cultivated mucosal epithelial stem cells[J].Cornea,2003,22(1):75-80.
4 Lauer G.Autografting of feeder-cell free cultured gingival epithelium: Method and clinical application[J].J Craniomaxillofac Surg,1994,22 (1):18-22.
5 刘雪梅,朱桂金.人胚胎干细胞培养系统的研究进展[J].生命科学,2007,19(3):306-310.
6 Evrard B,Dosgilbert A,Jacquemot N,Demeocq F,Gilles T,Chassagne J,et al.CFSE flow cytometric quantification of lymphocytic proliferation in extracorporeal photopheresis:Use for quality control[J].Transfus Apher Sci,2010,42(1):11-19.
7 肇静娴,曾耀英,何贤辉,王南,狄静芳,曾山.活体染料CFDA-SE在淋巴细胞增殖研究中的应用[J].细胞与分子免疫学杂志,2003,19(2):109-111.
8 Jones PH,Watt FM.Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression[J].Cell,1993,73(4):713-724.
9 徐超,黄荣华,俞宏,赵小立,陆永良,戴利成,等.分离MEF和ES细胞的差速贴壁法研究[J].分子细胞生物学报,2006,39(5): 477-481.
10刘虎仙,贾赤宇,付小兵,胡大海,谢晓繁.重复利用Ⅳ型胶原以差速贴壁法分选表皮干细胞[J].中国临床康复,2006,10(13): 38-40.
11 Takagi R,Yamato M,Kushida A,Nishida K,Okano T.Profiling of extracellular matrix and cadherin family gene expression in mouse feeder layer cells:Type VI collagen is a candidate molecule inducing the colony formation of epithelial cells[J].Tissue Eng Part A,2012,18 (23-24):2539-2548.
12 Hirayama M,Satake Y,Higa K,Yamaguchi T,Shimazaki J.Transplantation of cultivated oral mucosal epithelium prepared in fibrin-coated culture dishes[J].Invest Ophthalmol Vis Sci,2012,53(3):1602-1609.
13 Menzel-Severing J,Polisetti N,Schlotzer-Schrehardt U,Kruse F.Limbal stem cells and their niche:Implications for bioengineered tissue constructs[J].Klin Monbl Augenheilkd,2012,229(12):1191-1197.
14 Tao Q,Qiao B,Su K,Lü B,Zheng CQ.Isolation,culture and identification of rat buccal mucosa stem cells[J].Zhonghua Kouqiang Yixue Zazhi,2008,43(5):311-313.
