腺苷预处理对大鼠脑缺血再灌注损伤后VEGF 的表达
2014-03-11王建平申小龙
尉 娜,王建平,申小龙,谭 军
缺血性脑血管疾病是一类常见病、多发病,其致残率与病死率都很高,极大地危害着人们的身体健康,而脑缺血同时也是多种脑损伤疾病共同的病理生理基础,如何减轻脑缺血后的神经损伤、提高脑组织对缺血的耐受,一直是临床预防和治疗缺血性脑血管疾病的重点和难点。脑缺血耐受的提出为防止脑缺血再灌注损伤开拓了新的研究领域,缺血预处理对大脑的保护作用对研究内源性神经保护机制和神经保护治疗方法提供了新的研究方向。然而在实际的临床工作中在患者发生脑梗死之前对大脑进行短暂的缺血预处理是不现实的,因此临床工作中更多应该选择药物进行预处理,本实验中我们选用腺苷作为预处理的药物。用腺苷进行预处理后制备大脑中动脉脑缺血模型,再灌注后选择不同时间点通过HE 染色后光镜下观察脑缺血再灌注损伤区域脑组织的病理变化,通过TTC 染色观察脑梗死体积,运用免疫组织化学法检测血管内皮生长因子(VEGF)的表达,探讨腺苷预处理在脑缺血再灌注损伤中可能的保护机制,为临床应用腺苷预防和治疗缺血性脑血管疾病提供理论依据,同时为减轻脑梗死损伤提供一条治疗思路。
1 材料和方法
1.1 实验动物及分组 健康SD 大鼠60 只(雄性,体重250~300 g)由新乡医学院实验动物中心提供。随机分为假手术组(F 组)、缺血再灌注组(IR 组)、腺苷预处理组(AP 组)共3 组,这3 组根据再灌注时间随机分为2 h、6 h、24 h、72 h 4 个亚组,每亚组5 只。F 组和IR 组大鼠于手术前3 d 开始腹腔注射生理盐水,每天一次,每次2 ml;AP 组大鼠于手术前3 d 开始腹腔注射腺苷注射液,剂量为1.5 mg/kg,生理盐水稀释到2 ml,每天一次。
1.2 主要试剂 腺苷注射液(沈阳光大制药有限公司,批准文号为国药准字H20030320、规格为6 mg/2 ml);VEGF 多克隆抗体、即用型SABC 免疫组化试剂盒、DAB 显色试剂盒(武汉博士德生物工程有限公司);Nikon MODEL YS100 显微镜(Nikon);照相显微镜HPIAS-2000 显微图像定量分析系统(郑州太阳电子科技公司)。
1.3 实验方法
1.3.1 大鼠局灶性脑缺血再灌注模型的建立本实验采用尼龙线栓塞法制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型[1,2],并加以改良。将SD 大鼠腹腔注射10%水合氯醛溶液(3 ml/kg)麻醉成功后,在颈正中线处纵向切开皮肤,分离右侧颈总动脉(common carotid artery,CCA),向近端分离出颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。结扎并离断ECA。ICA 分离至颅底,将其分支结扎离断,仅保留ICA 入颅的主干通畅。用动脉夹暂时夹闭ICA 和CCA,在ECA 残端剪一小口,插入准备好的尼龙线,到达大脑中动脉(middle cerebral artery,MCA)的起始部,插入使其到达大脑前动脉(anterior cerebral artery,ACA),进入深度约18 mm,阻断MCA 血流。在ECA残端插线处打结固定尼龙线,打开动脉夹,将尼龙线尾端用黑色记号笔涂黑后留于皮肤外1 cm,消毒并逐层缝合。阻断MCA 2 h 后,轻轻向外抽拉尼龙线至ECA 主干,使大脑动脉Willis 环和MCA 恢复血供,保持体温至清醒。大鼠术后单笼饲养,自由饮水和进食,并给予抗生素及补液治疗。
1.3.2 切片制备 各组大鼠按照时间点取出大脑至培养皿中,切取视交叉前后各2 mm 厚的脑组织,放入4% 多聚甲醛磷酸盐缓冲溶液(pH=7.4)中固定24 h 后,脱水透明,石蜡包埋切片,用于HE 染色及VEGF 免疫组化染色。
1.3.3 TTC 染色 处死大鼠取出脑组织放入-20 ℃冰箱,待组织冻硬后进行冠状切片(片厚2 mm)。将切片放入2%的2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)溶液中,37℃避光染色30 min。用4%多聚甲醛固定24 h 后拍照,正常脑组织染色后呈鲜红色,而梗死区呈苍白色。在脑的同一部位比较各组之间梗死体积的大小,以反映脑梗死后损伤的程度。
1.3.4 VEGF 免疫组化染色方法 按照VEGF免疫组织化学染色试剂盒说明书进行,光镜观察并应用HPIAS-2000 显微图像处理系统采集图片,每张切片随机取8~10 个200×视野,计数VEGF 阳性细胞数,求其平均值为该张切片VEGF 阳性细胞数。
1.4 统计学方法分析 使用SPSS13.0 统计软件进行统计学分析,结果用均数±标准差(±s)表示,数值变量资料的分析采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著差(LSD)t 检验,检验水平α=0.05,P<0.05 表示有统计学差异。
2 结果
2.1 TTC 染色 TTC 是一种水溶性盐类物质,它能与有活性的线粒体脱氢酶反应生成深红色脂溶性物质,在死亡细胞内由于线粒体脱氢酶失活所以与TTC不反应和显色,故正常组织被染成均匀的桔红色,而梗死灶呈白色,二者界限清晰可见。假手术组TTC 染色呈均匀桔红色,无缺血灶。缺血再灌注组脑组织TTC染色都出现大面积的白色区,脑梗死灶明显。腺苷预处理组白色区域较缺血再灌注组明显缩小(见图1)。
2.2 VEGF 蛋白表达情况 假手术组:大鼠脑组织脉络丛可见少量VEGF 阳性表达细胞,其余脑组织偶见VEGF 阳性表达,各亚组之间未见明显差异(见图2);随着脑组织缺血时间延长,缺血再灌注组和腺苷预处理组VEGF 阳性表达呈现逐渐增高后又逐渐降低的变化,2 h 开始增高,6 h 继续增高,24 h 达到高峰,72 h 略有下降,但处于较高水平;缺血再灌注组:在大鼠的大脑皮层、纹状体等部位的神经元及神经胶质细胞阳性表达明显,以缺血梗死灶周边区表达最明显(见图3~图6);腺苷预处理组:腺苷预处理各亚组较缺血再灌注各亚组阳性表达形态及部位均相似,阳性表达较缺血再灌注组增高(见图7~图10)。各组大鼠脑组织VEGF 阳性表达强度不同,F 组各亚组中VEGF 阳性表达无明显差别。IR 组及AP 组VEGF 阳性表达从2 h 开始逐渐增强,到24 h 达到高峰,72 h 时均有所减弱。2 h 时IR组和AP 组积分光密度值无明显差别(P>0.05)。6 h、24 h 及72 h 时AP 组各亚组与IR 组各相应亚组比较明显增高(P<0.05)(见表1)。
表1 各组别不同时间点VEGF 表达的平均积分光密度(±s)

表1 各组别不同时间点VEGF 表达的平均积分光密度(±s)
注:与F 组比较* P>0.05,△P ﹤0.05;与IR 组比较#P>0.05,▽P ﹤0.05
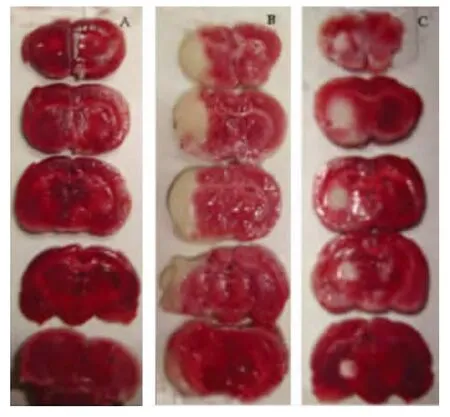
图1 不同组别TTC 染色结果
3 讨论
脑血管病是当今社会发病率、死亡率极高的一种疾病,其发病率在我国有明显增加的趋势且已成为死因构成的重要原因之一。缺血性脑血管病是脑血管病中较为常见的一类,极大地危害着人们的身体健康,而脑缺血同时也是多种脑损伤疾病共同的病理生理基础,如何减轻脑缺血后的神经损伤、提高脑组织对缺血的耐受,一直是临床研究的重点和难点,也是临床预防和治疗缺血性脑血管疾病的发展方向。短暂性脑缺血发作,即缺血预处理(ischemia preconditioning,IPC)对脑细胞有保护作用,可以减轻缺血组织的病变程度,诱导脑缺血耐受(ischemia tolerance,IT),可抵抗以后严重的脑缺血。1999 年国外对141 例有或无TIA 史的卒中患者进行回顾性病例对照研究,结论支持TIA 诱导脑缺血耐受。已有的研究结果表明,缺血耐受是迄今已知的最强的内源性保护机制,是机体抵抗缺血再灌注(ischemia-reperfusion,IR)损伤的一种生物现象[1]。脑缺血耐受的提出为防止脑缺血再灌注损伤开拓了新的研究领域,缺血预处理对大脑的保护作用、对研究内源性神经保护机制和神经保护治疗方法提供了新的研究方向。然而在实际的临床工作中在患者发生脑损伤之前对大脑进行短暂的缺血预处理是不现实的,因此临床工作中预处理更多应该选择药物来实现。药物预处理安全、方便、易于控制剂量,用药物替代IPC 进行预处理以达到神经保护的目的,可能将在临床预防和治疗缺血性脑血管病、脑损伤、器官移植等方面发挥重要作用。本实验中选择腺苷作为治疗脑缺血再灌注损伤预处理的药物。脑缺血缺氧时引起腺苷(腺嘌呤核苷)释放,腺苷作为一种神经递质与G 蛋白偶联受体(主要是受体A1)结合后,激活ATP 依赖的钾离子通道,抑制兴奋性氨基酸释放,阻止兴奋性氨基酸诱导的神经元除极效应,降低细胞膜对钙离子的通透性,扩张血管,抑制炎性细胞黏附和浸润,抑制血小板聚集,减轻炎性细胞、自由基导致的血管内皮损伤[2]。腺苷是一种内源性神经保护剂,其发挥神经保护作用主要是通过A1 受体阻滞Ca2+内流,抑制谷氨酸和天门冬氨酸的释放。Heurteaux 等[3]发现应用A1 受体拮抗剂可以完全阻断缺血预处理的保护作用。近年来国内外少有腺苷预处理对脑缺血的报道,本课题组应用腺苷预防治疗脑缺血再灌注损伤亦获得了良好的效果。
近年来,研究表明,受损的脑可出现神奇的再塑性,神经元发生的机制均与血管再通有重要的相关性,所以血管生成可以为大脑修复提供新的思路[4,5]。脑缺血再灌注损伤后,提高神经系统的血管再生可以促进损伤神经元的回访,减轻脑缺血的后遗症,改善脑缺血后康复的临床效果。促进血管生成机制可能涉及多个因素,主要包括生长因子、粘附分子和神经干细胞等。许多生长因子可能参与了血管生成,最具有代表性的是血管内皮生长因子(vascular endothelial growth factor,VEGF)。VEGF 是一种高度特异的血管内皮细胞有丝分裂素,具有诱导血管生成的功能,VEGF 还可间接地促进神经再生、学习、记忆并抑制细胞凋亡[6,7]。目前己经证实,缺血及移植损伤能显著上调神经元及星状细胞VEGF 的表达[8],这与我们在实验中观察到的VEGF 表达部位是一致的。在缺血区域的神经元、胶质细胞、与中枢神经系统炎症反应有关的细胞包括反应性星形胶质细胞、小胶质细胞VEGF 的表达均明显增加,提示其可能参与中枢神经系统的炎症反应。因此,对中枢及外周神经系统的创伤有可能在一定程度上触发由VEGF 介导的细胞发育事件,通过正常的血管灌流来调节生理功能以满足代谢要求。最近有报道在脊髓挫伤模型中单次应用一定剂量的VEGF,能明显促进行为学功能恢复[9],且与VEGF 受体表达增高密切相关,主要表现为组织凋亡减少、血管密度增加。这说明VEGF 既有的血管形成作用,又有潜在的神经营养作用。
本实验用腺苷进行预处理后制备大脑中动脉脑缺血模型,再灌注后选择不同时间点通过TTC 染色观察脑梗死体积和运用免疫组织化学法检测血管内皮生长因子(VEGF)的表达,探讨腺苷预处理在脑缺血再灌注损伤中可能的保护机制,为临床应用腺苷预防和治疗缺血性脑血管疾病提供理论依据,同时为减轻脑梗死损伤提供一条治疗思路。
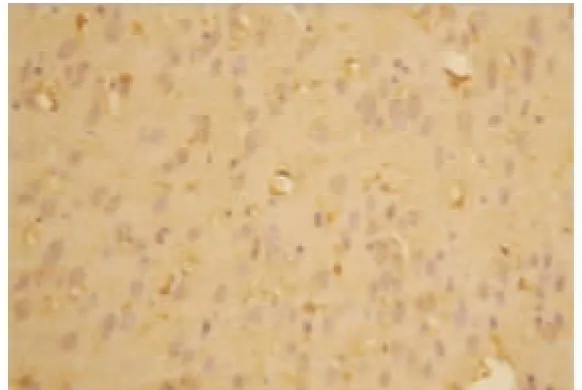
图2 F 组VEGF 的表达(×200)
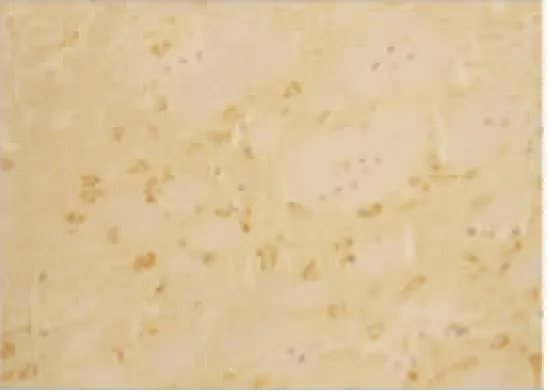
图3 IR 组2 h VEGF 的表达(×200)
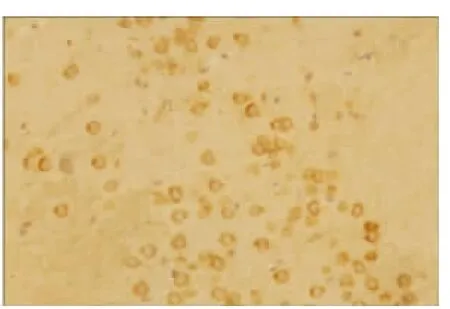
图4 IR 组6 h VEGF 的表达(×200)

图5 IR 组24 h VEGF 的表达(×200)
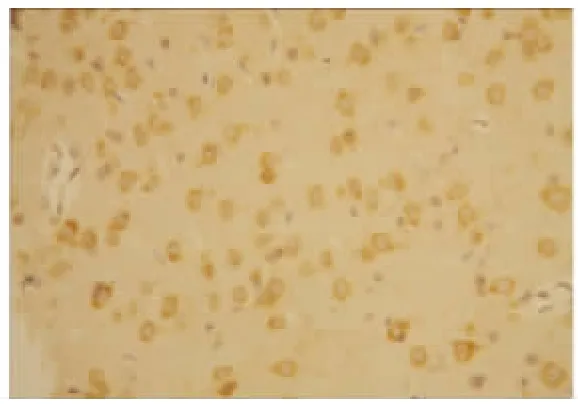
图6 IR 组72 h VEGF 的表达(×200)
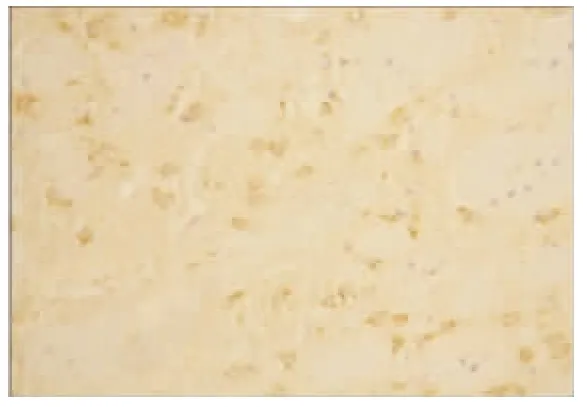
图7 AP 组2 h VEGF 的表达(×200)
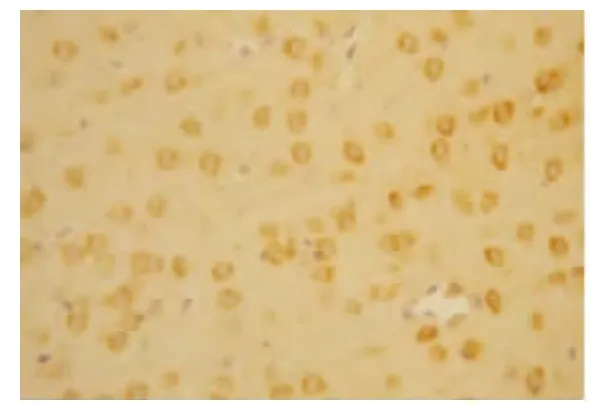
图8 AP 组6 h VEGF 的表达(×200)

图9 AP 组24 h VEGF 的表达(×200)
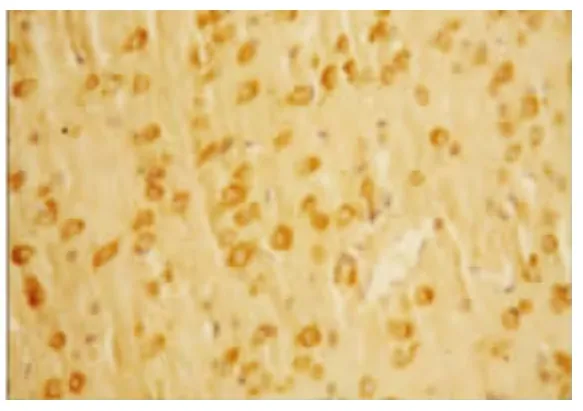
图10 AP 组72 h VEGF 的表达(×200)
[1]Kitagawa K,Matsumoto M,Tagaya M,et al.Ischemic tolerance phe-nomenon foundin the brain[J].Brain Res,1990,528(1):21-24.
[2]Abele AE,Miller RJ.Potassium channel activators abolish excitotoxicity in cultured hippocampal pyramidal neurons[J].Neurosci Lett,1990,11(5):195-200.
[3]Heurteaux C,lauritzen I,Widmann C,et al.Essential role of asenosine,adenosine A1 receptors,and ATP-sensitive K+channels in cerebral ischemic precondition[J].Proc Natl Acad Sci USA,1995,92(10):4666-4670.
[4]Chopp M,Zhang ZG,Jiang Q.Neurogenesis,angiogenesis and MRI indices of functional recovery from stroke[J].Stroke,2007,38(2):827-831.
[5]Chopp M,Li Y,Zhang J.Plasticity and remodeling of brain[J].J Neurol Sci,2008,265(1~2):97-101.
[6]Cao L,Jiao X,Zuzga DS,et al.VEGF links hippocampal activity with neurogenesis,learning and memory[J].Nat Genet,2004,36(8):827-835.
[7]Greenberg DA,Jin K.VEGF and ALS:The luckiest growth factor[J].Trends Mol Med,2004,10(1):1-3.
[8]Lennmyr F,Ata KA,Funa K,et al.Expression of vascular endothelial growth factor(VEGF)and its receptors(Flt-1andFlk-l)following permanent and transient occlusion of the middle cerebral artery in the rat[J].J Neuropathol Exp Neurol,1998,57(9):874-882.
[9]Widenfalk J,Lipson A,Jubran M,et al.Vascular endothelial growth factor improves functional outcome and decreases secondary degeneration in experimental spinal cord Contusion injury[J].Neuroscience,2003,120(4):951-960.
