促红细胞生成素预处理对脑缺血再灌注大鼠水通道蛋白4 的影响
2014-03-11商丽宏
刘 坤,姚 阳,杨 宇,商丽宏,梁 宇
脑水肿是脑缺血再灌注损伤的主要并发症与继发损伤的主要诱发因素。水通道蛋白4(aquaporin 4,AQP4)是对水有高度选择性的细胞膜转运蛋白,主要分布在中枢神经系统,与脑水肿的发生密切相关。研究表明,促红细胞生成素(erythropoietin,EPO)预处理对脑缺血再灌注后神经损伤具有保护作用,可减轻脑水肿,减少脑梗死体积[1,2]。本研究通过探讨EPO 对AQP4 的影响,进一步阐明EPO 的脑保护机制。
1 材料与方法
1.1 实验动物分组 健康雄性SD 大鼠66只,体重280~300 g,沈阳医学院实验动物中心提供。随机分为假手术组、模型组、EPO 组,每组大鼠22 只。模型组在手术前3 h 腹腔注射生理盐水2 ml,EPO 组在手术前3 h 腹腔注射重组人EPO(Sigma 公司)5000 U/kg 溶于2 ml 生理盐水中,再灌注时间为48 h。
1.2 大鼠大脑中动脉闭塞(MCAO)模型制备参照Longa 线栓方法[3]。10%水合氯醛(0.3 ml/kg)腹腔注射麻醉大鼠,常规消毒,颈部正中切口,暴露左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。在ECA 与CCA 分叉处结扎ECA,用直径为0.26 mm 的尼龙线进入ICA 约18~20 mm,遇轻微阻力时则为阻断MCA 入口,栓塞成功后固定尼龙线,2 h 后拔出尼龙线进行再灌注。假手术组栓线插入ICA 深度<10 mm。
1.3 激光多普勒血流仪检测脑血流 大鼠麻醉后俯卧位固定于脑立体定位仪,正中矢状线切开颅顶皮肤,冠状缝后1 mm 与矢状缝左5 mm 交叉点处钻一小孔直至硬脑膜,直径约2 mm,该区域为缺血核心区域。置激光多普勒血流仪探头于孔内,检测大脑中动脉血流变化。记录缺血前脑血流基础值及缺血后血流变化。MCAO 后脑流量迅速降到基础值的30%以下视为手术成功,不符合此标准的大鼠剔除。
1.4 脑水含量的测定 应用干、湿重法,动物在相应时间点麻醉、处死,断头取脑,将脑组织放在烘烤过的玻片上,秤湿重,放入烤箱中烘干(110 ℃,24 h),秤干重。脑组织水含量(%)=(湿重-干重)/湿重×100%。
1.5 免疫组织化学法检测AQP4 表达的变化麻醉大鼠后,4%多聚甲醛灌流,断头取额顶叶脑组织,30%蔗糖脱水,OTC 包埋,冰冻切片机冠状连续切片(厚10 μm)。一抗为山羊抗大鼠多克隆抗体,1∶200 稀释(Sigma 公司),应用免疫组化SABC法,按试剂盒(武汉博士德公司)说明操作,DAB(武汉博士德公司)显色,结果用Motic Images Advanced 3.2 图像分析系统采集照片,进行定量分析。
1.6 RT-PCR 检测AQP4mRNA 含量的变化麻醉动物经心脏灌注冰生理盐水约300 ml,取缺血侧半暗带周围脑组织50 mg,假手术组取相应部位脑组织50 mg。按Trizol(Gibco 公司)试剂说明书提取总RNA,紫外分光光度仪测定总RNA 含量。按RT-PCR 试剂盒(Takara 公司)的操作说明将mRNA逆转录为cDNA,用以下引物对AQP4 及β-actin 的cDNA 进行扩增:AQP4(452bp)上游5’-ACCACAGTCCATGCCATCAC-3’,下游5’-ATCCACCACCCTGTTGCTGTA-3’;β-actin(493bp)上游5’-GTGGGGCGCCCAGGCACCA-3’,下 游5’-GCTCGGCCGTGGTGGTGAAGC-3’,PCR 产物经2%琼脂糖凝胶电泳检测,紫外分析仪下观察并照相。
2 结果
2.1 大鼠大脑中动脉血流变化 激光多普勒血流仪检测大鼠大脑中动脉血流改变。脑缺血模型成功标准为MCAO 后大鼠脑血流降于基础值30%以下(见图1)。MCAO 后脑血流未降至基础值30%以下大鼠有5 只,弃用。
2.2 脑水含量测定 结果显示,与假手术组相比,模型组与EPO 组脑水含量均显著增加(P<0.01)。EPO 组与模型组相比,脑水含量显著减少(P<0.01)(见表1)。
2.3 脑组织AQP4 蛋白表达 AQP4 蛋白表达在微血管内皮细胞、胶质细胞和神经元细胞。与假手术组比较,模型组与EPO 组AQP4 表达均显著增加(P<0.01)。EPO 处理后,与模型组比较,AQP4表达显著减少(P<0.01)(见表2、图2)。
2.4 脑组织AQP4 mRNA 表达 结果显示,模型组与EPO 组较假手术组AQP4 mRNA 表达水平显著升高(P<0.01)。EPO 组与模型组比较,AQP4 mRNA 表达水平明显降低(P<0.01)(见表3、图3)。
表1 实验各组脑水含量的变化(±s)

表1 实验各组脑水含量的变化(±s)
与假手术组比较* P<0.01;与模型组比较#P<0.01
表2 实验各组脑组织AQP4 表达的平均光密度比较(±s)
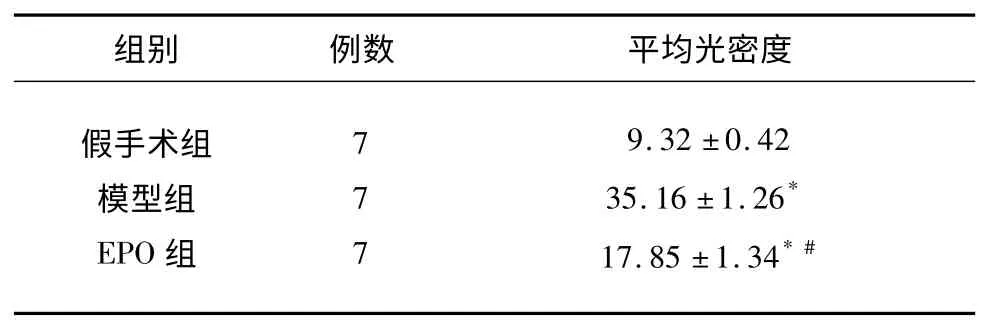
表2 实验各组脑组织AQP4 表达的平均光密度比较(±s)
与假手术组比较* P<0.01;与模型组比较#P<0.01
表3 实验各组脑组织AQP4 mRNA 的比较(±s)
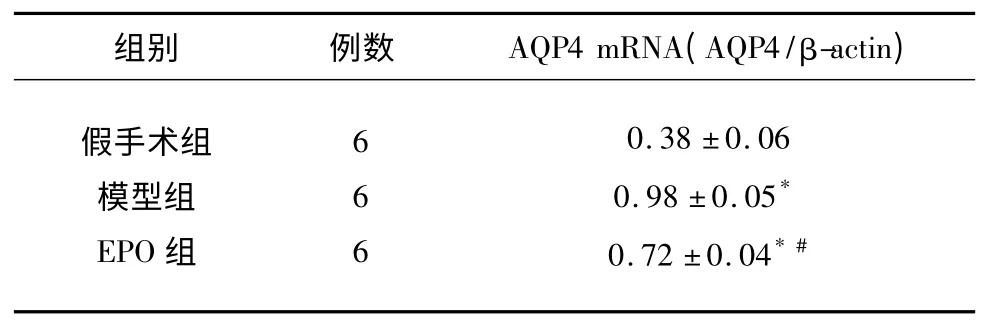
表3 实验各组脑组织AQP4 mRNA 的比较(±s)
与假手术组比较* P<0.01;与模型组比较#P<0.01
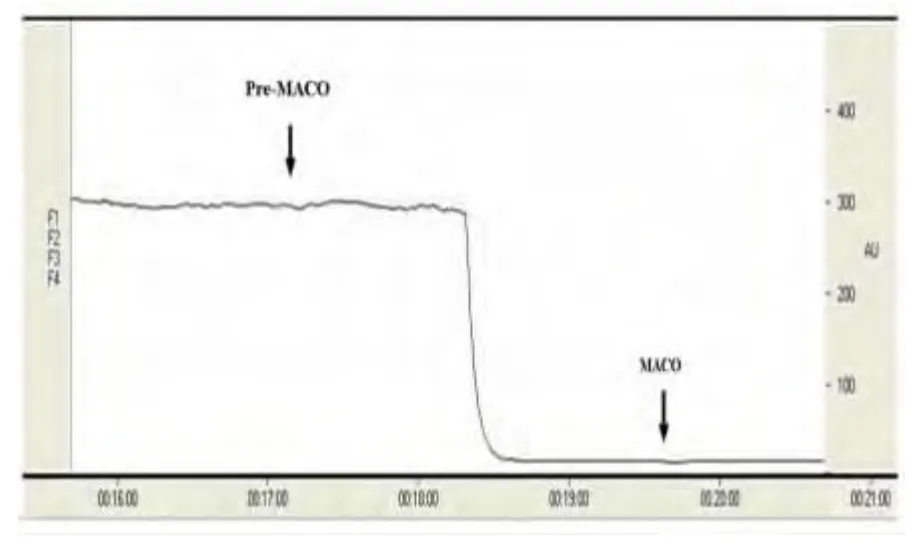
图1 大鼠MCAO 前后局部脑血流值变化图
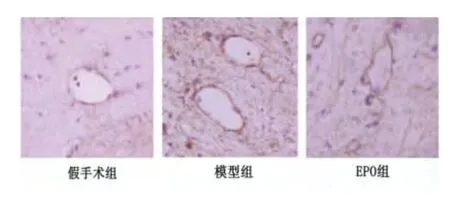
图2 各组额顶叶皮质AQP4 蛋白表达(×400)
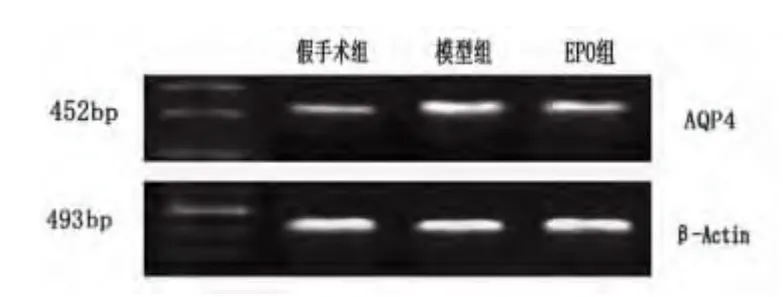
图3 各组脑组织中AQP4mRNA 表达
3 讨论
脑水肿是缺血性脑血管病的常见病理变化之一,也是导致病情加重、恶化,甚至引起患者死亡的主要原因。因此,有效减轻缺血后脑水肿的程度对改善患者的疗效极其重要。
促红细胞生成素(erythropoietin,EPO)是一种主要由肾脏分泌的糖蛋白,主要作用是调节血液中红细胞的生成。研究发现,在脑内神经胶质细胞、神经元和内皮细胞均有EPO 及其受体表达[4]。利用缺血再灌注动物模型研究发现,EPO 预处理可以减小脑梗死体积、减轻脑水肿程度[1,2],这与我们的研究结果一致。脑水肿与水通道蛋白的表达密切相关。水通道蛋白是具有高度选择性的水通道特异性蛋白质家族,现已从哺乳动物组织鉴定出13 种水通道蛋白[5]。其中,AQP4 主要表达于脑微血管内皮细胞、血管周围星形胶质细胞和室管膜细胞。AQP4是胶质细胞与脑脊液以及血管之间的水调节和运输的重要结构基础[6]。研究表明,AQP4 缺乏与小鼠细胞毒性脑水肿减轻有关,包括水中毒以及局灶性脑缺血和细菌性脑膜炎诱导的水肿[7,8]。Yang 等研究证明,AQP4 过表达明显加重细胞毒性脑水肿[9]。我们的研究结果显示,脑缺血再灌注后,模型组缺血区脑组织AQP4 蛋白及mRNA 表达水平显著升高,EPO 预处理能够显著降低缺血区AQP4 的表达。EPO 调节AQP4 表达的可能机制如下:EPO 与其受体结合后,减少肿瘤坏死因子α(tumor necrosis factor alpha,TNFα)的产生[10],并上调细胞内PKC 水平[11]。TNFα 能够上调AQP4 的表达[12],而PKC具有下调AQP4 表达作用[13]。研究还发现,AQP4分子序列中Ser180 是PKC 的磷酸化位点,AQP4 磷酸化后对水的通透性显著降低[14]。
综上所述,EPO 可能通过多种途径下调AQP4的表达水平,减轻脑水肿的程度,从而实现对缺血再灌注后神经组织的保护作用。
[1]Marti HH.Erythropoietin and the hypoxic brain[J].Exp Biol,2004,207(18):3233-3242.
[2]徐兴顺,耿德勒,卜 渊,等.促红细胞生成素对大鼠局灶性脑缺血再灌注后梗死体积和脑组织水肿的影响[J].Clin Neurol,2003,3(13):156-158.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]Morre EM,Bellomo R,Nichiol AD.Erythropoietin as a novel brain and kidney protective agent[J].Aneasth Intensive Care,2011,39(3):356-372.
[5]Huber VJ,Tsujita M,Nakada T.Aquaporins in drug discovery and pharmacotherapy[J].Mol Aspects Med,2012,33(5):691-703.
[6]Lacovetta C,Rudloff E,Kirby R.The role of aquaporin 4 in the brain[J].Vet Clin Pathol,2012,41(1):32-44.
[7]Li M,Ma RH,Li LH,et al.Astragaloside IV reduces cerebral edema post-ischemia/reperfusion correlating the suppression of MMP-9 and AQP4[J].Eur J Pharmacol,2013,715(1):189-195.
[8]Papadopoulos MC,Verkman AS.Aquaporin-4 gene disruption in mice reduces brain swelling and mortality in pneumococcal meningitis[J].J Biol Chem,2005,280(14):13906-13912.
[9]Yang B,Zador Z,Verkman VS.Glial cell aquaporin-4 overexpression in transgenic mice accelerates cytotoxic brain swelling[J].J Biol Chem,2008,283(22):15280-15286.
[10]Liu K,Sun T,Wang P,et al.Effects of erythropoietin on blood-brain barrier tight junctions in ischemia-reperfusion rats[J].J Mol Neurosci,2013,42(2):369-379.
[11]Garg K,Yadav HN,Singh M,et al.Mechanism of cardioprotective effect of erythropoietin-induced preconditioning in rat heart[J].Indian J Pharmacol,2010,42(4):219-223.
[12]Alexander JJ,Jacob A,Cunningham P,et al.TNF is a key mediator of septic encephalopathy acting through its receptor,TNF receptor-1[J].Neurochem Int,2008,52(3):447-456.
[13]Zhu SM,Xiong XX,Zheng YY,et al.Propofol inhibits aquaporin 4 expression through a protein kinase C-dependent pathyway in an astrocyte model of cerebral ischemia/reoxygenation[J].Anesth Analg,2009,109(5):1493-1499.
[14]Yukutake Y,Yasui M.Regulation of water permeability through aquaporin-4[J].Neuroscience,2010,168(4):885-891.
