原发性失眠患者学习能力及海马功能连接的研究
2014-03-11张红菊王恩峰李永丽张杰文
张红菊,周 瑶,王恩峰,张 驰,李永丽,张杰文
原发性失眠常伴随生活质量下降、工作效率降低[1]及焦虑、抑郁情绪,被认为是抑郁的预测因子[2]。失眠常导致事故伤害发生,占用医疗资源[3]。对原发性失眠认知损害的研究主要集中在注意力、记忆力、执行能力和警觉性方面,睡眠在学习记忆中起重要作用[4],海马参与记忆的形成和巩固[5]。动物睡眠剥夺后出现学习能力下降,海马受损[4],原发性失眠患者也存在海马损害[6],也有持不同的观点[7]。静息态功能磁共振能更早发现疾病早期异常功能改变,研究发现阿尔采默病患者海马与全脑功能连接异常[8]。因此,海马功能连接异常可能是原发性失眠患者学习能力下降的神经生物机制之一。我们对本院睡眠门诊40 例原发性失眠患者和50 例正常对照者进行静息态脑功能连接的研究,探讨原发性失眠患者学习能力下降的病理生理机制。
1 材料和方法
1.1 研究对象 PI 组:筛选2011 年4 月~2013 年4 月在本院睡眠障碍门诊就诊的原发性失眠患者,符合国际睡眠障碍分类(ICSD)和美国精神障碍诊断与统计手册第4 版(DSM-Ⅳ)诊断标准,且匹兹堡睡眠指数(pittsburgh sleep quality index,PSQI)>7,汉密尔顿抑郁量表(Hamilton depression scale,HAMD)<17。排除标准:多导睡眠图检查存在其他睡眠障碍疾病、合并有其他精神疾病或躯体疾病、半月内服用影响睡眠和脑功能的药物、妊娠及哺乳期女性、检查不合作者、体内有金属植入物者。健康受试组:选择与上述PI 患者性别、年龄、受教育程度匹配的健康志愿者,且HAMD<17,PSQI<5。所有受试者入组前均被详细告知并取得其知情同意,本研究得到郑州大学人民医院伦理委员会认可。
1.2 方法
1.2.1 词语学习测评 使用WHO-UCLA 词语学习量表测评受试者学习能力,包括瞬时回忆、插入测验、短时延迟回忆、长时延迟回忆、长时延迟再认。
1.2.2 设备及fMRI 扫描参数 采用Siemens Tim Trio 3.0T 超导磁共振扫描仪,头颅12 通道专用线圈,扫描时受试者安静闭目,静止不动。进行脑部常规结构像、静息态脑功能像数据采集,脑部结构部异常及脑功能数据不符合标准者舍弃。扫描时以泡沫固定被试者头部以减少头动,使用棉球和耳塞,以减少噪声。常规MRI 扫描参数:高分辨率T13DMPRAGE 序列:TR/TE 1950 ms/2.30 ms,TI 900 ms,扫描时间4.24 min;矩阵248×256;层厚1 mm;无间隔,视野244×252。静息态扫描序列参数:采用Siemens ep2_bold sequence,TR/TE 3000 ms/30 ms,矩阵64×64;层厚5 mm;层间隔0.5 mm;共36 层,视野320×320。
1.2.3 数据处理及统计学分析 采用SPSS17.0 统计软件,正态分布计量资料使用均数±标准差(±s)表示,两组间使用独立样本t 检验,P<0.05 表示差异有统计学意义。磁共振数据使用Mricron 进行DICOM 数据转换,SPM8 预处理,对每个受试者的EPI 图像进行时间校正及头部校正(剔除头动超过1.5 mm,转动大于1.5°的数据);将静息态数据前10 个时间的TR 去除;然后进行重排、配准、空间标准化和平滑处理。使用REST 软件进行数据分析:分别提取左、右海马时间序列的平均值,与大脑其余的体素进行相关分析,相关系数经过Fisher Z 值转换,得到每个被试的Z 值,首先分别进行原发性失眠组、健康对照组单样本t 检验,显著阈值设为P<0.05,体素簇≥20 voxels。然后进行双样本t 检验,显著阈值设为P<0.05,体素簇≥20 voxels。使用Xjview 自动识别功能连接异常脑区。
2 结果
2.1 一般情况 入选42 例患者和51 例健康志愿者,2 例患者和1 例健康受试遭剔除(头动大于1.5 mm),最终共入组PI 患者40 例,男12 例,女28例,年龄(38.78±8.25)岁;病程3~24 个月。受教育程度:大专以上/初中及高中/小学(17/18/5)。健康志愿者50 例,男21 例,女29 例;年龄(35.28±8.23)岁;受教育程度:大专以上/初中及高中/小学(23/21/6)。以上入选者均为右利手。
2.2 词语学习测评结果 PI 组WHO-UCLA词语学习能力中的瞬时回忆、插入测验、短时延迟回忆、长时延迟回忆明显少于健康组,差异有统计学意义(t>-3.49,P<0.01)。PI 延迟再认与健康组比较无统计学差异(t=-1.727,P>0.05)(见表1)。
2.3 静息态功能磁共振结果 以右海马为种子点进行全脑功能连接,与健康组相比,PI 右侧海马与左边缘叶、右丘脑、左脑干连接增强,t>3.2574,P<0.05,cluster≥20(见表2)。以左海马为种子点进行全脑功能连接,与健康组比较,PI 左海马与双丘脑功能连接增强,t>4.9798,P<0.05,cluster≥20(见表3)。

表1 PI 与健康组WHO-UCLA 学习能力比较
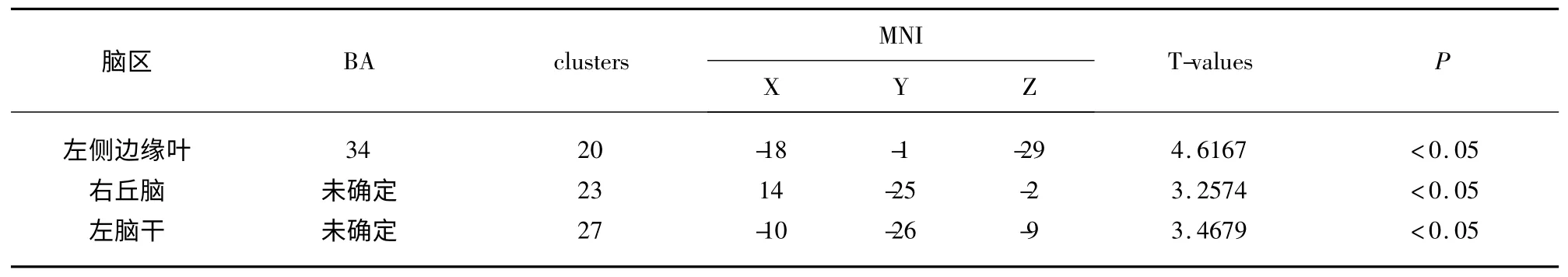
表2 PI 与健康组右海马功能连接两样本t 检验显著差异脑区信息
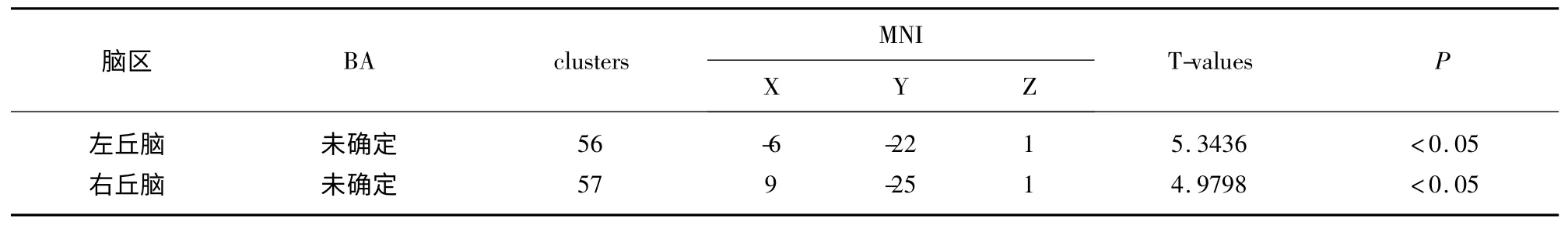
表3 PI 与健康组左海马功能连接两样本t 检验显著差异脑区信息
3 讨论
睡眠是人体重要的生理需要,人类有1/3 的时间在睡眠中渡过,睡眠具有重要的生理意义,如蛋白的合成、神经突触的重构、记忆的形成和巩固[4]。PI患者存在记忆力下降、注意力和警觉性受损,睡眠在学习记忆中起着重要的作用,失眠扰乱了正常睡眠、干扰了记忆的储存和巩固、海马参与记忆的形成。功能磁共振能更早的发现疾病早期神经兴奋性及功能连接的改变,因此我们利用静息态磁共振研究40 个PI 患者和50 个健康对照者海马脑功能连接的改变,寻找PI 患者学习能力下降的早期病理生理学改变。
本研究显示PI 患者词语学习中瞬时回忆、插入测试、短时延迟回忆、长时延迟回忆得分均较健康对照组明显下降,说明原发性失眠患者记忆力下降。睡眠是记忆形成和巩固的必要条件,特别是在慢波睡眠和快眼动期睡眠中,存在神经突触重塑[9]。功能磁共振研究显示睡眠剥夺后前额叶背外侧区、顶叶及枕叶激活下降,这些区域与学习相关[10];任务态功能磁共振研究也发现PI 患者前额叶、顶叶和枕叶激活下降[11],这些脑区兴奋性下降是PI 患者记忆力下降的原因[12]。
本研究结果显示:PI 患者右侧海马与左边缘叶、右丘脑、左脑干功能连接增强。左海马与双侧丘脑功能连接增强。海马是记忆形成重要的解剖结构,参与记忆的形成和储存,是突触水平的片断记忆及短时程记忆的编码储存区[13],边缘叶参与情绪调节[14],丘脑是多种神经递质投射的解剖区,是生物钟所在部位;脑干具有碱胆能及单胺类神经递质的投射纤维,拥有“REM 睡眠开关”[15],上述结构功能相互作用决定了清醒或睡眠状态。既往磁共振研究发现失眠患者海马体积变小,失眠严重程度与CA3/海马齿状回体积下降有关[6],词组记忆重现时海马激活区变小,而前额叶背外侧激活区范围变大,认为记忆片断通过睡眠转换到前额区,并将这些信息转为长时程记忆[4]。PI 患者海马受损,为储存记忆信息,反馈性要求睡眠增多,以满足储存记忆的需要;丘脑与脑干具有调节睡眠的作用,因此出现了海马与丘脑及脑干功能连接增强。PI 患者海马与边缘叶功能连接增强可能与失眠患者的焦虑情绪有关。
总之,PI 患者存在学习能力下降。其海马与丘脑、脑干功能连接增强,可能与海马受损后,反馈性增多睡眠以满足储存记忆的需要有关。海马功能连接的改变,为理解失眠的学习能力下降提供了客观影像学依据,并为失眠患者临床疗效评估提供客观、科学的影像学依据。
[1]Leger D,Guilleminault C,Bader G,et al.Medical and socio-professional impact of insomnia[J].Sleep,2002,25(6):625-629.
[2]Baglioni C,Battagliese G,Feige B,et al.Insomnia as a predictor of depression:A meta-analytic evaluation of longitudinal epidemiological studies[J].J Affect Disord,2011,135(1):10-19.
[3]Chien KL,Chen PC,Hsu HC,et al.Habitual sleep duration and insomnia and the risk of cardiovascular events and all-cause death:report from a community-based cohort[J].Sleep,2010,33(2):177-184.
[4]Spencer RM.Neurophysiological Basis of Sleep's Function on Memory and Cognition[J].Physiol,2013,1:319-619.
[5]Walker MP,van der Helm E.Overnight therapy.The role of sleep in emotional brain processing[J].Psychol Bull,2009,135(5):731-748.
[6]Neylan TC,Mueller SG,Wang Z,et al.Insomnia severity is associated with a decreased volume of the CA3/Dentate gyrus hippocampal Subfield[J].Biol Psychiatry,2010,68(5):494-496.
[7]Noh HJ,Joo EY,Kim ST,et al.The Relationship between hippocampal volume and cognition in patients with chronic primary insomnia[J].J Clin Neurol,2012,8(2):130-138.
[8]Mc Laren DG,Sperling RA,Atri A.Flexible modulation of network connectivity related to cognition in Alzheimer’s disease[J].Neuroimage,2014,100:544-557.
[9]Dang-Vu TT,Schabus M,Desseilles M,et al.Functional neuroimaging insights into the physiology of human sleep[J].Sleep,2010,33(12):1589-1603.
[10]Chuah LY,Chee MW.Functional neuroimaging of sleep deprived healthy volunteers and persons with sleep disorders:a brief review[J].Ann Acad Med Singapore,2008,37(8):689-694.
[11]Drummond SP,Walker M,Almklov E,et al.Neural correlates of working memory performance in primary insomnia[J].Sleep,2013,36(9):1307-1316.
[12]Goel N,Rao H,Durmer JS,et al.Neurocognitive consequences of sleep deprivation[J].Semin Neurol,2009,29(4):320-339.
[13]Arnsten AF,Jin LE.Molecular influences on working memory circuits in dorsolateral prefrontal cortex[J].Prog Mol Biol Transl Sci,2014,122:211-231.
[14]Ognhanovski N,Maruyama D,Lashner N,et al.CA1hippocampal network activity changes during sleep-depend memory consloidaion[J].Front Sys Neruosci,2014,8:61.
[15]McReynolds JR,Holloway-Erickson CM,Parmar TU,et al.Corticosterone-induced enhancement of memory and synaptic Arc protein in the medial prefrontal cortex[J].Neurobiol Learn Mem,2014,112:148-157.
