肺局限性磨玻璃结节的高分辨率CT征象与国际肺癌研究协会/美国胸科学会/欧洲呼吸学会病理的对照研究
2014-03-10峰PANFeng
潘 峰PAN Feng
刘 卓1LIU Zhuo
袁 飞1YUAN Fei
王 俊2WANG Jun
孙昆昆3SUN Kunkun
杜湘珂1DU Xiangke
洪 楠1HONG Nan
肺局限性磨玻璃结节的高分辨率CT征象与国际肺癌研究协会/美国胸科学会/欧洲呼吸学会病理的对照研究
潘 峰1PAN Feng
刘 卓1LIU Zhuo
袁 飞1YUAN Fei
王 俊2WANG Jun
孙昆昆3SUN Kunkun
杜湘珂1DU Xiangke
洪 楠1HONG Nan
目的探讨肺局限性磨玻璃结节(GGN)的高分辨率CT(HRCT)征象与国际肺癌研究协会/美国胸科学会/欧洲呼吸学会病理的相关性。资料与方法 选取121例GGN患者,按病理结果将其分为良性组(22例)、浸润前病变(PIL)组(21例)、微浸润癌组(26例)和浸润癌组(52例),总结患者肺GGN的影像、病理及预后资料,分析不同病理类型GGN间的差异。结果GGN的最大径、边缘、空泡征、实性成分、形状及是否有血管穿行在4组间差异均有统计学意义(χ2=9.945~31.068,P<0.05)。浸润癌组的最大径、边缘与良性组、PIL组、微浸润癌组比较,差异有统计学意义(P<0.008);良性组空泡征与PIL组、微浸润癌组、浸润癌组比较,差异有统计学意义(P<0.008);是否含有实性成分、形状在浸润癌与微浸润组间差异有统计学意义(P<0.008);是否有血管穿行在良性组与浸润癌组间差异有统计学意义(P<0.008)。仅1例浸润癌出现远处转移。结论当GGN的最大径≥16.35 mm、出现毛刺征或分叶征提示浸润癌;当GGN内部出现空泡征则提示其为恶性;GGN内部含有实性成分或其形状不规则,可以鉴别浸润癌与微浸润癌;GGN内部有血管穿行可以用于鉴别浸润癌与良性病灶;GGN的预后好,仅0.83%病例出现远处转移。
硬币病变,肺;肺肿瘤;腺癌;体层摄影术,螺旋计算机;病理学,外科
肺部磨玻璃结节(ground glass nodule, GGN)是早期肺癌的重要表现形式,其检出及随诊主要依赖肺高分辨率CT(high resolution CT, HRCT)。2011年国际肺癌研究协会、美国胸科学会及欧洲呼吸学会提出了肺腺癌的新病理学分类[1],将肺腺癌分为浸润前病变(preinvasive lesion, PIL)、微浸润癌、浸润癌、浸润癌的其他类型4类,其中PIL包括不典型增生(atypical adenomatous hyperplasia, AAH)及原位癌。本研究评估121例经国际肺癌研究协会/美国胸科学会/欧洲呼吸学会病理分类证实的GGN的HRCT征象,对不同病理类型GGN的特点进行统计与分析,以提高GGN的CT诊断准确性。
1 资料与方法
1.1 研究对象 本研究回顾性分析了2005-01~2013-07在北京大学人民医院行胸部HRCT扫描并手术切除的121例GGN患者,其中,单发结节100例,多发结节21例(均全部手术切除);年龄34~78岁,平均(58.43±10.28)岁。病理诊断采用2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会分类标准[1],其中23例2011年9月前的病灶请病理科医师按照新病理重新诊断。根据病理结果将所有患者分为良性组(22例)、PIL组(21例)、微浸润癌组(26例)和浸润癌组(52例),患者的性别及年龄等一般资料见表1。
1.2 仪器与方法 胸部HRCT扫描采用GE 64排LightSpeed VCT扫描机,均为平扫,标准算法重建,重建层厚1 mm。CT征象分析采用Lung VCAR软件(GE公司,AW 4.3工作站)。分析数据包括最大径、边缘、空泡征、是否含有实性成分(与病理镜下所见的实性成分不完全一致)、形状、是否有血管穿行、与胸膜关系。以上征象由2位具有10年以上胸部CT诊断经验的副主任医师在不知病理结果的情况下进行测量。对所有患者进行术后随访,记录是否出现肿瘤转移、复发及患者死亡的情况,平均随访时间13.4个月(范围1~95个月)。
1.3 统计学方法 采用SPSS 17.0软件,连续变量用Kruskal-Wallis检验与Mann-Whitney U检验,非连续变量用χ2检验及Fisher确切概率法,P<0.05表示差异有统计学意义,组间两两比较以P<0.008为差异有统计学意义。
2 结果
2.1 病理结果 良性GGN 22例(图1),PIL 21例(AAH 11例,原位癌10例)(图2、3),微浸润癌26例(图4),浸润癌52例(图5、6)。
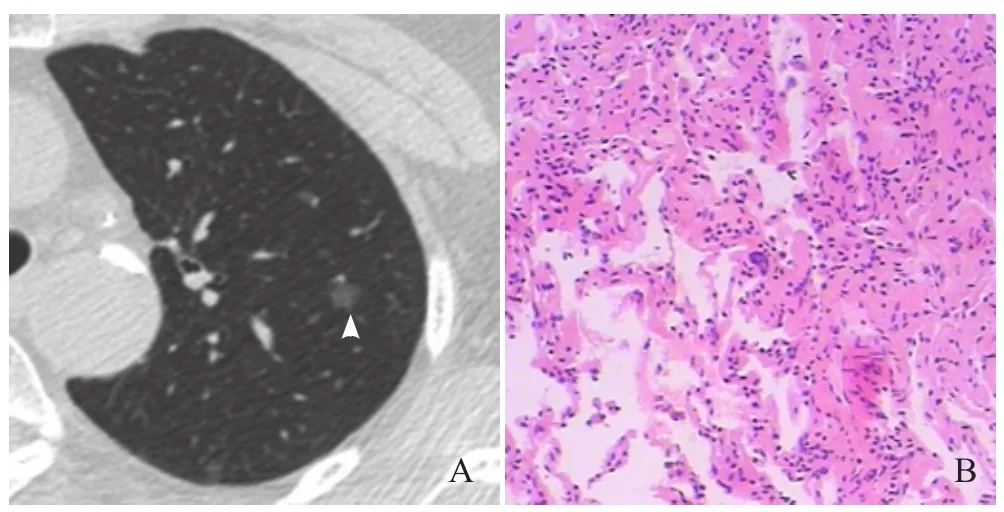
图1 女,76岁,左肺上叶GGN。最大径7.9 mm,球形,边缘光滑,无实性成分,无空泡征,无血管穿行,与胸膜无关(箭头,A);病理:炎症,镜下可见纤维组织增生,未见异形细胞(HE,×200,B)
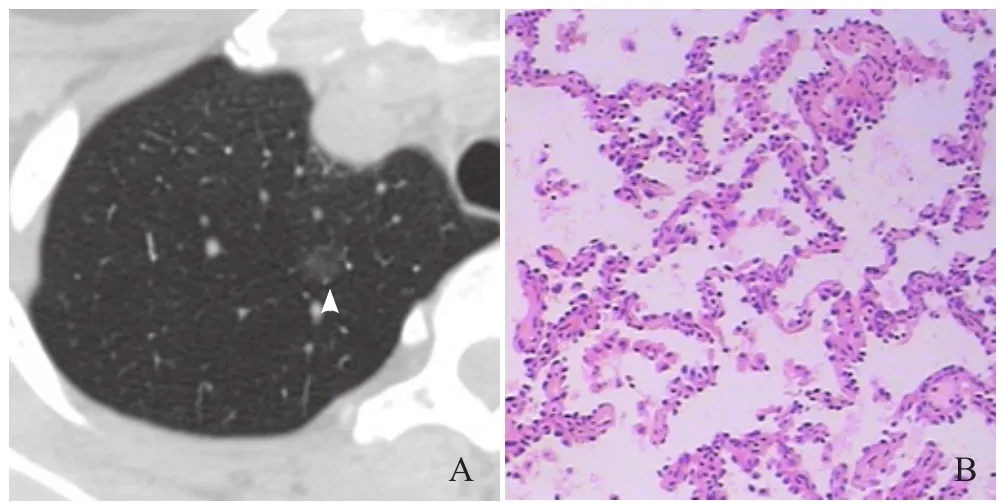
图2 女,39岁,右肺上叶GGN。最大径10.3 mm,球形,边缘光滑,无实性成分,无空泡征,有血管穿行,与胸膜无关(箭头,A);病理:AAH,镜下可见局灶上皮非典型增生(HE,×200,B)

图3 女,52岁,左肺下叶GGN。最大径10.6 mm,球形,边缘光滑,无实性成分,无空泡征,有血管穿行,与胸膜无关(箭头,A);病理:原位癌,镜下可见肿瘤细胞贴肺泡壁生长,基底膜结构完整(HE,×200,B)
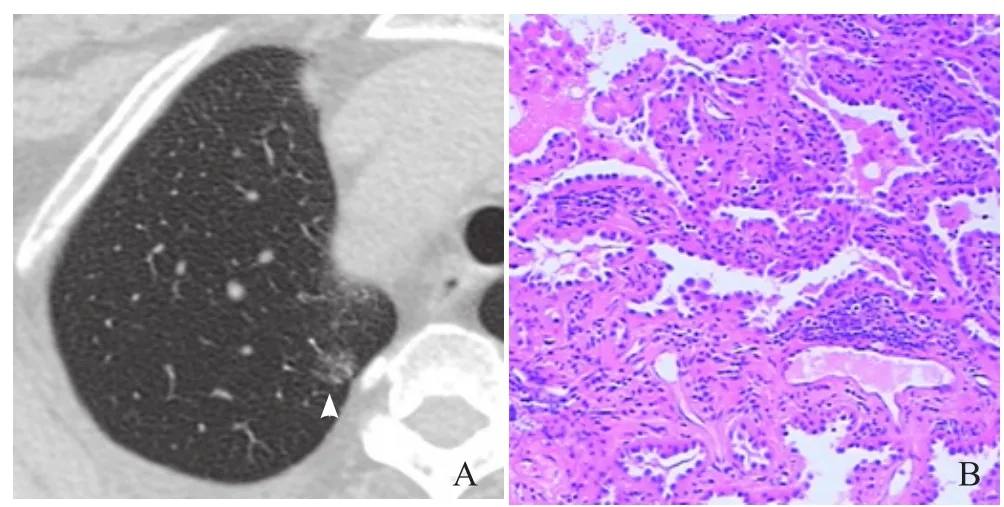
图4 女,56岁,右肺上叶GGN。最大径14.1 mm,球形,边缘光滑,内可见点状实性成分,无空泡征,有血管穿行,与胸膜间有细小索条影(箭头,A);病理:微浸润癌,镜下肺间质内可见少许肿瘤细胞浸润,浸润灶<5 mm(HE,×200,B)
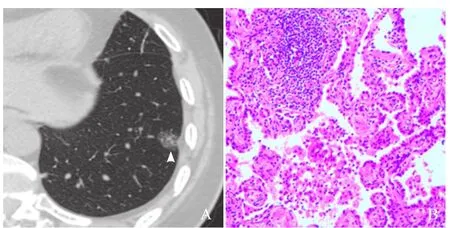
图5 女,54岁,左肺下叶GGN。最大径14.9 mm,椭球形,边缘光滑,内见点状实性成分、空泡征,有血管穿行,与胸膜粘连(箭头,A);病理:浸润癌,镜下见肺泡结构破坏,间质内可见大量肿瘤细胞浸润(HE,×200,B)

图6 男,69岁,右肺上叶GGN。最大径25.3 mm,形状不规则,分叶状,内可见片状实性成分、空泡征,有血管穿行,与胸膜粘连(箭头,A);病理:浸润癌;纵隔淋巴结(箭头,B)、胸椎(箭头,C)转移
2.2 不同病理类型GGN的临床、CT征象情况 GGN的最大径(χ2=31.068,P<0.05)、边缘情况(χ2=19.459,P<0.05)、空泡征(χ2=20.755,P<0.05)、是否含有实性成分(χ2=14.421,P<0.05)、形状(χ2=11.864,P<0.05)及是否有血管穿行(χ2=9.945,P<0.05)在4组间差异均有统计学意义;而患者的性别(χ2=2.534,P>0.05)、年龄(χ2=2.803,P>0.05)、GGN与胸膜的关系(χ2=7.625,P>0.05)在4组间差异无统计学意义。浸润癌组GGN的最大径与良性组、PIL组、微浸润癌组比较,差异均有统计学意义(P<0.008),该征象评估GGN为浸润癌的ROC曲线下面积为0.796(图7);最大径≥16.35 mm时,提示GGN为浸润癌的特异度为78.3%,敏感度为65.4%。浸润癌组GGN的边缘与良性组、PIL组、微浸润癌组比较,差异均有统计学意义(P<0.008),出现毛刺征或分叶征提示浸润癌,特异度为81.16%,敏感度为55.77%。良性组空泡征与PIL组、微浸润癌组、浸润癌组比较,差异均有统计学意义(P<0.008),出现空泡征提示恶性,特异度为95.45%,敏感度为52.53%。是否含有实性成分在浸润癌组与微浸润癌组间差异有统计学意义(P<0.008),含有实性成分提示浸润癌,特异度为73.08%,敏感度为69.23%。形状在浸润癌组与微浸润癌组间差异有统计学意义(P<0.008),形状不规则提示浸润癌,特异度为84.61%,敏感度为51.92%。是否有血管穿行在良性组与浸润癌组间差异有统计学意义(P<0.008),有血管穿行提示浸润癌,敏感度为94.23%,特异度为31.82%。见表1。
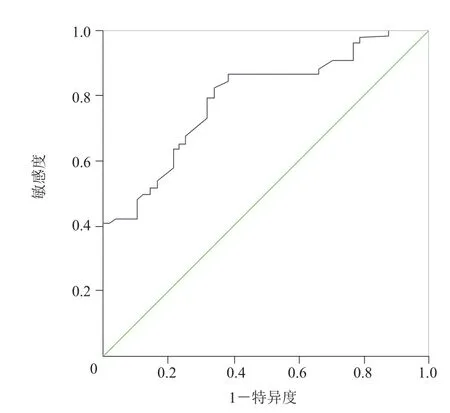
图7 最大径评估GGN是否为浸润癌的ROC曲线,曲线下面积为0.796
2.3 随访及预后 121例病灶中仅1例(0.83%)浸润癌初诊时合并纵隔淋巴结转移、胸椎转移(图6),余120例在随访期间均未出现肿瘤转移或复发征象。
3 讨论
2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会将肺腺癌病理分为PIL、微浸润癌、浸润癌、浸润癌的变形4大类[1]。其中PIL包括AAH及原位癌,AAH是指肺泡壁细胞局限性不典型增生,在HRCT上主要表现为直径<5 mm的纯磨玻璃结节;原位癌指完全贴肺泡壁生长的直径<3 cm的没有侵袭性的病灶,在HRCT上也表现为纯磨玻璃影,但比AAH的密度稍高。微浸润癌定义为直径≤3 cm、内部浸润灶≤5 mm的病灶,在HRCT上表现为纯GGN或混杂GGN。浸润癌内部浸润灶>5 mm,以实性结节为主要表现形式,早期的浸润癌也可以表现为GGN[2]。研究表明,AAH及原位癌术后5年生存率达100%,微浸润癌的术后5年生存率也接近100%,而浸润癌的术后5年生存率明显降低[3],因此,GGN的定性诊断对指导临床及预后具有重要的作用。本研究结果证实,GGN的HRCT征象能够提示GGN的良、恶性,也能够将浸润癌从更早期癌中筛选出来。
3.1 最大径与实性成分 GGN浸润生长一方面表现为逐渐增大,另一方面表现为内部实性成分的增多。临床研究已表明,病灶的大小是诊断恶性病灶的独立因素之一,病灶越大其恶性可能越大[4,5]。本研究显示浸润癌的最大径明显大于良性病灶、PIL及微浸润癌,浸润癌组与其他各组均具有显著差异,即随着GGN侵袭性的增加,其最大径增大。癌细胞的浸润生长在CT上的表现为实性结节,而癌细胞贴肺泡壁生长在CT上表现为磨玻璃影[6]。病理学认为,浸润癌内部浸润灶>5 mm,微浸润癌内部浸润灶≤5 mm[1]。本研究显示,浸润癌内部出现实性结节的概率高于微浸润癌,差异有统计学意义,说明HRCT判断病灶内部是否具有实性成分有一定准确性,且可以鉴别浸润癌与微浸润癌。对于良性病灶及PIL而言,病灶内亦可以出现实性成分,但与其他各组间无显著差异,考虑良性病灶或PIL内的实性成分可能为塌陷的肺泡、炎性物质沉积等。

表1 不同病理类型GGN的临床、CT征象情况比较
3.2 毛刺征及分叶征 毛刺征和分叶征体现了恶性病灶内部不同类型细胞的生长方式,肿瘤细胞生长较快,受到周围肺间质及纤维组织限制,形成分叶征。对于实性结节而言,毛刺征及分叶征是提示恶性的较敏感且特异的征象[7,8],GGN是实性肿物的早期表现形式,因此该征象在GGN中亦有所体现。本研究结果提示浸润癌出现毛刺征或分叶征的比率(55.77%)高于其他病灶出现分叶或毛刺的比率(良性为13.63%、PIL 为27.27%、微浸润癌为15.38%),说明浸润癌的生长方式更加接近实性结节,而该征象也是诊断浸润癌比较特异的征象之一(特异度为81.16%)。
3.3 空泡征 空泡征的形成是由于癌细胞侵犯使局部肺泡结构破坏,互相融合形成小的空腔,在CT上表现为肿瘤内部的含气透亮区;良性病灶在生长过程中对肺泡的直接破坏少,主要以肺泡内渗出或肺泡塌陷为主。良性病灶出现空泡征的概率(1.87%)远低于恶性病灶(PIL为38.10%、微浸润癌为46.15%、浸润癌为61.54%),空泡征提示GGN为恶性的特异度高达95.45%,空泡征的出现强烈提示GGN为恶性。
3.4 形状 浸润癌中形状不规则的病灶比例(51.92%)明显高于微浸润癌中形状不规则病灶比例(15.38%),差异有统计学意义,考虑原因有:其一,在肺癌生长的最初阶段,GGN向周围生长的速度较慢,受表面各向张力的影响,病灶趋于球形,当肿瘤细胞突破肺泡基底膜呈浸润性生长时,肿瘤细胞生长迅速加快,局部表面张力与其他部位不平衡,病灶向某一方向的生长速度更快,表现为不规则形;其二,率先突破基底膜的肿瘤细胞并非位于GGN的中央,GGN内部也并非只有一处浸润灶。因此,浸润癌的形态可呈现出不规则形。
3.5 血管穿行 GGN内部是否有血管穿行、穿行血管的数量、形态在HRCT上可以清晰显示。GGN内部有血管穿行说明病灶有相对独立的血供,提示病灶有进一步生长甚至恶变的可能性与趋势[9]。本研究显示浸润癌内部血管穿行的比例(94.23%)明显高于良性病灶内部有血管穿行的比例(68.18%),且两者具有统计学差异。分析其原因可能为:浸润癌在生长过程中需要丰富的血供,从病灶内部穿行的血管能够保证病灶足够的营养,利于浸润癌生长,而良性病灶在生长过程中血供相对不丰富,其内部出现血管穿行的比例低。因此,病灶内部是否有血管穿行,在一定程度上反应了病灶对血供的需求,对提示其恶性程度有指导意义。
3.6 胸膜牵拉 胸膜牵拉可以出现在微浸润癌中,并对其诊断具有鉴别意义[10],但本文结果显示GGN与胸膜的关系在不同病理类型间并无显著差异,且与胸膜有关系的GGN(索条牵拉或直接粘连)仅占总GGN的46.28%。GGN是肺癌的早期表现形式之一,此时癌细胞数量少、侵袭性弱,没有迅速侵犯胸膜并对其产生牵拉的能力;且GGN病灶较小,与胸膜之间的距离相对较远,产生胸膜牵拉的几率较小。患者的性别与年龄在不同病理分型间的差异无统计学意义。
3.7 GGN的预后 纳入本研究的121例GGN中,仅1例(0.83%)浸润癌在初诊时合并纵隔淋巴结及胸椎转移。该GGN内实性成分呈团片状生长,更接近实性结节的生长方式,这与其他GGN的形态学特点有较大差异。鲜有文献报道恶性GGN合并纵隔淋巴转移或远处转移,个别学者报道混杂GGN可能出现纵隔淋巴结转移[10,11],尚无纯GGN出现淋巴结转移、远处转移的报道。本研究也认为,GGN预后较好,极少出现肿瘤转移。
3.8 本研究的不足 本研究尚有诸多不足之处,如仅分析了GGN内部实性成分的有无,没有测量其比例或大小;对于GGN内部血管穿行的具体情况也没有进行详实的分析,如穿行血管的数量、形态等。基于文章篇幅此文不再赘述,作者将会在后续研究中进一步探讨及完善。
总之,当GGN的最大径≥16.35 mm、出现毛刺征或分叶征提示浸润癌,当GGN内部出现空泡征则提示其为恶性(特异度为95.45%),GGN内部含有实性成分或其形状不规则可以鉴别浸润癌与微浸润癌,GGN内部有血管穿行可以鉴别浸润癌与良性病灶,GGN的预后好,仅0.83%的病例出现远处转移。
[1] Travis WD, Brambilla E, Noguchi M. et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society: international multidisciplinary classifcation of lung adenocarcinoma. Proc Am Thorac Soc, 2011, 8(5): 381-385.
[2] Austin JH, Garg K, Aberle D. et al. Radiologic implications of the 2011 classification of adenocarcinoma of the lung. Radiology, 2013, 266(1): 62-71.
[3] Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases. Mod Pathol, 2011, 24(5): 653-664.
[4] Fan L, Liu SY, Li QC. et al. Multidetector CT features of pulmonary focal ground-glass opacity: differences between benign and malignant. Br J Radiol, 2012, 85(1015): 897-904.
[5] Henschke CI, Yankelevitz DF, Naidich DP, et al. CT screening for lung cancer: suspiciousness of nodules according to size on baseline scans. Radiology, 2004, 231(1): 164-168.
[6] Suzuki K, Koike T, Asakawa T, et al. A prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer (Japan Clinical Oncology Group 0201). J Thorac Oncol 2011, 6(4):751-756.
[7] Oh JY, Kwon SY, Yoon HI. et al. Clinical significance of a solitary ground-glass opacity (GGO) lesion of the lung detected by chest CT. Lung Cancer, 2007, 55(1): 67-73.
[8] Furuya K, Murayama S, Soeda H. et al. New classifcation of small pulmonary nodules by margin characteristics on highresolution CT. Acta Radiol, 1999, 40(5): 496-504.
[9] Gao F, Li M, Ge X, et al. Multi-detector spiral CT study of the relationships between pulmonary ground-glass nodules and blood vessels. Eur Radiol, 2013, 23(12): 3271-3277.
[10] 孟庆成, 贾丙鑫, 张建伟, 等. 微浸润型肺腺癌的高分辨率CT表现. 中国医学影像学杂志, 2013, 21(7): 536-538, 542.
[11 Kakinuma R, Ohmatsu H, Kaneko M, et al. Progression of focal pure ground-glass opacity detected by low-dose helical computed tomography screening for lung cancer. J Comput Assist Tomogr, 2004, 28(1): 17-23.
[12] Suzuki K, Kusumoto M, Watanabe S, et al. Radiologic classifcation of small adenocarcinoma of the lung: radiologicpathologic correlation and its prognostic impact. Ann Thorac Surg, 2006, 81(2): 413-419.
(本文编辑 冯 婕)
Comparative Study of Focal Pulmonary Ground Glass Nodule Between Findings of High Resolution CT and Pathology Classification of IASLC/ATS/ERS
PurposeTo evaluate the correlations between high resolution CT (HRCT) fndings and IASLC/ATS/ERS pathological classifcation of ground glass nodule (GGN).Materials and Methods121 patients with confirmed GGN were selected, and divided into benign group (22 cases), PIL group (21 cases), microinvasive carcinoma group (26 cases) and invasive carcinoma group (52 cases), then the imaging, pathology and prognosis data of patients with pulmonary GGN were reviewed, and the differences among GGN of different pathological types were analyzed.ResultsMaximum diameter, margin, vacuole sign, solid component, shape and blood vessels through of GGN were significantly different among the four groups (χ2=9.945-31.068, P<0.05). Maximum diameter and margin were signifcantly different between invasive adenocarcinoma and other groups (P<0.008); vacuole sign of the benign group was signifcantly different with other groups (P<0.008); the existence of solid component and shape were signifcantly different between invasive adenocarcinoma and minimally invasive adenocarcinoma (P<0.008); there was significant difference of blood vessels through between invasive adenocarcinoma and benign lesions (P<0.008). Among the 121 lesions, no metastasis except one invasive adenocarcinoma case complicated with distant metastasis.ConclusionMaximum diameter of GGN greater than 16.35 mm, with spiculation or lobulation represent invasive adenocarcinoma; vacuole sign within the GGN represent malignancy; with solid component and irregular shape can be used to identify invasive adenocarcinoma from minimally invasive adenocarcinoma; while blood vessels through can be used to identify invasive adenocarcinoma from benign lesions; the prognosis of GGNs is well with only 0.83% probability of distant metastasis.
Coin lesion, pulmonary; Lung neoplasms; Adenocarcinoma; Tomography, spiral computed; Pathology, surgical
1.北京大学人民医院放射科 北京 100044
2.北京大学人民医院胸外科 北京 100044
3.北京大学人民医院病理科 北京 100044
洪 楠
Department of Radiology, Peking University Peoples' Hospital, Beijing 100044, China
Address Correspondence to: HONG Nan E-mail: hongnan@pkuph.edu.cn
R445.6;R734.2
2014-03-28
修回日期:2014-10-31
中国医学影像学杂志
2014年 第22卷 第11期:815-819,823
Chinese Journal of Medical Imaging
2014 Volume 22(11): 815-819, 823
10.3969/j.issn.1005-5185.2014.11.004
Doi:10.3969/j.issn.1005-5185.2014.11.005
