量子点成像技术在宫颈癌及卵巢癌诊断和治疗中的应用
2014-03-10叶称连许恒毅聂丽菊陈进聪傅
叶称连许恒毅聂丽菊陈进聪傅 芬
量子点成像技术在宫颈癌及卵巢癌诊断和治疗中的应用
叶称连1,2许恒毅2聂丽菊1,2陈进聪2傅 芬1
宫颈癌及卵巢癌都是目前严重威胁女性健康的妇科恶性肿瘤,发病呈日益年轻化且发病率有逐年上升趋势。有数据统计,全世界每年约有宫颈癌新发病例50万,约有2313万妇女死于该病,其中80%的新发病例是发生在发展中国家,而我国每年宫颈癌新发病例约占全世界发病人数的1/3[1]。卵巢癌每年新发病例约为20万,占全部女性癌症的4%,死亡率为3%,在各种妇科恶性肿瘤引起的死亡率中占首位,70%~80%的卵巢癌患者发现时已为晚期[2]。因此,提高宫颈癌及卵巢癌的早期诊断水平,改善治疗手段对于两者的预后有重要意义。传统的诊断宫颈癌及卵巢癌的方法包括影像学检查(阴道镜检查、CT、超声、MRI和PET等[3,4])、实验室检查(肿瘤标志物测定、细胞学检查及人乳头状瘤病毒检测等[5])和病理组织活检(宫颈锥切、宫颈组织活检、卵巢癌组织活检等)。影像学检查操作简单方便,但不能检测到体积较小的宫颈癌与卵巢癌组织[3];实验室检查的灵敏度较低,不能用于宫颈癌及卵巢癌的早期诊断;病理组织活检是诊断宫颈癌及卵巢癌的“金标准”,但会对人体造成一定的创伤。放疗、化疗和介入治疗等传统的治疗方法价格昂贵,副作用较多,治疗效果不理想。因此,建立新的诊断和筛查技术以及更有效的治疗方法对降低宫颈癌及卵巢癌的死亡率至关重要。量子点(quantum dots, QDs)是近年发展起来的一种新型纳米发光粒子,具有荧光强度高、荧光寿命长、抗光漂白能力强、激发波谱宽及发射波谱窄等独特的光学特性,使其在生物医学领域,尤其是作为一种新型标记物应用于肿瘤研究,前景十分广阔。本文介绍了量子点的光学特性,并从体外成像、体内成像及肿瘤治疗成像3个方面综述了其在宫颈癌及卵巢癌诊断和治疗中的应用进展。
1 QDs的光学特性
QDs又称半导体纳米晶,是一种由II~IV族或III~V族元素组成的纳米颗粒,直径为3~10 nm。QDs作为一种新型的荧光材料,与传统的荧光染料相比,具有许多独特的性质:①QDs具有连续而宽的激发光谱,发射光谱范围很窄,并且荧光谱峰位置可以通过改变QDs的物理尺寸进行调控;②QDs的stokes位移(激发波长和发射波长峰值的差值)较大(300~400 nm),能够避免发射谱与激发谱的重叠,从而允许在低信号强度的情况下进行光谱学检测,提高检测的灵敏度;③QDs抗光漂白能力强,荧光寿命长;④QDs生物相容性好,尤其是在经过表面功能化修饰之后,可以进行生物分子的特异性识别与连接;⑤QDs组织穿透力强,发射近红外波长(700~2000 nm)的QDs对于在体内成像十分理想,因其在此波长范围内组织散射和吸收很低,能得到最大组织穿透深度(>1 mm)的光学信号;⑥QDs较有机荧光染料更不易降解,能抵抗生物活体内的代谢降解作用,细胞毒性小,在活体内及细胞内可长时间存在。基于以上特性,QDs应用于宫颈癌及卵巢癌生物分子、活细胞、组织及活体等生物体系的长时间实时、动态可视化荧光示踪成像。
2 QDs在宫颈癌及卵巢癌诊断与治疗成像中的应用
2.1 体外成像
2.1.1 生物分子成像 目前用于生物医学领域研究的生物分子主要包括蛋白质(如抗原、抗体等)、肽和核酸,用QDs标记有关的生物分子,即可以了解这些生物分子之间的相互作用及其在活体细胞、组织内的作用,可以作为间接判断活体细胞信号传递及其分子机制的手段。常见的宫颈癌及卵巢癌特异性生物分子包括甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原(CA125和CA19-9)及绒毛膜促性腺激素(HCG)等。Guo等[6]利用电化学发光免疫检测法检测妇科恶性肿瘤相关标志物AFP及CEA,分别用QD525和QD625标记,在单次检测中构建多色反应显示AFP及CEA的检测限可达到0.4 fg/ml,其宽线性范围为0.001~0.100 pg/ml。Cheng等[7]采用植物凝集素-N-乙酰葡糖胺修饰的QDs探针(Con A-GlcNA-QDs)检测宫颈癌HeLa细胞表达的热休克蛋白HSP70,荧光显微镜显示其可以特异性地识别地HSP70。Jokerst等[8]利用QDs制作纳米芯片检测卵巢癌早期患者血清和唾液中的肿瘤标志物CEA、CA125及Her-2/ Neu(C-erbB-2),其检测限可低至0.11 pmol/L,检测范围较ELISA更大,用时更短。Al-Ogaidi等[9]通过石墨烯QDs介导的免疫荧光定量检测卵巢癌肿瘤标志物CA125,生物传感器显示其宽线性范围为0.1~600.0 U/ml,检测限可达到0.05 U/mL,优于传统的ELISA检测法(检测限为0.05~0.30 U/ml)。
2.1.2 细胞成像 QDs荧光探针作为一种非侵袭性的检测工具,能够迅速准确地定位肿瘤细胞上的特异生物标志物。对于明确宫颈癌及卵巢癌的诊断和选择适当的肿瘤细胞表达受体或抗原至关重要。常见的宫颈癌及卵巢癌细胞表达抗原及受体包括表皮生长因子受体、人表皮生长因子受体(Her 2)、叶酸受体及癌胚抗原相关黏附因子(CEACAM8)等。Zrazhevskiy等[10]针对HeLa细胞内的Ki-67、HSP90、Lamin A、Cox-4及β-tubulin 5种不同的抗原进行QDs多重染色,其中Ki-67所对应的位置为细胞核,HSP90为细胞质,Lamin A为核膜,Cox-4为线粒体,β-tubulin为微管,成功实现了单个HeLa细胞内微环境的检测。Chakraborty等[11]构建了叶酸和(或)生物素修饰QDs表面的双重(或单重)功能化QDs探针,将修饰后的QDs探针与HeLa细胞(高表达叶酸和生物素受体)共同孵育4 h,结果显示双功能化QDs比单功能化QDs(仅叶酸或生物素修饰的QDs)标记的HeLa细胞显示出更高的荧光强度;进一步孵育直至12 h后再次观察其荧光强度,发现在细胞内的QDs浓度明显升高,推断QDs进入HeLa细胞是通过胞吞内化的途径。Silva等[12]制备了超小尺寸(1~2 nm)CdSe QDs探针(CdSe MSQDs)用于检测HeLa细胞,并比较其与抗癌药物依托泊苷对HeLa细胞的毒性,荧光显微镜检测结果显示依托泊苷可以明显造成细胞破坏,而CdSe MSQDs对细胞未见明显的毒性作用,证实了CdSe MSQDs的低毒性及其在细胞标记的可行性。进一步研究显示,CdSe MSQDs在与HeLa细胞共孵育24 h及36 h后,其荧光强度无明显改变,证实了CdSe MSQDs在生物标记应用中的稳定性。图1为本实验室采用P16INK4A抗体修饰的QD620针对宫颈癌HeLa细胞进行特异性标记,相对于对照组,其表现出较高的特异性。

图1 HeLa细胞的QDs免疫荧光成像。P16INK4A抗体修饰的QD620对HeLa细胞的免疫荧光成像,可见细胞质内明显荧光(A);对照组为不加P16INK4A抗体修饰的单纯QD620对HeLa细胞的免疫荧光成像,未见明显荧光(B)。红色为QDs荧光,蓝色为有机染料DAPI的核染图像
2.2 活体成像
2.2.1 肿瘤成像 活体成像是目前肿瘤研究中的挑战和热点。动物活体中量子点作为光学显像剂结合荧光成像系统可以进行宫颈癌及卵巢癌的定位,特别是卵巢癌,因其解剖位置的关系导致临床早期检测较难实现,因此,实时监测宫颈癌及卵巢癌细胞的生长和转移,为肿瘤动力学的研究及指导癌症手术提供了帮助。Al-Jamal等[13]将人宫颈癌C33a细胞经皮下注射到裸鼠的右下腹构建活体肿瘤模型,将阳性脂质-QDs双分子层囊泡(L-QDs)对小鼠肿瘤模型行内注射,以有机染料碘化丙啶(PI)作为对照组,分别在5 min及24 h后对其进行肿瘤冰冻切片免疫荧光成像,可以观察到L-QDs被成功标记于肿瘤间质及细胞膜表面,随着时间的推移,逐渐转移至细胞内近核处;同时发现其抗光漂白能力明显高于传统染料,表明相对于传统染料,QDs在宫颈癌组织成像的应用上有其优势。Gao等[14]将耦联了抗Her 2抗体的QD800经静脉注射入皮下移植了卵巢癌SKOV3细胞的裸鼠体内,并与对照组聚乙二醇(PEG)修饰的QD800相比,通过活体显像技术可以观察到4 h后Her 2-QDs标记的肿瘤部位荧光明显强于其他组织,而PEG-QDs在肿瘤处未能显现荧光,且PC-3肿瘤也无明显荧光,证实Her 2-QDs可以特异性地结合卵巢癌并进行标记。图2为本实验室采用P16INK4A抗体修饰的QD550针对宫颈癌组织进行特异性标记成像,相对于健康对照组,其在宫颈癌组织的成像检测上表现出明显的有效性。
2.2.2 血管成像 宫颈癌及卵巢癌组织周围血管丰富,细胞生长迅速,通过对肿瘤血管的检测可以间接反映癌组织的生长情况。通常所用荧光试剂不能在体实时对多种组织成像,而QDs凭借其良好的发光性能及组织穿透力,可以应用于肿瘤血管及周围区域的研究,从而用于宫颈癌及卵巢癌的早期诊断和治疗。Allen等[15]的研究显示,近红外QDs可以显示组织下深达200 μm处的肿瘤脉管系统成像,并能消除自发荧光干扰,准确性和灵敏性高,在生物体内脉管系统成像的应用中显示出其优势。Yoo等[16]将近红外QDs标记的卵巢癌SKOV3细胞经腹腔注射至小鼠体内构建活体肿瘤模型,通过多谱成像可以观察到经标记的肿瘤细胞通过周围血管转移至肝、肠、腹壁、膀胱等部位,证实QDs可以从卵巢癌周围的细胞和组织中区分出肿瘤血管。Smith等[17]将耦联了精氨酸-甘氨酸-天门冬氨酸(RGD)的QDs经尾静脉注射到耳部移植了人卵巢癌SKOV3细胞的小鼠中,用活体显微技术观察到RGD-QDs成团地与肿瘤新生血管上的αvβ3整合素结合,并且在不同肿瘤类型中,RGD-QDs与肿瘤血管上的αvβ3整合素结合形式相同,但QDs从血管中的溢出情况不同。因此,QDs可以对肿瘤局部血管形态和功能进行动态成像,为动态观察血管内药物或分子之间的相互作用提供了可能,可以作为肿瘤早期诊断的一种方法。
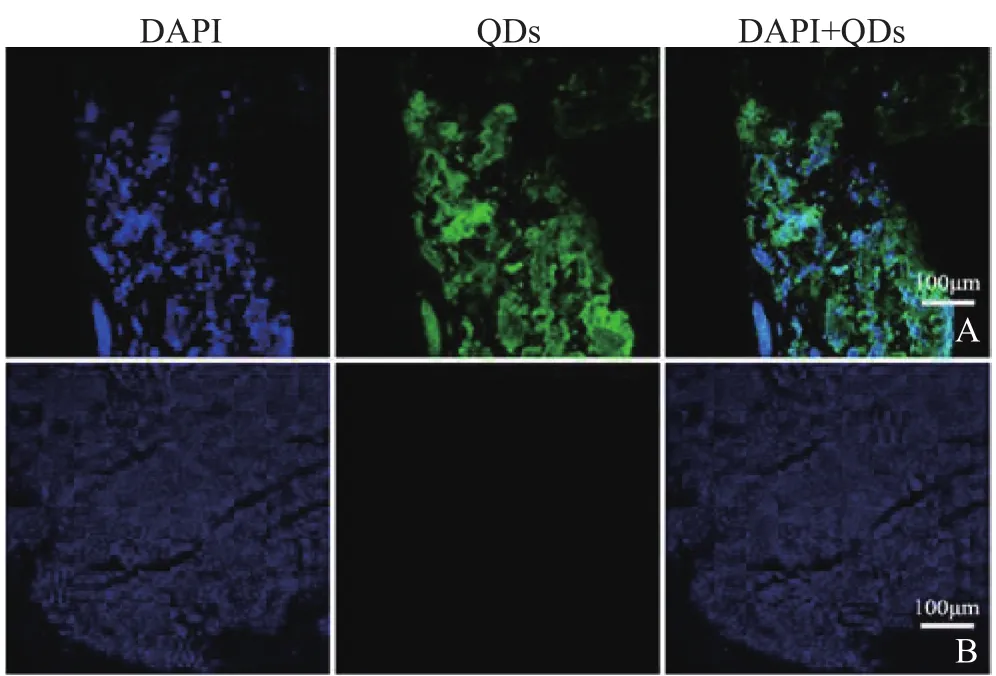
图2 宫颈组织的QDs免疫荧光成像。P16INK4A抗体修饰的QD550对宫颈癌组织的免疫荧光成像可见癌组织显示明显荧光(A);对照组为P16INK4A抗体修饰的QD620对健康宫颈组织的免疫荧光成像,未见明显荧光(B)。绿色为QDs荧光,蓝色为有机染料DAPI的核染图像
2.2.3 淋巴结成像 宫颈癌及卵巢癌中晚期易发生区域淋巴结转移,因此在对其进行手术前,先要检查癌组织周围的淋巴结是否已发生肿瘤转移,然后才能选择相应的术式。宫颈癌淋巴转移的主要部位是闭孔、髂内及髂外淋巴结[18],卵巢癌淋巴转移的主要部位是腹主动脉旁淋巴结、髂内、髂外及髂总淋巴结[19]。目前常用的检测淋巴结转移的方法主要包括放射性核素标记和注射染料指示剂,但放射性核素易造成污染且灵敏度不高,染料指示剂荧光性能较差、发光持续时间短且不能在深组织内成像。近年来,QDs因其特异的荧光特性及低毒性被广泛应用于淋巴结成像。Kobayashi等[20]注射5种不同发射波长的QDs到小鼠5个不同的位置,实现了同时对活体内的5种不同淋巴管和淋巴结的实时成像。Bhang等[21]研究发现,通过静电吸附透明质酸,可以延长QDs在淋巴管内的停留时间。Ballou等[22]通过缓慢灌输QDs至小鼠阴道,实时荧光动态观察QDs在阴道邻近淋巴结的运输情况,可见大部分QDs传输到腰淋巴结,少部分传输到腹股沟淋巴结,且其荧光强度最大值是在灌输后的36 h产生,证实QDs可以成功实现活体淋巴结成像,为宫颈癌及卵巢癌有无淋巴转移的检测及术中淋巴结清扫区域的选择提供了一个参考。宫颈癌及卵巢癌的淋巴结转移与肿瘤的进展和预后显著相关,QDs对宫颈癌及卵巢癌患者淋巴结的准确定位在其诊断和治疗中具有指导性意义。
2.3 肿瘤治疗实时成像 QDs的大比表面积使得QDs表面可以连接治疗药物和靶向物质对疾病进行治疗和观察,近年来,这种模式的QDs已广泛应用于宫颈癌及卵巢癌的治疗和药物示踪研究。Savla等[23]针对多药耐药的卵巢癌细胞,使用QDs-黏蛋白1-阿霉素复合物(QD-MUC1-DOX)靶向结合卵巢癌细胞,通过荧光显微镜检测可以对肿瘤治疗过程进行实时动态观察,结果显示QD-MUC1-DOX比DOX对卵巢癌细胞的特异性更高,且对癌细胞的抑制作用明显增强。Chen等[24]研究QDs对HeLa细胞的抑制作用,使用PEG修饰QDs表面与HeLa细胞共培养24 h后,对其抑制效应进行荧光实时检测,证实QDs可以通过抑制Rho激酶(ROCK)相关活性或者ROCK介导c-Myc蛋白的稳定性进而抑制HeLa细胞的增生。Li等[25]将具有治疗作用的siRNA通过静电结合在精氨酸-QDs载体表面,与HeLa细胞共培养一段时间后,流式细胞仪和共聚焦显微镜分析结果显示,该类载体能成功将siRNA导入HeLa细胞中,并抑制癌基因HPV18 E6的表达,从而抑制癌细胞的增殖和生长。QDs的强荧光性能使siRNA转染细胞的过程得到了示踪和呈现,也为宫颈癌的基因治疗带来了新的曙光。通过对宫颈癌和卵巢癌治疗的实时监测,有利于从细胞甚至分子层面理解药物的作用效果和分子机制,从而加快抗宫颈癌和卵巢癌新药的开发,为发展肿瘤治疗药物和手段提供新的思路。
3 展望
QDs以其独特的光学性质,已经在宫颈癌及卵巢癌的诊断和治疗成像研究中发挥了一定的作用,并且随着量子点合成修饰技术和现代光学成像技术的完善,QDs在未来生物医学基础研究中具有巨大的应用前景。然而,QDs在实际应用过程中也面临许多挑战,如小尺寸QDs的合成、表面修饰、生物分子耦联及其可能的急性、慢性毒性等。因此,只有通过改善QDs的合成并进一步研究其表面修饰,降低可能的毒性并更好地利用其荧光性能,以适应各种生物学上的应用。同时可以考虑与MRI、CT及PET等现有的成像技术相结合,并发展多光子显微技术、红外及近红外探针等,为实时动态监测细胞和生物活体内的分子变化提供强有力的实验手段。随着生物科学技术的进步,QDs将成为主流的荧光标记物广泛应用于生物分析、固定细胞成像、活细胞体外成像及动物体内靶向等方面,将为基因组学、蛋白质组学、药物筛选、生物大分子相互作用及病理诊断等研究提供更加有效的技术支持。
[1] 申茹萌, 洪颖, 金敏. 子宫颈癌筛查方法的选择. 中国实用妇科与产科杂志, 2010, 26(2): 157-159.
[2] Lin HW, Tu YY, Lin SY, et al. Risk of ovarian cancer in women with pelvic infammatory disease: a population-based study. Lancet Oncol, 2011, 12(9): 900-904.
[3] 彭卫军, 蒋朝霞. 影像学诊断方法在妇科肿瘤中的应用. 中国癌症杂志, 2012, 22(6): 441-446.
[4] 杨雪, 于宁, 李翔. 经阴道彩色多普勒超声联合血清CA125监测卵巢癌新辅助化疗的疗效. 中国医学影像学杂志, 2013, 21(3): 234-237.
[5] 高淑平. 宫颈癌诊断与治疗的新进展. 医学理论与实践, 2012, 25(12): 1446-1448.
[6] Guo Z, Hao T, Du S, et al. Multiplex electrochemiluminescenceimmunoassay of two tumor markers using multicolor quantum dots as labels and graphene as conducting bridge. Biosens Bioelectron, 2013, 44: 101-107.
[7] Cheng FF, Liang GX, Shen YY, et al. N-Acetylglucosamine biofunctionalized CdSeTe quantum dots as fuorescence probe for specifc protein recognition. Analyst, 2013, 138(2): 666-670.
[8] Jokerst JV, Raamanathan A, Christodoulides N, et al. Nanobio-chips for high performance multiplexed protein detection: determinations of cancer biomarkers in serum and saliva using quantum dot bioconjugate labels. Biosens Bioelectron, 2009, 24(12): 3622-3629.
[9] Al-Ogaidi I, Gou H, Aguilar ZP, et al. Detection of the ovarian cancer biomarker CA-125 using chemiluminescence resonance energy transfer to graphene quantum dots. Chem Commun (Camb), 2014, 50(11): 1344-1346.
[10] Zrazhevskiy P, Gao X. Quantum dot imaging platform for singlecell molecular profling. Nat Commun, 2013, 4: 1619.
[11] Chakraborty A, Maity AR, Jana NR. Folate and biotin based bifunctional quantum dot as fuorescent cell label. RSC Adv, 2014, 21(4): 10434-10438.
[12] Silva AA, de Deus SD, Silva MB, et al. Highly stable luminescence of CdSe magic-sized quantum dots in HeLa cells. Sens Actuators B Chem, 2014, 191: 108-114.
[13] Al-Jamal WT, Al-Jamal KT, Tian B, et al. Lipid-quanturn dot bilayer vesicles enhance tumor cell uptake and retention in vitro and in vivo. ACS Nano, 2008, 2(3): 408-418.
[14] Gao J, Chen K, Miao Z, et al. Affibody-based nanoprobes for HER2-expressing cell and tumor imaging. Biomaterials, 2011, 32(8): 2141-2148.
[15] Allen PM, Liu W, Chauhan VP, et al. InAs(ZnCdS) quantum dots optimized for biological imaging in the near-infrared. J Am Chem Soc, 2010, 132(2): 470-471.
[16] Yoo JS, Kim HB, Won N, et al. Evidence for an additional metastatic route: in vivo imaging of cancer cells in the primovascular system around tumors and organs. Mol Imaging Biol, 2011, 13(3): 471-480.
[17] Smith BR, Cheng Z, De A, et al. Real-time intravital imaging of RGD-quantum dot binding to luminal endothelium in mouse tumor neovasculature. Nano Lett, 2008, 8(9): 2599-2606.
[18] Kasuya G, Toita T, Furutani K, et al. Distribution patterns of metastatic pelvic lymph nodes assessed by CT/MRI in patients with uterine cervical cancer. Radiat Oncol, 2013, 8: 139.
[19] Powless CA, Aletti GD, Bakkum-Gamez JN, et al. Risk factors for lymph node metastasis in apparent early-stage epithelial ovarian cancer: implications for surgical staging. Gynecol Oncol, 2011, 122(3): 536-540.
[20] Kobayashi H, Hama Y, Koyama Y, et al. Simultaneous multicolor imaging of five different lymphatic basins using quantum dots. Nano Lett, 2007, 7(6): 1711-1716.
[21] Bhang SH, Won N, Lee TJ, et al. Hyaluronic acid-quantum dot conjugates for in vivo lymphatic vessel imaging. ACS Nano, 2009, 3(6): 1389-1398.
[22] Ballou B, Andreko SK, Osuna-Highley EA, et al. Nanoparticle transport from mouse vagina to adjacent lymph nodes. PLoS One, 2012, 7(12): e51995.
[23] Savla R, Taratula O, Garbuzenko O, et al. Tumor targeted quantum dot-mucin 1 aptamer-doxorubicin conjugate for imaging and treatment of cancer. J Control Release, 2011, 153(1): 16-22.
[24] Chen L, Qu G, Zhang C, et al. Quantum dots (QDs) restrain human cervical carcinoma HeLa cell proliferation through inhibition of the ROCK-c-Myc signaling. Integr Biol (Camb), 2013, 5(3): 590-596.
[25] Li JM, Zhao MX, Su H, et al. Multifunctional quantum-dot-based siRNA delivery for HPV18 E6 gene silence and intracellular imaging. Biomaterials, 2011, 32(31): 7978-7987.
宫颈肿瘤;卵巢肿瘤;正电子发射断层显像术;体层摄影术,X线计算机;量子点成像技术;综述
2014-06-18 【 修回日期】2014-10-28
(本文编辑 张春辉)
R737.3;O439
国家自然科学基金项目(81201691);江西省教育厅基金项目(GJJ13093)。
1.南昌大学第二附属医院 江西南昌 330006;2.南昌大学食品科学与技术国家重点实验室 江西南昌 330047
傅 芬 E-mail: fu_fen@163.com
10.3969/j.issn.1005-5185.2014.11.020
