冬凌草甲素对骨肉瘤细胞的凋亡诱导效应的研究
2014-03-10唐新桥朱宝玉王万春
唐新桥,朱宝玉,王万春
·药理毒理·
冬凌草甲素对骨肉瘤细胞的凋亡诱导效应的研究
唐新桥1,朱宝玉1,王万春2
目的:考察冬凌草甲素是否能诱导MG-63细胞凋亡。方法:用不同浓度的冬凌草甲素作用于MG-63细胞,用Hochest33258染色鉴定MG-63细胞凋亡的形态学特征;用流式细胞仪分析MG-63早期凋亡细胞的百分率;用Caspase-8蛋白印迹分析证明MG-63细胞凋亡发生的分子特征。结果:凋亡细胞形态学鉴定、流式细胞仪检测均有力证明冬凌草甲素能以浓度依赖性方式诱导MG-63细胞凋亡;冬凌草甲素诱导MG-63细胞凋亡伴有Caspase-8蛋白表达上调和裂解激活。结论:冬凌草甲素能以浓度依赖性方式诱导MG-63细胞凋亡。
冬凌草甲素;人骨肉瘤细胞株MG-63细胞;凋亡;分子机制
多项研究表明,冬凌草甲素能抑制前列腺癌[1]、乳腺癌[2]、肝癌[3]、肺癌[4]和血液系统肿瘤[5]等多种肿瘤的发生发展,在临床治疗恶性肿瘤方面展示出良好的应用前景。其具体作用机制尚不甚清楚,有研究认为增殖抑制是冬凌草甲素抗肿瘤作用的重要环节之一,也有研究发现冬凌草甲素抗肿瘤作用常常与其诱导肿瘤细胞凋亡有关[6]。为了解冬凌草甲素对人骨肉瘤细胞MG-63细胞株是否具有凋亡诱导效应,作者在体外条件下对不同浓度冬凌草甲素干预的MG-63细胞的凋亡现象进行了研究。
1 材料和方法
1.1 实验材料
人骨肉瘤细胞株MG-63细胞引自中南大学湘雅二医院内分泌研究所。冬凌草甲素购自中国科学院昆明植物研究所。Hochest33258染料购自凯达生物公司。兔抗人Caspase-8抗体为StressGen 公司产品;ECL(Enhanced chemiluminescence)试剂盒购自Amersham公司;Annexin V-FITC/PI凋亡试剂盒购自BECTON DICKINSON公司。BD FACSCalibur型流式细胞仪为美国BECTON DICKINSON公司产品;Lamda-Bio10型紫外分光光度计为美国Perkin Elmer公司产品;PAC200型电泳转膜系统及Mini-PROTEAN II 电泳槽为美国Bio-Rad公司产品;自动X光冲片机和胶片为美国柯达公司产品。
1.2 研究方法
1.2.1 细胞培养 液氮内取出冻存的人骨肉瘤细胞株MG-63细胞,复苏后贴壁生长,传代培养。取对数生长期的MG-63细胞,制成细胞悬液,待用。
1.2.2 Hochest33258染色检测细胞凋亡 取对数生长期的MG-63细胞,胰蛋白酶消化,制成细胞悬液,调整细胞数为3.0×105个/mL,接种于无菌6孔培养板中,每孔2 mL。各实验组加入等体积不同浓度的冬凌草甲素,混匀,使冬凌草甲素终浓度分别为
12.5 、25、50 μmol.L-1,对照组加等体积DMSO。48小时后,离心去液体,用冷的PBS洗两遍,涂片,1 mL 4%的甲醛溶液4℃固定10 min,PBS洗两遍,滴加100 μL Hochest33258工作液,室温下放置10分钟,冲洗干净,自然风干,在荧光显微镜下紫外光340 nm波长激发观察。立即在荧光显微镜下观察并照相,镜下随机计数10个视野,按以下公式计算细胞凋亡率:凋亡率(%)=(凋亡细胞数/总细胞数)×100%,重复3次。
1.2.3 Annexin V-FITC/PI双标记法检测细胞早期凋亡 取对数生长期的MG-63细胞,胰蛋白酶消化,制成细胞悬液,调整细胞数为3.0×105个/mL,接种于无菌6孔培养板中,每孔2 mL,各实验组加入等体积不同浓度的冬凌草甲素,混匀,使冬凌草甲素终浓度分别为12.5、25、50 μmol.L-1,对照组加入等体积DMSO。分别培养24和48小时后,1000 rpm离心5分钟,弃上清后消化收集细胞,流式细胞仪上进行Annexin V检测(按试剂盒说明书进行操作,步骤略)。
1.2.4 Western印迹检测Caspase-8蛋白表达 取对数生长期的MG-63细胞,胰蛋白酶消化,制成细胞悬液,调整细胞数为3.0×105个/mL,接种于无菌培养瓶中。各实验组加入等体积不同浓度的冬凌草甲素,混匀,使冬凌草甲素终浓度分别为12.5、25、50 μmol.L-1,对照组加等体积DMSO。48小时后,收集细胞,按常规步骤抽提蛋白质,Bradford 法测定蛋白质含量,SDS聚丙烯酰胺凝胶电泳,将凝胶中的蛋白质电转至PVDF膜,加入兔抗人Caspase-8抗体孵育,ECL试剂盒检测液Caspase-8蛋白信号,自动X光冲片机冲片。
1.2.5 统计学分析 不同药物浓度处理组与对照组的细胞凋亡率比较采用t检验分析;各种统计图采用SPSS11.5 for windows及Microcoft Excel统计软件获得。
2 结果
2.1 Hochest33258染色结果
对照组MG-63细胞的细胞核界限清晰,呈圆形或椭圆形,为均匀蓝绿色荧光,染色质分布均匀(图2-1A);冬凌草甲素处理后的细胞,部分细胞的细胞核缩小,染色质凝集呈颗粒团状分布,有的核碎裂形成多个球形颗粒(图2-1B箭头所示)。经12.5 μmol.L-1冬凌草甲素处理后,MG-63细胞的凋亡率为12.6±1.6%,是对照组的3.8倍(凋亡率为3.3±0.8%),干预组与对照组相比差异显著,具有统计学意义(P<0.05);用浓度分别为25 μmol.L-1和50 μmol.L-1的冬凌草甲素处理后,MG-63细胞的凋亡率分别是对照组的5.3倍和7.8倍,差异有显著的统计学意义(P<0.01)(图2-2及表2-1)。根据Hochest33258染色结果可以看出,冬凌草甲素有诱导MG-63细胞凋亡的作用,且随着药物浓度的增高,细胞的凋亡率也逐渐增高。
表1 冬凌草甲素对MG-63细胞凋亡率(%)影响(Hochest33258染色)()

表1 冬凌草甲素对MG-63细胞凋亡率(%)影响(Hochest33258染色)()
注:与对照组比较,* P<0.05;* *P<0.01
干预时间 对照组 12.5 μmol.L-125 μmol.L-150 μmol.L-148hr 3.3±0.8 12.6±1.6* 17.3±1.9* 26.0±2.5 **
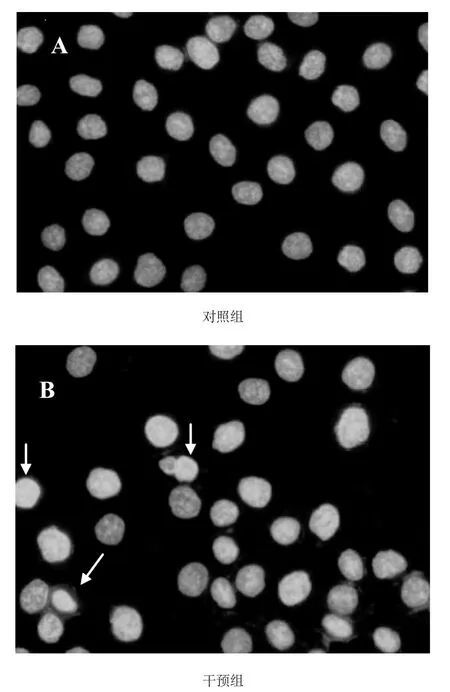
图1 正常细胞和50 μmol.L-1冬凌草甲素干预后MG-63细胞Hochest33258染色结果(×400)
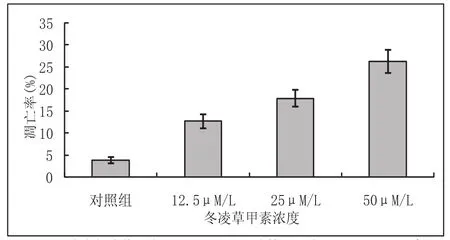
图2 不同浓度冬凌草甲素处理后MG-63细胞的凋亡率:Hochest33258染色(3次独立实验结果)
2.2 Annexin V-FITC/PI双标记法检测MG-63细胞早期凋亡结果
流式细胞仪检测MG-63细胞的早期凋亡率结果显示,经不同浓度的冬凌草甲素(0,12.5,25,50 μmol.L-1)干预48小时后,MG-63细胞的早期凋亡率分别为3.94%±0.92%,13.242%±2.32%,18.87%±3.19%和25.33%±3.86%,即随着药物浓度的增加,MG-63细胞的早期凋亡率也逐渐增加,且差异明显(P<0.05);在相同的药物浓度下,对照组24小时的早期凋亡率为3.65%±0.82%,12.5 μmol.L-1组为8.25%±2.54%,25 μmol.L-1组为10.72%±2.98%,50 μmol.L-1组为14.12%±3.63%。可见在相同的药物浓度下,24小时 MG-63细胞的早期凋亡率明显低于48小时,尤其是25 μmol.L-1组与50 μmol.L-1组,差异非常显著(P<0.01)(表1及图1,图2),由此可见冬凌草甲素诱导的MG-63细胞早期凋亡呈时间和浓度依赖性。

图3 不同浓度冬凌草甲素处理后MG-63细胞的早期凋亡率:Annexin V-FITC/PI染色
冬凌草甲素分别干预24 hr和48 hr后,随着药物浓度的提高,MG-63细胞的早期凋亡率逐步增加;在相同浓度的药物干预下,MG-63细胞48 hr的早期凋亡率明显高于24 hr,即MG-63细胞的早期凋亡率表现出对冬凌草甲素的浓度与时间的依赖性。
表2 冬凌草甲素对MG-63细胞早期凋亡率(%)影响(Annexin V-FITC/PI染色)()

表2 冬凌草甲素对MG-63细胞早期凋亡率(%)影响(Annexin V-FITC/PI染色)()
注:在同一时间内,与对照组比较,* P<0.05;* *P<0.01 ;在同一浓度内,48 hr 的细胞凋亡率与24hr 的比较,▲P<0.05
干预时间 对照组 12.5 μmol.L-125 μmol.L-150 μmol.L-124hr 3.65±0.82 8.25±2.54 10.72±2.98 * 14.12±3.63 * 48hr 3.94±0.92 13.242±2.32 * 18.87±3.19*▲25.33±3.86 **▲
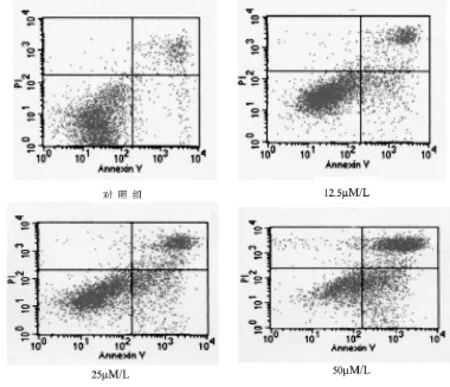
图4 Annexin V-FITC/PI染色检测48小时后冬凌草甲素对MG-63细胞早期凋亡率的影响
四格中右下格代表膜完整的凋亡细胞数,右上格代表晚期凋亡细胞和坏死细胞数,左下格代表正常活细胞数,左上格代表消化、收集过程中出现的损伤细胞数。与对照组相比,随着冬凌草甲素浓度增加,MG-63细胞早期凋亡细胞数、晚期凋亡细胞和坏死的细胞数逐渐增多。
2.3 Western印迹检测Caspase-8蛋白表达的结果
从Western印迹可以看出(见图5),对照组与12.5 μmol.L-1冬凌草甲素处理组的Caspase-8蛋白表达较微弱,但无裂解激活;从25 μmol.L-1浓度开始到50 μmol.L-1浓度,Caspase-8表达逐步上调,并且出现裂解激活片段。上述结果提示,冬凌草甲素可以浓度依赖性方式使Caspase-8表达上调和裂解激活,冬凌草甲素诱导的MG-63细胞凋亡涉及到Caspase信号转导途径。

图5 冬凌草甲素诱导MG-63细胞凋亡伴Caspase-8蛋白表达上调及裂解激活的Western印迹结果
1-4泳道分别代表0、12.5 μmol.L-1、25 μmol.L-1和50 μmol.L-1的冬凌草甲素浓度组。
3 讨论
为了解冬凌草甲素对MG-63细胞是否具有凋亡诱导作用,作者通过对药物作用后的MG-63细胞进行Hochest33258染色分析和流式细胞仪分析,以证明凋亡现象的发生。将膜联蛋白V(Annexin V)与碘化丙啶(Propidine iodide, PI)匹配使用,可以把凋亡早晚期的细胞和已经死亡的细胞区分开来:正常细胞Annexin V-FITC和PI染色均为阴性,早期凋亡阶段的细胞Annexin V-FITC阳性而PI阴性,晚期凋亡阶段和已经死亡的细胞Annexin V-FITC和PI染色均为阳性[7~9]。本实验用不同浓度的冬凌草甲素干预MG-63细胞,经Annexin V-FITC和PI染色,用流式细胞仪检测其凋亡率。结果发现经不同浓度的冬凌草甲素干预不同时间后,随着药物浓度的升高和干预时间的延长,细胞早期凋亡率逐渐增加;冬凌草甲素对MG-63细胞早期凋亡的诱导呈时间和浓度依赖性。为进一步研究冬凌草甲素凋亡诱导效应,作者同时用Hochest33258染色方法对MG-63细胞晚期凋亡进行检测。结果显示,冬凌草甲素处理后的细胞,部分细胞的细胞核缩小,染色质凝集呈颗粒团状分布,有的核碎裂形成多个球形颗粒,与对照组相比差异显著(P<0.05)。实验证明冬凌草甲素有诱导MG-63细胞凋亡的作用。由此可见,Annexin V-FITC和PI染色以及Hochest33258染色分析两种实验方法均有力证明冬凌草甲素可诱导MG-63细胞凋亡,其诱导细胞凋亡的作用呈剂量和时间依赖性。
死亡信号转导途径在凋亡的激活过程中具有重要作用,该途径又可分为内源性和外源性两条途径:内源性死亡信号转导途径是由诱导凋亡的物质作用于死亡途径的受体,下传信号,激活Caspases;外源性死亡信号转导途径是由诱导凋亡的物质直接作用于线粒体,释放细胞色素C,激活Caspases。Caspases裂解激活后,最终作用是将DNA降解为180-200bp及其整数倍的片段,故Caspases在凋亡过程中处于中心地位。Caspase-8是凋亡的启动子,能够通过寡聚而自身切割活化,并能激活下游Caspases,产生凋亡效应,其表达和裂解激活是反应凋亡启动和发生的分子标志。
本实验中,作者用灵敏度很高的Western印迹分析了Caspase-8裂解激活情况。结果清楚的显示,12.5 μmol.L-1的冬凌草甲素组即可上调Caspase-8蛋白表达,25 μmol.L-1的冬凌草甲素组开始出现裂解激活,随着冬凌草甲素浓度的增加,Caspase-8的裂解激活也越明显,呈现明显的药物浓度依赖性活化。以上证据清楚的表明,冬凌草甲素在诱导MG-63细胞凋亡的同时可伴有Caspase-8的表达上调和裂解激活,并呈药物浓度依赖性;冬凌草甲素诱导MG-63细胞凋亡的机制涉及到Caspase-8活化的信号转导途径。
本研究通过凋亡形态学和分子生物学等不同角度证实了冬凌草甲素对MG-63细胞具有显著的凋亡诱导效应,并呈浓度依赖性,提示冬凌草甲素通过诱导MG-63细胞凋亡而具有抗骨肉瘤效应,这为冬凌草甲素用于骨肉瘤的治疗提供了有用的实验依据。
[1] Ikezoe T, Chen S, Heber D, et al. Baicalin is a major component of PC SPES which inhibits the proliferation of human cancer cells via apoptosis and cell cycle arrest[J]. Prostate, 2001, 49: 285.
[2] Hsieh TC, Wijeratne EK, Liang JY, et al. Differential control of growth, cell cycle progression, and expression of NF kappaB in human breast cancer cells MCF 7, MCF 10A, and MDA MB 231 by ponicidin and oridonin, diterpenoids from the chinese herb Rabdosia rubescens[J]. Biochem Biophys Res Commun, 2005, 337(1): 224.
[3] Zhang JF, Liu JJ, Liu PQ, et al. Oridonin inhibits cell growth by induction of apoptosis on human hepatocellular carcinoma BEL 7402 cells[J]. Hepatol Res, 2006, 35: 104.
[4] Leung CH, Grill SP, Lam W, et al. Novel mechanism of inhibi¬tion of nuclear factor kappa B DNA binding activity by diterpenoids isolated from Isodon rubescens[J]. Mol Pharmacol, 2005, 68: 286.
[5] Ikezoe T, Yang Y, Bandobashi K, et al. Oridonin, a diterpenoid purifed from Rabdosia rubescens, inhibits the prolif¬eration of cells from lymphoid malignancies in association with blockade of the NF kappa B signal pathways[J]. Mol Cancer Ther, 2005, 4(4): 578.
[6] 曲佳,郭坤元,昊秉毅,等.冬凌草甲素诱导人多发性骨髓瘤ARH-77细胞凋亡及其可能机制[J].中国肿瘤生物治疗杂志, 2010,17(2):134.
[7] 段国庆,李书忠.凋亡抑制蛋白Survivin在骨肉瘤中的表达及其与PTEN cyclinD1蛋白表达的关系 [J].中国矫形外科杂志, 2007,3(15): 217.
[8] 聂涛,戴闽,宗世璋.Survivin在骨肉瘤中的表达及其与血管内皮生长因子的相关性研究[J].中国矫形外科杂志, 2005, 13 (9): 683.
[9] Trieb K, Lehner R, Stulnig T, et al. Survivin expression in human osteocarcoma is a marker for survival [J]. Eur J Surg Oncol, 2003, 29(4):379.
(责任编辑:陈思敏)
Apoptosis-inducing effect of Oridonin on Osteosarcoma MG-63 cells
TANG Xin-qiao1, ZHU Bao-yu1, WANG Wan-chun2// (1. Orthopedics, Xiangtan Central Hospital, Xiangtan 411100, Hunan; 2. Orthopedics, the Second Xiangya Hospital of Central South University, Changsha 410011, Hunan)
Objective:To investigate the effect of oridonin on the apoptosis of osteosarcoma MG-63 cells.Method:After MG-63 cells were incubated with different concentrations of Oridonin, the morphologic character of apoptosis was evaluated by Hochest33258 staining. The percentage of earlier apoptosis cell was analyzed by flow cytometry. The molecular character of apoptosis was analyzed by Western blot detecting Caspase-8 expression.Result:Hochest33258 staining and fow cytometry detection powerfully testifed that Oridonin could induce the apoptosis of MG-63 cells in a concentration-dependent way. The apoptosis of MG-63 cells induced by Oridonin was found to be companied with up-regulation and cleavage of Caspase-8.Conclusion:Oridonin can induce the apoptosis of MG-63 cells with a concentration-dependent manner.
Oridonin;osteosarcoma MG-63 cells;apoptosis;molecular mechanism
R 285.5
A
1674-926X(2014)04-006-04
1.湘潭市中心医院骨科,湖南 湘潭 411100;2.中南大学湘雅二医院骨科,湖南 长沙 410011
唐新桥(1965-),男,湖南邵阳人,汉族,博士,主任医师,主要从事骨科创伤、肿瘤的医疗与研究 Email:Zhubaoyu101@163.com
2013-11-20
