冬凌草滴丸大鼠体内药动学研究*
2022-03-28谢涛杨婷郑大勇李伟于德红韩倩
谢涛,杨婷,郑大勇,李伟,于德红,韩倩
(1.华北理工大学药学院,唐山 063210;2.河南省人民医院放疗科,郑州 450003)
冬凌草为唇形科(Labiatae)植物碎米桠Rabdosiarubescens(Hemsl.)Hara的干燥地上部分,收载于《中华人民共和国药典》(2020版)中,其味苦甘,性微寒;归肺、胃、肝经;有清热解毒、活血止痛的功效[1]。冬凌草的主要有效成分为二萜类化合物,现代药理研究表明,其具有抗肿瘤,抗炎、抗菌,抗氧化和免疫增强等药理作用[2],其中冬凌草甲素(Oridonin)与冬凌草乙素(Ponicidin)是其主要的两种二萜类活性成分。
中药滴丸是在中药丸剂基础上发展的一种新剂型,与传统的中药制剂相比较,具有生物利用度高、速效、高效、毒副作用小、制备简单、安全性好等优点[3]。冬凌草滴丸是由冬凌草精制而成的中药滴丸制剂,进入《2019版国家医保药品目录》,具有清热解毒、消肿散结、利咽止痛的功效。用于热毒壅盛所致咽喉肿痛、声音嘶哑、扁桃体炎、咽炎、口腔炎等疾病。冬凌草滴丸对复发性口腔溃疡、牙龈炎等有较为显著的疗效,其临床应用已有相关文献报道。邓旭霞等[4]、CHEN等[5]研究发现,冬凌草滴丸能明显改善患者的牙龈红肿、牙龈疼痛、牙龈出血等。且CHEN等[5]发现相较于冬凌草片,冬凌草滴丸疗效更为显著。同时,冬凌草滴丸中主要的两种活性成分冬凌草甲素和冬凌草乙素在癌症辅助治疗方面已取得了较为显著的疗效[6-7],可见冬凌草滴丸是非常有前景的中药制剂。
目前,已有研究报道了几种测定生物样品中冬凌草甲素和冬凌草乙素的方法,包括高效液相色谱(HPLC)法测定兔血浆[8]和大鼠血浆[9]中的冬凌草甲素,犬血浆[10]中的冬凌草乙素,其定量限分别为20,50,20 ng·mL-1;高效液相色谱-串联质谱法(LC-MS/MS)测定犬血浆中冬凌草甲素[11]、冬凌草乙素[12],其定量限分别为12.5,5 ng·mL-1。其中包括了诺胃口服给药、静脉注射给药等给药方式,尚未有不同给药剂量下冬凌草甲素和冬凌草乙素的药动学研究。本文采用LC-MS/MS技术建立同时测定大鼠血浆中的冬凌草甲素和冬凌草乙素的方法,定量限更低,分别为2、1 ng·mL-1,并对大鼠灌胃给予小(0.3 g·kg-1)、中(0.9 g·kg-1)、大(2.7 g·kg-1)剂量以及累积剂量(0.9 g·kg-1,连续给药7 d)的冬凌草滴丸后冬凌草甲素和冬凌草乙素的药动学特征进行了研究,以期为冬凌草滴丸的临床应用和进一步研发提供数据支持。
1 材料与方法
1.1材料
1.1.1药品 冬凌草滴丸,河南百年康鑫药业有限公司,批号:21191101,规格:每丸40 mg(含冬凌草甲素18.20 mg·g-1、冬凌草乙素0.61 mg·g-1)。
1.1.2仪器 AB Qtrap5500液质联用仪(液相部分为岛津UHPLC,其组成分别为LC-30AD二元泵,SIL-30AC自动进样器,CTO-30A柱温箱);JW-3021 HR高速冷冻离心机(安徽省嘉文仪器装备有限公司),MX-S旋涡混匀仪(美国塞洛捷克),Thermo Gen Pure xCAD Plus型超纯水机。
1.1.3试剂 冬凌草甲素对照品(中国食品药品检定研究院,含量≥98%,批号:111721-201704)、冬凌草乙素对照品(成都埃法生物科技有限公司,含量≥98%,批号:201901-190112)、苯海拉明(中国食品药品检定研究院,纯度≥99.9%,批号:100066-200807)。甲醇(Merck KGaA,Darmstadt,Germany,LC-MS级),甲酸(Sigma-Aldrich,Germany,LC-MS级),整个实验用水取自Thermo超纯水机。
1.1.4动物 雄性SPF级Sprague-Dawley大鼠,体质量200~250 g,北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2016-0011。实验前7 d,动物在室温条件下[(25±2) ℃],12 h明暗循环)饲养,给药前12 h禁食,给药后及其他时间自由食用食物和水。所用实验动物均通过华北理工大学实验动物中心伦理审查,按照动物护理与使用指南进行操作,许可证号:SYXK(冀)2020-0038。
1.2方法
1.2.1分析方法 ①色谱条件。色谱柱为Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相为A(0.2%甲酸水):B(甲醇)= 50:50(V:V);流速为0.3 mL·min-1;洗脱时间为3.8 min(切换阀1.0~3.6 min进质谱);柱温为40 ℃;进样量为10 μL。
②质谱条件。电喷雾离子源(ESI),正离子模式扫描,多反应监测模式检测(MRM),离子喷雾电压(ion spray voltage)为5500 V,离子源温度(temperature)为500 ℃,Gas1:55,Gas2:55,气帘气(curtain gas)为30 kPa,射入电压(EP)为10 V,碰撞室射入电压(CXP)为 13 V。冬凌草甲素、冬凌草乙素和苯海拉明(内标,IS)的去簇电压(DP)分别为80,120和50 V,碰撞电压(CE)分别为13.5,16.5和20 V;用于定量的离子对分别为冬凌草甲素m/z365.3→347.3,冬凌草乙素m/z363.3→345.2,苯海拉明m/z256.3→167.2。见图1。

图1 冬凌草甲素(A)、冬凌草乙素(B)和苯海拉明(C)的质谱图Fig.1 Mass spectrograms of oridonin (A), ponicidin (B) and diphenhydramine (C)
1.2.2溶液制备 ①对照品溶液制备。精密称取冬凌草甲素、冬凌草乙素对照品适量,用甲醇溶解、稀释,配制得冬凌草甲素、冬凌草乙素浓度分别为100 μg·mL-1,50 μg·mL-1的对照品储备液,放于冰箱4 ℃保存备用。②内标溶液的制备。精密量取苯海拉明(内标)1 mg,用50%甲醇溶液溶解、稀释,配制得10 ng·mL-1内标溶液,即得。放于冰箱4 ℃保存,备用。
1.2.3分组给药、血浆样品采集及处理 ①给药液配制。取冬凌草滴丸适量研磨成粉末,加入0.5%的羧甲基纤维素钠,超声混匀,制得浓度分别为20,60,180 mg·mL-1的低、中、高3种剂量浓度的冬凌草滴丸给药液,3种剂量分别含有冬凌草甲素、冬凌草乙素为0.364,0.012 mg·mL-1(低);1.092,0.036 mg·mL-1(中);3.276,0.108 mg·mL-1(高)。②给药与血浆样品采集。SD雄性大鼠24只,随机分为4组,每组6只,分别为:小剂量组、中剂量组、大剂量组和中剂量多次给药组,受试大鼠预适应1周,于实验前12 h禁食不禁水。经物种计量换算后,以冬凌草滴丸计,分别灌胃给予小剂量组(0.3 g·kg-1,临床给药剂量)、中剂量组(0.9 g·kg-1)、大剂量组(2.7 g·kg-1)3种剂量浓度的冬凌草滴丸给药液,并于给药前(0 h)和给药后0.08,0.25,0.5,1.0,1.5,2.0,3.0,4.0,6.0,8.0 h经大鼠眼球后静脉丛采集静脉血约0.2 mL;中剂量多次给药组间隔24 h连续7 d灌胃给予中剂量的冬凌草滴丸给药液(0.9 g·kg-1),并于给药后的每天早上给药前取血0.2 mL,第7天给药后,于给药前(0 h)和给药后0.08,0.25,0.5,1.0,1.5,2.0,3.0,4.0,6.0,8.0 h经大鼠眼球后静脉丛采集静脉血0.2 mL。每次采血后即刻置于肝素化试管中,4000 r·min-1离心10 min,分离血浆(于-80 ℃冰箱中冷冻备测)。③血浆样品处理。取大鼠血浆样品50 μL,加入内标溶液50 μL,加入1 mL乙酸乙酯,涡旋3 min,12 000 r·min-1离心3 min,取上清乙酸乙酯层900 μL,于35 ℃下氮气吹干,加50%甲醇溶液80 μL复溶,12 000 r·min-1离心5 min(r=5 cm),取上清液70 μL至内插管中,进样分析。
1.2.4方法学考察 ①专属性考察。取空白血浆50 μL,除内标液以等量50%甲醇溶液代替外,其余按“1.2.3”项下血浆样品处理方法操作后进样分析;取加入了冬凌草甲素、冬凌草乙素对照品溶液(含内标)的空白血浆、给药后血浆样品(冬凌草滴丸小剂量组给药后8 h取血点)各50 μL,按“1.2.3”项下血浆样品处理方法操作并进行测定,得到相应色谱图,确定血浆中内源物质对待测组分的干扰情况。

A.空白大鼠血浆色谱图;B.空白大鼠血浆加入冬凌草甲素、冬凌草乙素和内标的色谱图;C.大鼠血浆样品测定色谱图。峰1为冬凌草甲素;峰2冬凌草乙素;峰3为苯海拉明。图2 冬凌草甲素、冬凌草乙素和苯海拉明的色谱图A.Chromatogram of blank rat plasma;B.Chromatogram of blank rat plasma with oridonin, ponicidin and internal standard;C.Chromatogram of plasma sample.Peak 1, peak 2 and peak 3 were oridonin, ponicidin and diphenhydramine respectively.Fig.2 Chromatogram of oridonin, ponicidin and diphenhydramine
②标准曲线与定量限。取空白血浆50 μL,分别加入系列浓度的标准品溶液各50 μL,内标液50 μL,混匀后得到含冬凌草甲素分别为512,256,128,64,32,16,8,4,2 ng·mL-1和冬凌草乙素分别为256,128,64,32,16,8,4,2,1 ng·mL-1的标准血浆样品,按照“1.2.3”项下血浆样品处理方法操作,每一浓度平行6份,进行测定,记录色谱图。以待测物浓度为X轴,待测物与内标物的峰面积比值为Y轴,用加权(W=1/χ2)最小二乘法进行回归运算。取空白血浆按“1.2.3”项下血浆样品处理方法操作,制备低浓度血浆样品,计算色谱峰信噪比数据,连续进样6次验证(S/N>10)。
③精密度和准确度。取空白血浆50 μL,按“1.2.3”项下血浆样品处理方法操作制备小、中、大3个浓度的质量控制(QC)样品。其中冬凌草甲素的浓度分别为4.25,65.00,410.00 ng·mL-1,冬凌草乙素的浓度分别为2.09,32.38,205.50 ng·mL-1。每一浓度平行6份,连续测定3 d,根据当日的标准曲线,计算质控样品的测得浓度,根据质控样品的测定结果计算方法的精密度与准确度。
④提取回收率与基质效应。按“③精密度和准确度”项下制备低、中、高3个浓度的QC样品,每一浓度各6份样本,按“1.2.3”项下血浆样品处理方法操作,进样分析,测定待测物峰面积与内标峰面积之比为A1(6次进样平均值);同时另取空白大鼠血浆50 μL,除不加内标溶液外,其余按“1.2.3”项下血浆样品处理方法操作,向上清液中加入相应低、中、高浓度的标准溶液50 μL和内标溶液50 μL,涡流混合,35 ℃氮气流下吹干,残渣加50%甲醇溶液80 μL复溶,12 000 r·min-1离心5 min(r=5 cm),取上清液70 μL至内插管中,进样分析,测得待测物峰面积与内标峰面积之比为A2(3次进样平均值),则回收率R=A1/A2×100%;同法以流动相代替空白血浆以上述方法处理,进样分析,测定待测物峰面积与内标峰面积之比为A0,则基质效应M=A2/A0×100%。计算内标归一化的基质因子要求 RSD不得大于15%。
⑤稳定性。取“③精密度和准确度”项下低、高两个浓度的QC样品(冬凌草甲素的浓度分别为4.25,410.00 ng·mL-1,冬凌草乙素的浓度分别为2.09,205.50 ng·mL-1),每个质量浓度各3份,分别考察在室温放置0,4,10,16,24 h的稳定性;-80 ℃下经3次冷冻-解冻循环处理的稳定性、-80 ℃下冷冻保存30 d的稳定性、自动进样器(4 ℃)中放置24 h后的稳定性以及全血样品(除以等量全血代替空白血浆外,与QC样品同样操作处理)在室温、4 ℃、-20 ℃3种条件下放置1,3,5 d的稳定性。
1.2.5药动学研究 不同剂量组在大鼠体内药动学研究给药、取血方案和血浆样品处理方法如“1.2.3”项所述,血浆样品处理后按“1.2.1分析方法”项下所述方法进行检测,计算不同时间点血药浓度,绘制药-时曲线图,所得数据用 DAS 3.0版软件进行处理,采用非房室模型计算主要药代动力学参数。
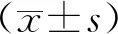
2 结果
2.1方法学评价
2.1.1专属性 冬凌草甲素与冬凌草乙素分别在2.98,1.70 min左右出峰,内标苯海拉明在2.11 min左右出峰,峰形对称,表明血浆中内源性物质不干扰测定,专属性强,色谱图见图2。
2.1.2标准曲线与定量限 冬凌草甲素的线性方程为:Y=0.00 204X+0.004 580,相关系数r=0.997,权重为1/χ2,在2~512 ng·mL-1浓度范围内线性良好,定量限为2.0 ng·mL-1(S/N>10);冬凌草乙素的线性方程:Y=0.002 12X+0.001 78,相关系数r=0.997,权重为1/χ2,1~256 ng·mL-1浓度范围内线性良好,定量限为1.0 ng·mL-1(S/N>10),能满足血浆样品中冬凌草甲素和冬凌草乙素的含量测定。
2.1.3精密度和准确度 低、中、高3个浓度生物质控样品精密度与准确度良好,测得结果表明两成分日内及日间RSD均不超过8.4%,准确度水平均大于98.70%,均符合生物样品分析要求,结果见表1。

表1 大鼠血浆中冬凌草甲素和冬凌草乙素的准确度与精密度 Tab.1 Accuracy and precision of oridonin and ponicidin in rat plasma
2.1.4提取回收率与基质效应 低、中、高3个浓度的生物质控样品回收率良好,冬凌草甲素的提取回收率为75.40%~82.40%,冬凌草乙素的提取回收率为75.30%~88.60%,两成分RSD均不超过8.9%,符合生物样品分析要求,基质效应考察结果为85.30%~105.31%,RSD<9.7%,未见内源物质干扰测定,结果见表2。

表2 大鼠血浆中冬凌草甲素和冬凌草乙素的提取回收率与基质效应 Tab.2 Extraction recovery and matrix effect of oridonin and ponicidin in rat plasma
2.1.5稳定性 含药血浆在室温放置0,4,10,16,24 h,-80 ℃下经3次冷冻-解冻循环处理、-80 ℃下冷冻保存30 d和自动进样器(4 ℃)中放置24 h后四种条件下,冬凌草甲素的低、高浓度血浆样品RSD均不超过10.6%,冬凌草乙素的低、高浓度血浆样品RSD均不超过11.3%,可见稳定性良好,符合生物样品分析要求,结果见表3。全血样品在室温4 ℃,-20 ℃3种条件下放置1,3,5 d的稳定性良好,RSD均不超过11.7%,符合生物样品分析要求,结果见表4。
表3 大鼠血浆中冬凌草甲素和冬凌草乙素的常规稳定性Tab.3 Conventional stability of oridonin and ponicidin in rat plasma %,n=6
表4 冬凌草甲素和冬凌草乙素的全血稳定性 Tab.4 Whole blood stability of oridonin and ponicidin n=6
2.2药动学研究结果
2.2.1中剂量多次给药组 给药前6 d的血样中未检测到冬凌草甲素与冬凌草乙素,小、中、大剂量组中冬凌草甲素与冬凌草乙素的平均血药浓度-时间曲线,见图3。根据所得血药浓度数据经SPSS 26.0版软件处理,药动学参数分别见表5,表6。

表5 冬凌草甲素在大鼠体内的药动学参数Tab.5 Pharmacokinetic parameters of oridonin in rats

表6 冬凌草乙素在大鼠体内的药动学参数Tab.6 Pharmacokinetic parameters of ponicidin in rats

图3 冬凌草甲素和冬凌草乙素的平均血药浓度-时间曲线Fig.3 Mean blood concentration time curve of oridonin and ponicidin
2.2.2冬凌草滴丸 中剂量单次给药与中剂量多次给药后,冬凌草甲素的消除半衰期t1/2β分别为(2.54±1.17)和(2.85±0.82) h,冬凌草乙素的消除半衰期t1/2β分别为(2.56±0.45)和(2.73±0.62) h,均差异无统计学意义,药时曲线对比见图4。

图4 单次给药与多次给药冬凌草甲素与冬凌草乙素的药时曲线Fig.4 Drug concentration-time curves of single and multiple doses of oridonin and ponicidin
2.2.3置信区间法 分析小、中、大3个剂量组(0.3,0.9,2.7 g·kg-1)下,冬凌草甲素ln(Cmax)、ln(AUC0-t)与ln(Dose)的线性方程为Y=0.867X+5.272(R2=0.912)、Y=0.921X+5.431 (R2=0.942);冬凌草乙素ln(Cmax)、ln(AUC0-t)与ln(Dose)的线性方程为Y=0.861X+3.552 (R2=0.904)、Y=0.961X+4.163 (R2=0.901),斜率均接近1,见图5,图6。
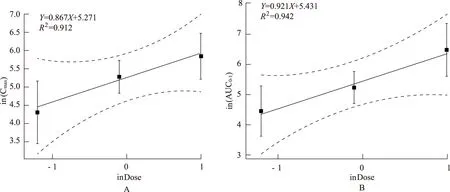
虚线为90%置信区间,A.Cmax;B.AUC0-t。图5 冬凌草甲素lnPK与ln(剂量)的线性关系The dotted line is the 90% confidence interval.A.The relationship between lnCmax and lnDose;B.The relationship between lnAUC0-t and lnDoseFig.5 The relationship between lnPK and lnDose of oridonin
3 讨论
在本实验中,首先探讨了甲醇或乙腈[13]为溶剂的蛋白质沉淀法处理血浆样品的效果,结果显示样品中冬凌草乙素低于方法的检测限,且提取回收率较低,故选用液-液萃取法。分别考察乙酸乙酯、二氯甲烷[14]作为萃取剂的效果,结果显示乙酸乙酯萃取的提取回收率较高为75.3%~88.6%,可能是乙酸乙酯的沸点(77 ℃)相较于二氯甲烷(39 ℃)更高,更加稳定,所以选取乙酸乙酯作为萃取剂。冬凌草滴丸中剂量单次给药和冬凌草滴丸中剂量多次给药后,药物吸收迅速,冬凌草甲素血药浓度均约在0.2 h达最大值,t1/2β均约为2.5 h;冬凌草乙素血药浓度均约在0.3 h达最大值,t1/2β均约为2.6 h,且单次给药和多次给药后,冬凌草甲素与冬凌草乙素的消除半衰期t1/2β均差异无统计学意义,说明长期给药后冬凌草甲素与冬凌草乙素在大鼠体内的吸收、分布、代谢和排泄未显著改变,不存在药物蓄积的风险[15]。

虚线为90%置信区间;A.Cmax;B.AUC0-t。图6 冬凌草乙素lnPK与ln(剂量)的线性关系The dotted line is the 90% confidence interval;A.The relationship between lnCmax and lnDose;B.The relationship between lnAUC0-t and lnDoseFig.6 The relationship between lnPK and lnDose of ponicidin
在研究中,冬凌草滴丸小剂量给药后6 h、8 h,部分大鼠血样中的冬凌草乙素浓度低于方法的定量限,故小剂量组中冬凌草乙素的部分药动学参数无法获得。经统计学分析,在本实验的小、中、大(0.3,0.9,2.7 g·kg-1)3个剂量组下,冬凌草甲素lnCmax、ln(AUC0-t)与ln(剂量)的斜率β(90%置信区间)分别为0.867(0.771,1.002)、0.921(0.841,1.096),lnCmax斜率β略跨过判断区间(0.839,1.161),表明冬凌草甲素的Cmax有线性药动学特征的结果尚无定论。ln(AUC0-t)斜率β包含在判断区间(0.839,1.161)内,表明冬凌草甲素的药动学参数AUC0-t有线性药动学特征。冬凌草乙素lnCmax、ln(AUC0-t)与ln(剂量)的斜率β(90%置信区间)分别为0.861(0.775,0.956)、0.961(0.779,1.152),斜率β均略跨过判断区间(0.839,1.161),表明冬凌草乙素的Cmax与AUC0-t有线性药动学特征的结果尚无定论。
本实验建立了同时测定大鼠血浆中冬凌草甲素与冬凌草乙素的LC-MS/MS方法[16-17],该方法快速、准确、专属性强。用所建方法对不同剂量冬凌草滴丸中冬凌草甲素、冬凌草乙素进行了大鼠体内的药动学研究,研究结果可为冬凌草滴丸的临床应用和进一步研发提供数据支持。在以后的的工作中需要进一步研究冬凌草滴丸中活性成分的组织分布规律、主要的蓄积器官以及蓄积程度进行深入研究探索;冬凌草滴丸是冬凌草的单方制剂,而冬凌草对多种肿瘤具有抗癌活性,因此可以研究冬凌草滴丸在抗癌、抗肿瘤方面的潜在功效。
