CuSO4对阿尔茨海默病模型行为学和病理学的影响
2014-03-10周美琴何远宏
周美琴,何远宏,余 列,李 魁,王 楠
铜(Cu)和AD 的关系目前暂不清楚。一些研究提示铜可以影响β 淀粉样前体蛋白(APP)的转运、释放以及重新分布,并促进细胞表面APP 水平的增高;但另有研究认为Cu 对脑脊液中tau 蛋白及磷酸化tau 蛋白无明显影响,不但能够降低Aβ 的含量[1],患者脑脊液中β 淀粉样蛋白(Aβ)的浓度还与Cu 水平呈负相关[2]。AD 患者血浆Cu 浓度较正常均明显增高,但是轻度与中重度AD 患者之间的Cu 浓度无显著差异,且AD 患者的认知功能与Cu无相关性[3]。因此,AD 患者脑内Cu 是缺乏还是过量一直存在争议,有必要设计实验进一步探讨铜与AD 的关系。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组 SPF 级健康雄性成年大鼠,体重平均(250 ±20)g,由郑州大学实验动物中心提供(许可证号:SCXK(豫)2010~0002)经水迷宫淘汰有记忆障碍的大鼠后随机分为6 组:正常组、PBS 组、AD 模型组、低、中、高剂量CuSO4组,每组6 只,共72 只。
1.1.2 主要试剂及仪器 Tau 蛋白抗体及GSK-3β 抗体(美国Santa 公司),Aβ1-42(北京博奥森公司;HRP 标记山羊抗兔IgG,HRP 羊抗鸡IgG(自上海生工),水迷宫系统(SLY-WMS 北京硕林苑科技有限公司)。
1.2 方法
1.2.1 模型制备 制备AD 模型,水合氯醛腹腔麻醉后固定,参考Paxinos 和Watson 大鼠脑立体定位图谱[4]确定进针部位(3.8 mm(A/P)、2.5 mm(L/R)、3 mm(H),两侧各注射质量浓度为2 μg/μl的Aβ1-425 μl,(Aβ1-42粉剂溶于无菌生理盐水,于37 ℃水浴锅中孵育36 h,使其变为聚集状态),留针6 min,使药物充分进入局部组织。PBS 组注射5 μl的无菌PBS,低中高剂量CuSO4组在造AD 模型成功后,坐标参照包新明[5]确定侧脑室坐标(1.5 mm(A)、1.5 mm(L/R)、3.5 mm(H)注入无菌CuSO4溶液(剂量分别是:1 mg/kg、3 mg/kg、5 mg/kg),术后青霉素抗感染。
1.2.2 Morris 水迷宫行为学检测 在术后第9天进行水迷宫实验,(1)定位航行实验(place navigation)共4 d,每只大鼠4 次/d,将大鼠随机从4 个象限面向池壁放入水中,大鼠爬上平台所用的时间记为逃避潜伏期,如果大鼠在120 s 未爬上平台,潜伏期则记录为120 s;(2)空间探索实验(spatial probe)第5 天撤除平台,随机选取一个象限放入大鼠,观察在其原平台象限穿越次数及停留时间比,数据由Morris 水迷宫自动监视系统处理并完成。
1.2.3 病理染色观察神经元凋亡情况 (1)尼氏染色:术后第14 天大鼠麻醉后灌注取全脑,梯度蔗糖脱水固定,包埋,切边的部位:冠状切至视交叉到乳头体之间的脑片,厚度20 μm,酒精脱脂,水洗,入尼氏染色液染色,镜下观察染色时间,尼氏小体清晰背景浅即终止反应。蒸馏水洗,甩干,盐酸乙醇分化,脱水,晾干,二甲苯透明,中性树胶封片。镜下射片观察,分析计数。(2)HE 染色:取材同尼氏染色,冰冻切片水洗,Harris 苏木素染色,水洗,盐酸乙醇分化,水洗,促蓝液返蓝,冲洗,伊红染色,镜下观察颜色变化控制染色时间,水洗,脱水二甲苯透明,晾干,封片。镜下射片观察。
1.2.4 Western blot 测定GSK-3β 及tau 蛋白的表达 术后14 d 大鼠断头,取CuSO4注射侧脑组织,匀浆,裂解,离心,取上清,加入上样缓冲液,沸水煮5 min。测蛋白浓度,调至浓度一致,-80 ℃冻存待用,制备SDS-聚丙烯酰胺凝胶,上样电泳,半干转至PVDF 膜上,5%脱脂牛奶封闭,加入鼠抗GSK-3β抗体(1∶ 500)、非磷酸化兔抗tau 抗体(1∶ 500),4 ℃孵育过夜。PBST 洗膜,加入HRP 标记的山羊抗兔二抗(1∶ 5000)或山羊抗小鼠二抗(1∶ 5000),室温下孵育2 h。洗膜后加入ECL 发光液,在Chemi scope Mini 系统中扫描成像,并用成像分析系统对各蛋白条带及内参条带进行灰度扫描,获得光密度(OD)值,两者比值作为该蛋白的相对表达量。
1.2.5 统计学方法 使用SPSS13.0 统计软件处理,做计量资料,以均数±标准差()表示,用t检验,检验水准α=0.05。
2 结果
2.1 水迷宫实验检测成绩 正常组和PBS 组比较,AD 模型组大鼠的逃避潜伏期显著延长,穿越平台象限次数减少,平台象限停留时间缩短,差异有统计学意义(P <0.05)。各CuSO4处理组与AD 模型组比较,逃避潜伏期明显延长,穿越平台象限次数减少,平台象限停留时间缩短,差异有统计学意义(P <0.05)。随着CuSO4注射剂量的增加,潜伏期延长,穿越平台次数减少,平台象限停留时间进一步缩短(P <0.05)。具体数据(见表1)。
2.2 病理染色 HE 染色结果:与正常组及PBS 组比较,AD 模型组海马区锥体细胞数目明显减少,差异有统计学意义(P <0.05),CuSO4处理进一步减少了锥体细胞数目(P <0.05),随着CuSO4注射剂量的增加,锥体细胞数目减少进一步加剧(P <0.05),具体数据(见表2)。
2.3 GSK-3β 及总tau 蛋白表达情况 与正常组和PBS 组比较,AD 模型组GSK-3β 及总tau 蛋白表达增强(P <0.05)。3 组CuSO4处理组较AD 模型组两种蛋白表达增强,差异有统计学意义(P <0.05)。随着CuSO4注射剂量的增加,GSK-3β 及总tau 蛋白的表达量进一步上调,差异有统计学意义(P <0.05)。尼氏染色结果比较及分析:正常组和假手术组大鼠的海马锥体细胞胞浆内尼氏体丰富,细胞排列整齐;AD 模型组大鼠的海马锥体细胞胞浆内尼氏体减少或缺如,核固缩深染,海马锥体细胞丧失明显,表明有大量的海马锥体细胞凋亡。3 组CuSO4处理组大鼠海马锥体细胞中尼氏体丢失严重,细胞核固缩深染,与AD 模型组大鼠相比,锥体细胞凋亡明显(见表3)。
表1 各组水迷宫检测成绩比较()
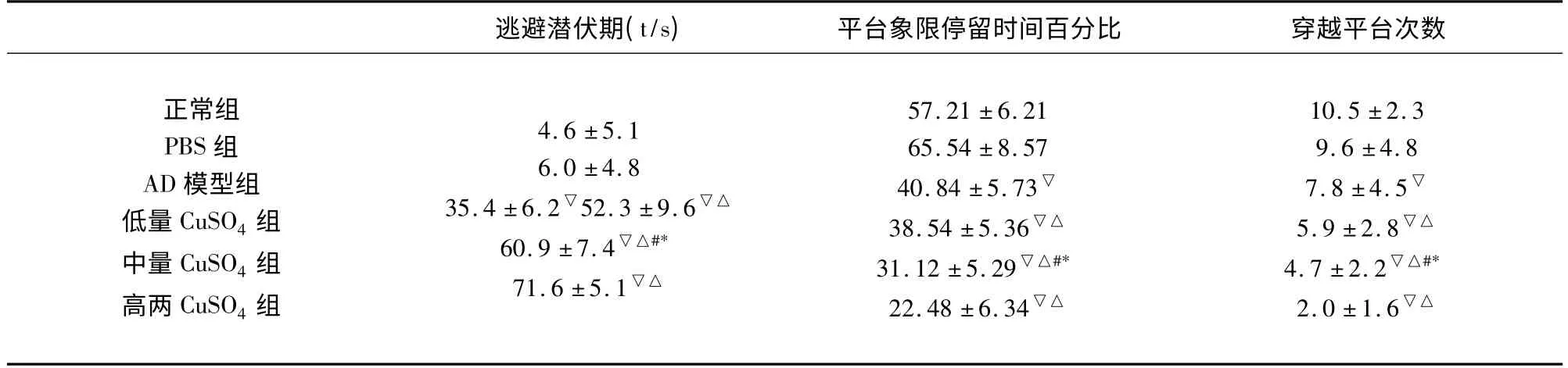
表1 各组水迷宫检测成绩比较()
与正常组和PBS 组比较▽P <0.05;与模型组比较△P <0.05;与低剂量CuSO4组比较#P <0.05;与高剂量CuSO4组比较* P <0.05
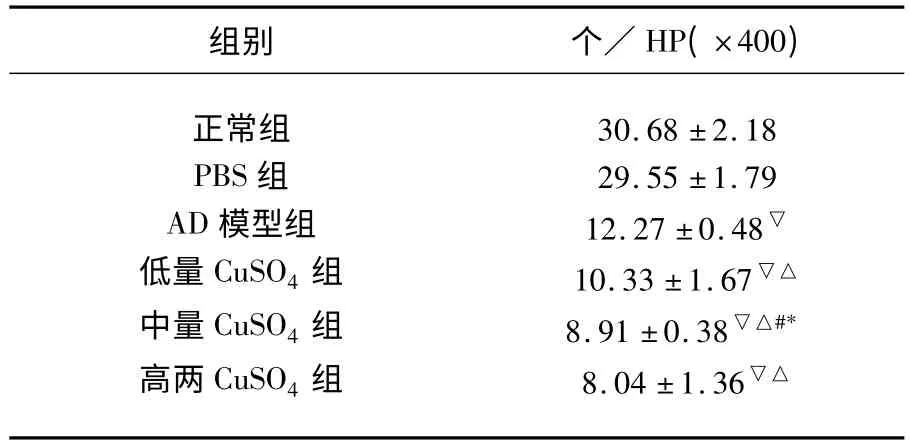
表2 实验组大鼠海马CA3区每高倍镜下正常锥体细胞数

表3 各组GSK-3β 及总tau 蛋白表达情况
3 讨论
在本试验中,我们采用海马注射Aβ 的方法建立AD 模型。Aβ 在海马细胞的异常沉积是AD 的主要病理特征,与AD 的发病机制有着重要关系[6],用Aβ 做AD 模型[7]能很好的模拟AD 的特点,此方法较成熟可靠,虽然转基因鼠已经问世,国内外也有APP、APP/PS1、SAMP8 等转基因动物的应用,其培育难、死亡率高、价格昂贵等特点,且不能囊括散发型等其他类型的AD 模型,因此成为大量应于基础研究的羁绊。
为此进一步探索Cu 与AD 的关系,我们采用Morris 设计的水迷宫检测大鼠的学习记忆功能。逃避潜伏期代表了大鼠找到平台的时间,反映了学习能力;原平台象限停留时间比代表撤去平台后大鼠在原平台所在象限活动的时间和原平台跨越次数共同代表反映了短期记忆能力。Tau 蛋白具有促进微管蛋白聚合成微管、防止其解聚和维持微管功能稳定的作用,当tau 蛋白被过度磷酸化、异常糖基化或泛素化时,就会丧失促微管组装的生物活性,同时对蛋白水解酶的抗性增加,产生神经毒性,从而导致神经退行性变和神经纤维缠结的的形成。而神经原纤维缠结的形成与AD 患者的认知功能障碍呈明显的正相关[8],AD 患者血清tau 蛋白及磷酸化tau 蛋白浓度的异常情况与疾病的严重程度相关[9],糖原合成酶激酶3β(GSK-3β),是磷酸化tau 蛋白的主要激酶,不仅能使tau 蛋白磷酸化使其具有更强的成纤维特性,而且可以诱导神经细胞凋亡[10],因此我们检测GSK-3β 和tau 蛋白的表达,以及利用病理染色观察Cu 处理对大鼠的影响。
研究结果显示,AD 模型组的大鼠较正常组和PBS 组学习记忆能力下降,海马神经元凋亡较严重,说明AD 模型建立是成功的。3 组CuSO4组大鼠的学习记忆能力较AD 模型组显著下降,且随注射剂量的增加,大鼠的学习能力越差,细胞凋亡越严重。GSK-3β 和tau 表达方面,CuSO4组较AD 模型组增加,且随着CuSO4剂量的增加,GSK-3β 和tau 表达也增强。研究证实了高浓度Cu 对AD 大鼠的学习记忆产生损害,导致行为学变化,高浓度的Cu 可以对神经元产生毒性作用,导致神经元变性及凋亡,可以诱导GSK-3β 和tau 蛋白的表达,我们推测CuSO4可能是通过某种通路诱导了GSK-3β 和tau 蛋白的表达而使大鼠出现行为学的变化及病理学的变化,另外CuSO4溶液的注射导致脑脊液中的SO42-集聚上升,是否会大鼠的神经功能有影响,需要进一步探索。
[1]Kessler H,Pajnk FG,Bach D,et al.Efkct of copper intake on CSF parameters in patients with mild Alzheimer’s disease:apilotphase2 clinical trial[J].J Neural Transm,2008,115:1651 -1659.
[2]strozy KD,Launer IJ,Adlard PA,et al.Zinc and copper modulate Alzheimer levels in human cerebro-spinal nuid[J].Neurobiol Aging,2009,30:1069 -1077.
[3]ventriglia M,Buossi S,Panetta V,et al.Copper in Alzheimer’s disease:a Meta-Analysis of serum.plasma,and erebrospinal fluid studies[J].J Alzheimer Dis,2012,29:1 -4.
[4]rouch PJ,Hung LW,Adlard PA,et al.Increasing Cu bio availabiliy Inhibits AB oligomersand tau phosphorylation[J].PNAS,2009,106(2):381 -386.
[5]包新民,舒斯云.大鼠脑立体定向图谱[M].北京:人民卫生出版社,1991.30 -35.
[6]孙 欣,杨 宇.β 淀粉样蛋白在阿尔茨海默病中所致的细胞内毒性作用[J].中风与神经疾病杂志,2011,28(3):277 -279.
[7]刘艳华,李 晶.丹参酮对β 淀粉样肽拟痴呆小鼠的保护剂机制[J].中风与神经疾病杂志,2007,24(1):64 -66.
[8]Krager U,Wang Y,Kumar S,et al.Autophagic degradation of tau in primary neurons and its enhancement by trehalose[J].Neurobiol Aging,2012,33(10):2291 -2305.
[9]周 凡,单可人,肖 雁,等.阿尔茨海默病发病机制中β 淀粉样蛋白和Tau 蛋白过度磷酸化的相互关系[J].中风与神经疾病杂志,2011,28(5):470 -472.
[10]Choi CH,Lee BH,Ahn SG,et al.Proteasome inhibition-induced p38 MAPK/ERK signaling regulates autophagy and apoptosis through the dual phosphorylation of glycogen synthase kinase 3β[J].Biochem Biophys Res Commun,2012,418(4):759 -764.
