多重耐药基因cfr在广东地区猪源肠球菌中的流行特点
2014-03-08王秀梅初胜波张万江刘思国
牟 迪,王秀梅,初胜波,刘 琪,张万江,刘思国*
(1.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物细菌病研究室,黑龙江 哈尔滨 150001;3.吉林农业大学,吉林 长春 130118)
肠球菌为一种革兰氏阳性条件致病菌,不仅可引起人体尿路感染、皮肤软组织感染,还可导致菌血症、心内膜炎、脑膜炎等严重感染[1],也可引起多种家畜家禽等动物感染发病[2]。存在于肉品中的肠球菌,是人食物中毒的主要原因[3]。由于肠球菌是人和动物肠道中的正常菌群,并且很容易捕获耐药基因或耐药质粒,常被称之为耐药基因的“蓄水池”,因此存在随食物链传播耐药基因的风险。
cfr 基因于1997 年Schwarz 首次发现,该基因编码的Cfr 蛋白为细菌核糖体23S rRNA 甲基化酶,通过甲基化23S rRNA 的A2503 位,导致酰胺醇类、林克霉素类、恶唑烷酮类、截断侧耳素类和链阳菌素A 药物耐药,并且cfr 基因介导的耐药为恶唑烷酮类和截短侧耳素类的第一种可转移耐药机制[4]。目前,已在动物和人源的多种细菌中检测到cfr 基因。但关于cfr 基因在我国动物源肠球菌中的流行状况和传播方式研究还较少。本研究以广东大型猪场分离的携带cfr 基因的肠球菌为研究对象,通过PFGE 和Southern 杂交对cfr 基因进行亲缘关系分析和定位,初步研究cfr 基因在猪源肠球菌中的传播方式,为临床制定合理措施控制其快速传播提供理论依据。
1 材料和方法
1.1 菌株、临床样品及主要试剂 粪肠球菌ATCC29212 和沙门氏菌H9812 由本实验室保存;1 800份鼻拭子和肛门拭子于2011 年采集自广东某大型猪场;药敏试验所用药物均购自中国兽医药品监察所;限制性内切酶、琼脂糖凝胶DNA 回收试剂盒、LA Taq DNA 聚合酶、S1 核酸酶和蛋白酶K 均购自TaKaRa 公司;质粒中量提取纯化试剂盒购自德国Qiagen 公司;DIG High Prime DNA Labeling and Detection Starter Kit 试剂盒购自Roche 公司。
1.2 cfr基因阳性肠球菌的分离鉴定 将鼻腔和肛门拭子直接置于含6.5 % NaCl 营养肉汤中,45 ℃培养后,划线于含10 mg/L 氟苯尼考的肠球菌鉴定培养基(叠氮钠-结晶紫-七叶苷琼脂),37 ℃过夜培养;挑取疑似克隆,提取全基因组,用23S rRNA通用引物对氟苯尼考低敏感菌进行鉴定。根据Gen-Bank 已发布的目的基因序列设计合成cfr 基因特异引物,(cfr-F 5'-TAAGAAGTAATAATGAGC-3',cfr-R 5'-TATAGAAAGTCTACGAGG-3'),进行PCR 扩增,预期大小为518 bp,反应条件:95 ℃5 min;94 ℃30 s、52.5 ℃30 s、72 ℃40 s,32 个循环;72 ℃5 min。
1.3 分离株亲缘关系分析 参照文献[5]的方法进行脉冲凝胶电泳(PFGE)分型,将过夜培养的细菌用低熔点的金胶灌模,300 mg/L 蛋白酶K 50 ℃消化24 h 直到胶块变透亮,然后用SmaⅠ30 ℃作用3 h;脉冲凝胶电泳1 % SKG 低熔点胶,0.5×TBE 电泳液,电压降6 V/cm,变换角度120,脉冲时间5 s~40 s 电泳18 h,Marker 为沙门氏菌H9812(XbaⅠ酶切)。电泳后用EB 染色,利用凝胶成像系统获取图片并保存。PFGE 谱型判定标准参照文献[6]的方法进行。
1.4 最小抑菌浓度(MIC)测定 参照CLSI M31-A3[7]推荐的微量肉汤稀释法测定临床分离株对各受试药物的MIC,质控菌为粪肠球菌ATCC29212。
1.5 质粒抽提及cfr基因的杂交定位 采用Qiagen Plasmid Midi 试剂盒提取cfr 基因阳性肠球菌质粒,具体方法参照说明书进行(略有改进)。将提取的质粒进行MegaBase 琼脂糖凝胶电泳,并将其转移到尼龙膜上,利用地高辛标记的cfr 特异探针进行Southern 杂交,具体方法参见文献[8]。
2 结果
2.1 氟苯尼考低敏感肠球菌筛查 从采集的1 800份样品中共筛选出氟苯尼考低敏感肠球菌79 株,23S rRNA 鉴定结果显示79 株肠球菌共分为6 种不同的肠球菌属,其中cfr 基因阳性菌共28 株,包括粪肠球菌8 株,铅黄肠球菌6 株,屎肠球菌4 株,鹑鸡肠球菌10 株,cfr 基因在不同菌种肠球菌中的检出率见表1。

表1 cfr 基因在不同菌种氟苯尼考低敏感肠球菌分离株中的检出率Table 1 Detection of cfr gene among different Enterococcus spp.isolates
2.2 PFGE分析 利用PFGE 对28 株cfr 阳性肠球菌进行亲缘关系分析,排除同一种属肠球菌中的相同克隆(数据未提供),最终分离到粪肠球菌3 株(3-1,B53-2 和D18-1),铅黄肠球菌(E2-1 和E3-1)和鹑鸡肠球菌(E14-1 和M1-1)各2 株,屎肠球菌1 株(E4-1)。图1 为8 株携带cfr 基因肠球菌的PFGE 谱型,结果显示各个菌的PFGE 谱型完全不同,不同种属间的谱型差别最大。
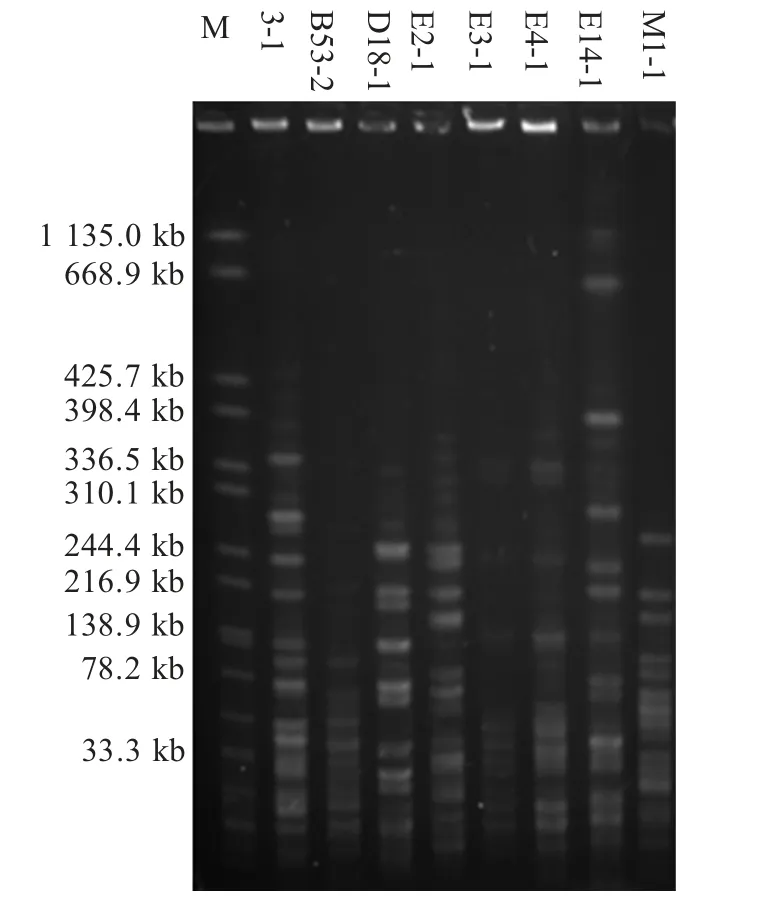
图1 8 株cfr 基因阳性肠球菌的PFGE 图谱Fig.1 PFGE profile of 8 Enterococcus spp.isolates carrying cfr gene
2.3 药敏试验结果 根据文献[7]的判定标准,所有8 株分离株均为多重耐药,对氟苯尼考、庆大霉素和红霉素100%耐药,对四环素的耐药率达87.5%,对环丙沙星、利福平的耐药率为75 %,对阿米卡星耐药率50 %。尽管8 株菌对氨苄西林和万古霉素的耐药率较低,分别为12.5 %和0,但其中7 株菌(87.5 %)对万古霉素敏感性降低(MIC 值:4 mg/L~16 mg/L),表现中度耐药(表2)。
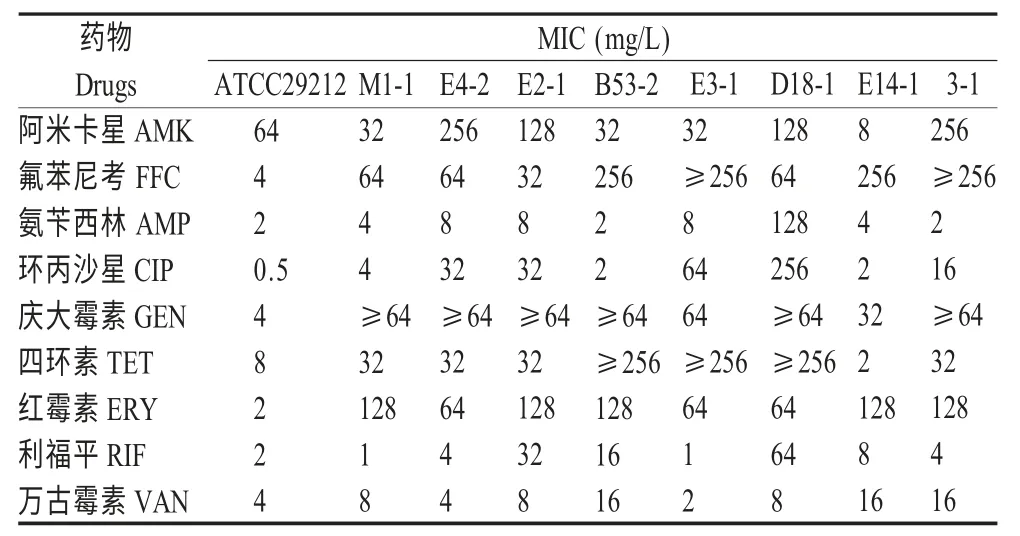
表2 8 株肠球菌对9 种药物的药敏试验结果Table 2 Antimicrobial susceptibility of 8 Enterococcus spp.isolates carrying cfr gene to 9 antibiotics
2.4 cfr基因的杂交定位 利用质粒提取试剂盒分别提取8 株cfr 基因阳性肠球菌的质粒,将提取的质粒进行MegaBase 琼脂糖凝胶电泳。电泳结果显示,每个野生菌均携带3~5 个质粒,质粒的大小在2 kb~60 kb(图2A)。用cfr 基因的特异探针进行Southern 杂交,结果显示有6 株菌的cfr 基因定位于质粒,质粒大小略有不同在3-1 中cfr 基因位于约50 kb 的质粒,在其余的5 株菌(D18-1,E2-1,E3-1,E4-1 和M1-1)中cfr 基因均定位于约40 kb 和20 kb的质粒。而在B53-2 和E14-1 中,质粒电泳条带与cfr 探针无显示杂交信号(图2B)。
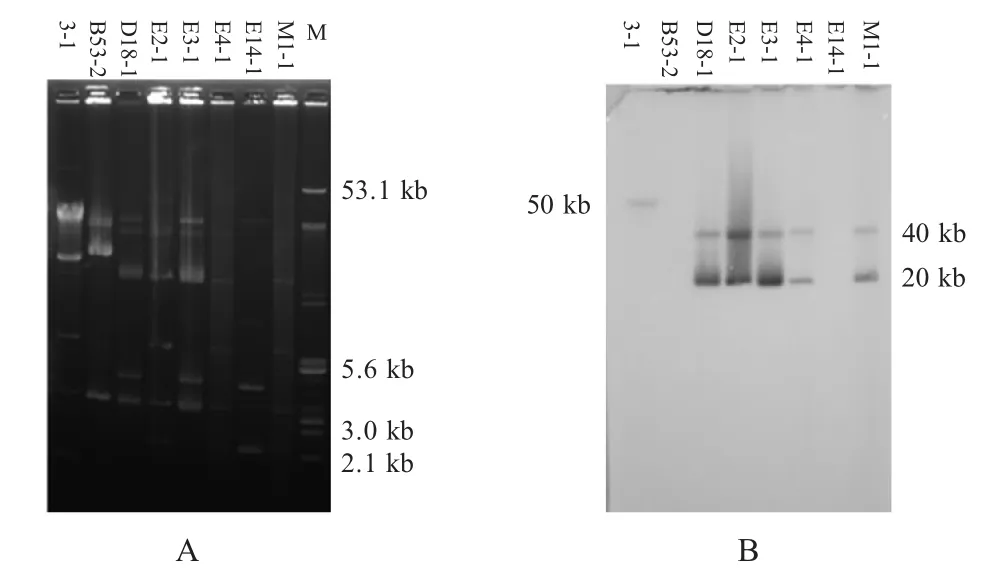
图2 8 株cfr 基因阳性菌的质粒电泳图(A)及其与cfr 探针的杂交图(B)Fig.2 Plasmids profiles(A)and Southern hybridization analysis of 8 cfr-carrying isolates with cfr probe(B)
3 讨论
目前多数研究结果显示,我国兽医临床携带cfr基因的菌株主要是葡萄球菌,也有少数其他携带cfr基因的细菌,如肠球菌、大肠杆菌和链球菌等[9]。刘洋等在2009 年调查了山东和北京两地猪源和鸡源肠球菌携带cfr 基因的情况,结果在453 株肠球菌中仅分离到1 株cfr 基因阳性菌,检出率为0.2 %[10]。本研究从广东猪场分离的79 株肠球菌中分离到28株cfr 阳性菌株,分离率为35.4 %,远高于刘洋报道的。分析原因主要有以下两个方面:(1)本实验分离的79 株肠球菌均为氟苯尼考耐药,而刘洋采用不加药平板进行筛选,因此cfr 基因阳性肠球菌的分离率就会略低一些;(2)本实验所选取的广东某猪场用药程度与刘洋所选取的北京和山东养殖场用药程度不同。
药物敏感性结果显示,8 株cfr 基因阳性肠球菌均为多重耐药,对临床常用的药物如氟苯尼考、庆大霉素、红霉素、四环素、环丙沙星和利福平等全部耐药或表现较高的耐药率,提示兽医临床在治疗肠球菌引起的感染时应减少使用这些药物。由于兽医临床没有肠球菌关于万古霉素耐药的判定标准,参照人医标准MIC≥32 mg/L 判定为耐药,本研究中的8 株菌对万古霉素的MICs≤32 mg/L,与国内其他的研究结果一致[11]。虽然,8 株分离株对万古霉素的MIC 值未达到耐药标准,但其中7 株菌对万古霉素的MIC 在4 mg/L~6 mg/L,表现为万古霉素中度耐药,因此,应该引起我们的高度重视。
虽然,本研究筛选到28 株携带cfr 基因的肠球菌,但PFGE 分型后仅鉴定到8 株不同谱型的肠球菌,表明携带cfr 基因的肠球菌在猪场内存在克隆传播现象。对cfr 基因的定位结果显示,8 株分离株中,cfr 基因在6 株菌中均位于质粒,表明质粒可能是携带cfr 基因发生水平传播的主要原因。
目前,肠球菌已是人医和兽医临床感染分离率较高的细菌,并且耐药的程度也较严重,更严重的是其作为“耐药基因的储库”可将耐药基因传递给其他致病菌,从而给临床抗感染治疗带来困难。本研究从广东某猪场分离到28 株携带cfr 基因的多重耐药肠球菌,通过PFGE 和Southern 杂交初步证明cfr 基因的传播方式主要是克隆传播和质粒介导的水平传播,为临床制定合理措施控制其快速传播提供理论依据。
[1]Coque T M,Tomayko J F,Ricke S C,et al.Vancomycin-resistant enterococci from nosocomial,community,and animal sources in the United States[J].Antimicrob Agents Chemother,1996,40(11):2605-2609.
[2]王亚宾,陈丽颖,张红英,等.感染仔猪粪肠球菌不同分离株的鉴定及毒力基因检测[J].中国兽医学报,2010,30(5):615-619.
[3]王亚宾,陈丽颖,胡慧,等.猪源粪肠球菌和屎肠球菌多重PCR 快速鉴定方法的建立[J].动物医学进展,2010,31(S):127-131.
[4]Schwarz S,Werckenthin C,Kehrenberg C.Identification of a plasmid-borne chloramphenicol-florfenicol resistance gene in Staphylococcus sciuri[J].Antimicrob Agents Chemother,2000,44(9):2530-2533.
[5]Barton B M,Harding G P,Zuccarelli A J.A general method for detecting and sizing large plasmids[J].Anal Biochem,1995,226(2):235-240.
[6]Tenover F C,Arbeit R D,Goering R V,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J].J Clin Microbiol,1995,33(9):2233-2239.
[7]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial disk and dilution susceptibility test for bacteria isolated from animals-third edition:Approved Standard M213-A3.CLSI,Wayne,PA,USA,2008.
[8]Zhang Wan-jiang,Xu Xing-Ran,Schwarz S,et al.Characterization of the IncA/C plasmid pSCEC2 from Escherichia coli of swine origin that harbours the multiresistance gene cfr[J].J Antimicrob Chemother,2014,69(2):385-389.
[9]Wang Yang,Li De-xi,Song Li,et al.First report of the multiresistance gene cfr in Streptococcus suis[J].Antimicrob Agents Chemother,2013,57(8):4061-4063.
[10]Liu Yang,Wang Yang,Schwarz S,et al.Transferable multiresistance plasmids carrying cfr in Enterococcus spp.from swine and farm environment[J].Antimicrob Agents Chemother,2013,57(1):42-48.
[11]齐亚银,张莉,王静梅,等.动物源粪肠球菌对7 种抗生素耐药表型及耐药基因检测[J].中国预防兽医学报,2010,30(7):962-965.
