鼠伤寒沙门菌感染小鼠肠道自噬现象的观察
2014-03-08乔香君程相朝张春杰李银聚陈松彪武建琳李圣杰袁乾亮
乔香君,李 静*,程相朝,张春杰,李银聚,陈松彪,武建琳,李圣杰,袁乾亮
(1.河南省动物疫病与公共安全院士工作站,河南 洛阳 471003;2.河南科技大学 动物疫病与公共卫生重点实验室,河南 洛阳 471003)
鼠伤寒沙门菌(Salmonella typhimurium)为肠杆菌科沙门菌属成员,是一种条件性胞内寄生的革兰氏阴性肠杆菌,具有广泛的宿主感染谱,主要引起动物的肠道性和人类的食源性疾病,在公共卫生学方面具有重要意义[1-2]。
自噬作为机体的一种免疫机制,为研究其在沙门菌感染过程中是否发挥作用,沙门菌感染是否可以引起宿主肠道发生自噬,本研究以消化道感染途径为切入点,结合目前世界对自噬的研究热点,建立动物感染模型,应用透射电子显微镜技术和western blot 方法,从细胞和蛋白水平观察鼠伤寒沙门菌SL1344 经消化道感染后,BALB/c 小鼠肠道自噬现象,揭示自噬在沙门菌感染过程中的作用,从而为深入研究机体的免疫调节提供实验依据。
1 材料和方法
1.1 菌株及实验动物 鼠伤寒沙门菌SL1344 由南京农业大学馈赠;6~8 周龄清洁级BALB/c 小鼠由郑州大学动物实验中心提供。
1.2 主要试剂 LB 培养基购自英国OXOID 公司;兔抗鼠LC3-II 抗体购自Sigma 公司;HRP 标记的山羊抗兔IgG(IgG-HRP)购自苏州拜吉氏生物科技有限公司;BCA 蛋白定量试剂盒及ECL 化学发光检测试剂盒均购自武汉博士德生物工程有限公司。
1.3 感染小鼠模型的建立 将鼠伤寒沙门菌接种于LB 培养基中,37 ℃摇床振荡培养,待细菌生长到对数期,对其进行菌落计数,并稀释为3 个不同浓度:107cfu、108cfu 及109cfu 感染小鼠,筛选最佳感染剂量。30 只BALB/c 小鼠随机分为3 组,每组10 只。第1 组和第2 组经口腔接种鼠伤寒沙门菌,第3 组口服接种相同体积的无菌生理盐水,接种后7 d 迫杀第1 组小鼠,接种后14 d 分别迫杀第2 组和对照组小鼠,采集小鼠空肠。
1.4 感染小鼠肠组织病理组织学观察 鼠伤寒沙门菌SL1344 感染BALB/c 小鼠后7 d 和14 d,迫杀小鼠后迅速采集小鼠空肠,经10 %甲醛溶液固定,石蜡包埋,切片,H E 染色后进行光学显微镜观察。
1.5 透射电镜技术观察感染小鼠肠道自噬现象SL1344 菌株感染BALB/c 小鼠后7 d、14 d,迅速采集小鼠空肠,进行组织修块后置于用0.15 M PBS(pH7.4)配制的2 %甲醛/2.5 %戊二醛中。固定1 h,转移至1%四氧化锇/0.15 M PBS 缓冲液中固定1 h,经不同浓度的乙醇进行脱水处理,包埋,切成1 μm的切片,置于载玻片上后用1 %甲苯胺蓝染色,先在光学显微镜下观察并确定部位。切成70 nm~80 nm,经4 %醋酸铀酰染色15 min,柠檬酸铅8 min,利用透射电镜进行超微结构观察。
1.6 感染小鼠肠道中LC3-II蛋白表达情况的检测采集小鼠空肠,称重,液氮研磨成粉状。取适量裂解液加入PMSF,使其终浓度为1 mM。按100 μL~200 μL 裂解液/20 mg 组织的比例加入裂解液,漩涡振荡,置4 ℃孵育30 min。待组织充分裂解后,4 ℃10 000 r/min 离心5 min,取上清液,采用BCA 法测定样品蛋白质的浓度。将蛋白样品经15 % SDSPAGE 电泳后转印至PVDF 膜上;以兔抗鼠LC3-II抗体(1∶1 000)为一抗,山羊抗兔IgG-HRP(1∶2 000)为二抗,ECL 曝光显影进行western blot 检测。
2 结果
2.1 鼠伤寒沙门菌感染小鼠模型的建立 以不同剂量的鼠伤寒沙门菌感染小鼠,结果显示108cfu 的接种剂量小鼠的发病效果比较理想。第1 组和第2 组小鼠每只经口腔接种108cfu 菌液,第3 组小鼠每只口服接种相同体积的生理盐水,在接种后7 d、14 d分别迫杀实验组1、2 和对照组小鼠,采集小鼠空肠。
2.2 感染小鼠肠组织病理形态学观察 将肠组织切片HE 染色后进行光学显微镜观察。结果显示,SL1344 菌株感染小鼠后7 d,空肠黏膜上皮脱落、缺损(图1A),感染后14 d,空肠中出现大量的炎性细胞浸润,杯状细胞数量增多(图1B)。
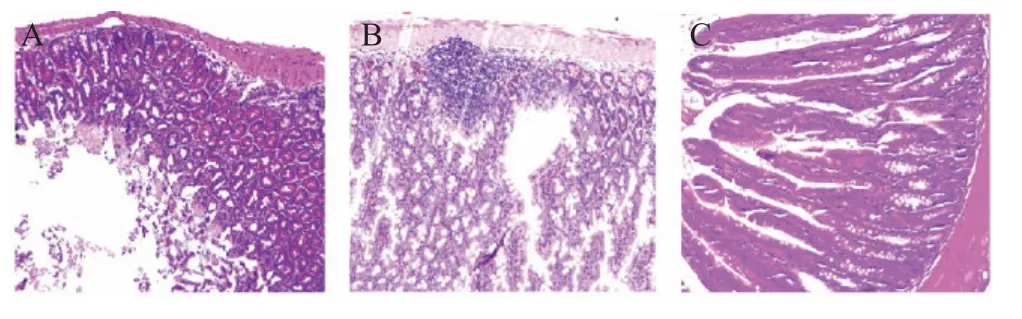
图1 空肠组织病理形态学观察(10×,HE)Fig.1 Histopathologic morphology observation of jejunum(10×,HE)
2.3 感染小鼠肠道超微结构观察 鼠伤寒沙门菌SL1344 感染BALB/c 小鼠后7 d 和14 d,采集小鼠空肠,对组织进行固定,经过处理后利用透射电镜进行超微结构观察。结果显示,鼠伤寒沙门菌SL1344 感染可以引起小鼠肠道发生自噬(图2B),并且引起细胞线粒体和内质网肿胀(图2E 和2H)。
2.4 感染小鼠肠道中LC3-II蛋白表达情况 采集小鼠空肠,提取蛋白并检测蛋白浓度后,利用western blot 方法检测感染小鼠肠道中LC3-II 蛋白的表达情况,结果显示,与对照组相比,实验组LC3-II 蛋白表达量均增加(图3)。
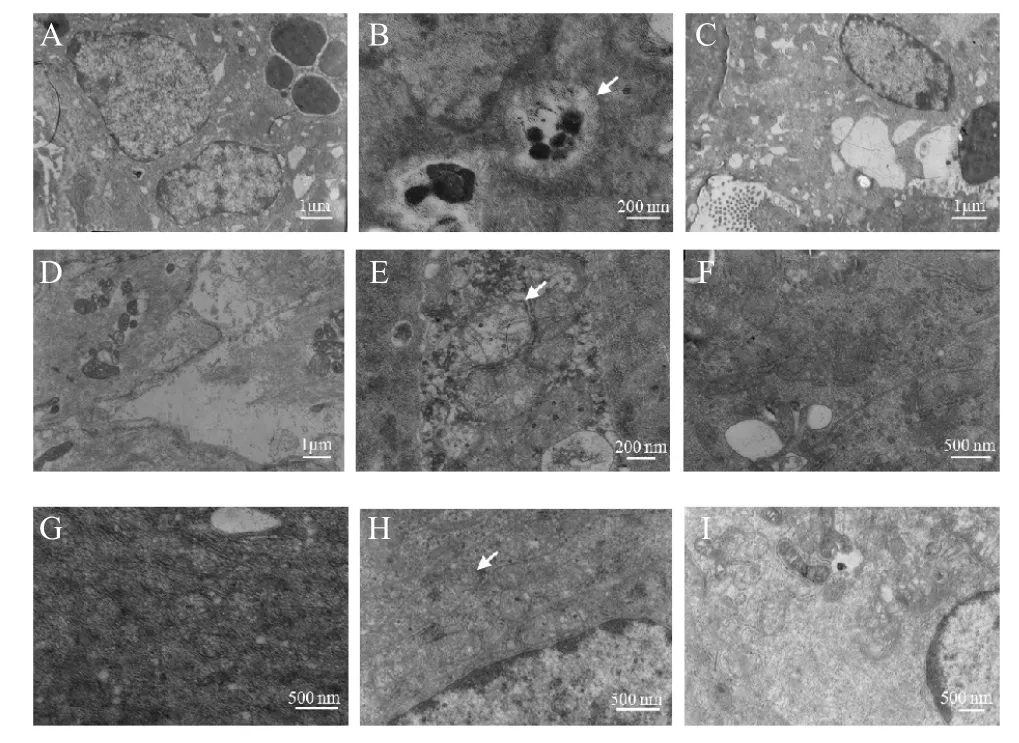
图2 鼠伤寒沙门菌感染小鼠肠道透射电镜观察结果Fig.2 Intestinal TEM observations of mice infected with S.typhimurium
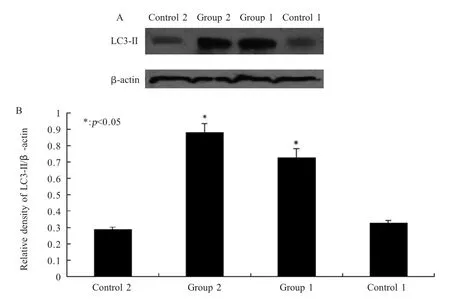
图3 Western blot 方法检测LC3-II 的表达水平Fig.3 Western blot detection of LC3-II expression level
3 讨论
鼠伤寒沙门菌是一种重要的人畜共患病原菌,其感染发病率居沙门菌感染的首位。正常生理情况下,机体能够抵御沙门菌入侵,但在肠道菌群失调或机体抵抗力下降等各种因素影响下,均有利于沙门菌感染的发生[3]。自噬作为天然免疫应答的一种,在病原体防御过程中发挥着重要作用[4]。病原体侵入细胞后,自噬通过膜结构对其进行包裹形成自噬体,随后自噬体与溶酶体发生融合形成自噬溶酶体,最后溶酶体中的蛋白酶对病原体进行降解[5]。LC3-II 基因参与自噬体的形成,目前已作为自噬的标记性分子用于自噬活性的检测[5]。本研究构建了鼠伤寒沙门菌SL1344 感染小鼠模型,利用透射电镜技术观察到自噬体的存在。此外,western blot 方法检测显示,鼠伤寒沙门菌SL1344 感染小鼠空肠组织中LC3-II 的表达量显著增加,这进一步表明鼠伤寒沙门菌感染可以引起小鼠肠道发生自噬。
作为机体免疫的一部分,自噬对多种病原体具有清除作用,即病原体能够被自噬直接杀伤或者通过先天性或获得性免疫间接被消灭。然而,一些病原体能够逃避自噬的识别,甚至利用自噬为其自身的复制提供便利[6]。由此表明,自噬在机体免疫过程中发挥着“双刃剑”的作用,然而自噬逃避机制目前尚不清楚[7-8]。本研究结果表明鼠伤寒沙门菌SL1344 可以引起BALB/c 小鼠肠道细胞发生自噬现象,这种自噬现象对沙门菌的感染是否具有清除作用还有待于深入研究。
[1]吕玲.鼠伤寒沙门菌在动物肠道定植的遗传基础[J].中国家禽,2013,35(16):1.
[2]秦丽云,郭玉梅,吕国平,等.2011 至2012 年石家庄地区沙门菌食物中毒分离株分子流行病学特征[J].微生物学杂志,2014,34(1):84-87.
[3]李伟,陈庆森.肠道黏膜免疫屏障及其菌群与机体健康关系的研究进展[J].食品科学,2008,29(10):649-655.
[4]王凯,郑洋,邢雅玲,等.细胞自噬在病毒感染与免疫调节中的作用机制[J].中国生物化学与分子生物学报,2011,27(11):987-992.
[5]眭怡群,冯一中.自噬相关基因LC3、Beclin-1 与凋亡相关基因p53、BCL-2 在大肠癌中的表达及意义[J].临床与实验病理学杂志,2012,28(3):282-286.
[6]章晟,于长明.细胞自噬在病原体感染过程中的作用研究进展[J].军事医学科学院院刊,2009,33(5):469-472.
[7]吴云舟,安莹,孙田,等.新城疫病毒疫苗株F 蛋白裂解位点改造对诱导HepG2 细胞发生自噬的影响[J].中国预防兽医学报,2013,35(9):698-701.
[8]Campoy E,Colombo M I.Autophagy in intracellular bacterial infection[J].Biochim Biophys Acta,2009,1793(9):1465-1477.
