犬源伪狂犬病毒BJ-YT株的分离鉴定及人工感染犬引起的病理学变化
2014-03-08张乐天杨万莲王巨实王安琦吕艳丽
张乐天,杨万莲,钟 承,王巨实,刘 蕾,王安琦,苏 畅,吕艳丽
(中国农业大学 动物医学学院,北京 100193)
犬伪狂犬病(Pseudorabies)是由伪狂犬病毒(PRV)引起的一种急性致死性疾病。PRV 属于疱疹病毒科,疱疹病毒甲亚科,水痘病毒属[1]。猪是该病毒的自然宿主,可带毒长期存活。除灵长类的很多哺乳动物对该病毒易感,犬主要通过食入被病毒污染的生猪肉或内脏而感染[2]。目前尚未见PRV 在犬之间相互传播的报道。犬感染PRV 后潜伏期为3 d~9 d,并通常在表现临床症状后的48 h 内死亡[3]。
自2011 年以来,国内许多地区的猪场暴发并流行猪伪狂犬病[4-5],报道显示近年已有PRV 分离株形成了相对独立的分支,其在我国的流行可能与病毒的基因突变有关[6]。同时,北京及周边地区疑似犬伪狂犬病的病例数目呈上升态势,但目前国内外尚无对犬感染PRV 的系统病理学研究。因此,本研究开展了人工感染PRV 犬的病理学观察,为临床诊断犬伪狂犬病提供依据,并为PRV 在非自然宿主的致病机制的研究奠定基础。
1 材料和方法
1.1 病料样品来源及实验动物 病料样品为中国农业大学教学动物医院确诊的一例死于食用生猪骨感染PRV 的约克夏犬,取病犬的大脑、小脑、脑干固定于10%中性缓冲福尔马林溶液,与PBS 按1∶10 比例混合,研磨成组织匀浆,保存于-80 ℃备用。5只健康并且免疫完全的比格犬购自北京科宇动物养殖中心,经血清中和试验鉴定为PRV 阴性。
1.2 主要试剂 2×Taq PCR Master Mix 试剂盒购自北京艾德莱生物科技有限公司;鼠抗PRV gE 单克隆抗体(MAb)由中国农业大学动物医学院何伟勇副教授提供;山羊血清、PV-9002 小鼠超敏二步法免疫组化检测试剂盒、DAB 显色剂均购自北京中杉金桥生物技术有限公司。
1.3 病毒的分离和鉴定 利用实验室前期建立的PRV 特异性PCR 扩增方法[7],采用PRV 高度保守的gB 基因特异性引物,分别对大脑、小脑、脑干的组织进行检测。将脑干按常规方法包埋,制备成4 μm厚的石蜡切片;酒精脱水后用3 % H2O2封闭内源性过氧化物酶,并采用10 %山羊血清孵育30 min 以阻断一抗的非特异性结合;以PRV gE MAb 为一抗,按照PV-9002 小鼠超敏二步法免疫组化检测试剂盒说明书进行病毒的免疫组化鉴定。最后经苏木精复染,中性树脂封片后于显微镜下观察。将脑干组织匀浆经0.22 μm 滤器过滤后接种于单层VERO细胞以分离病毒。待观察到细胞病变(CPE)后,将细胞培养物按照上述的方法进行PCR 鉴定。
1.4 病毒分离株的TCID50的测定 病毒盲传至出现CPE 后再连续传3 代,并将病毒培养液的4 代~7 代10 倍倍比稀释(10-1~10-10),将其接种至单层VERO 细胞进行培养。按CPE 情况,利用Karber 法计算TCID50,即lgTCID50=最高稀释度的对数-稀释度对数间的差×(阳性孔比率总和-0.5)。
1.5 人工感染试验 将比格犬分为两组,实验组为3 只(编号分别为1、2 和3),对照组2 只(编号分别为4 和5)。实验组犬于颈背部皮下注射2 mL 含有2×106TCID50的PRV 培养液,对照组皮下注射2 mL DMEM。两组犬分别饲养于相互隔绝的房间,每只犬饲养于独立的犬笼。均饲喂商品化犬粮,每日早、晚测量体温。在人工感染后的第0、2 d、4 d、6 d 静脉采血,分离血清,利用全自动干式生化仪测量丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和肌酸激酶(CK)。
1.6 病理学观察和免疫组化试验 动物死亡后立即进行剖检,分别取小脑、大脑、脑干、心、肺、肝、胰腺、胃、十二指肠、空肠、胸腺、脾、扁桃体、下颌淋巴结、肠系膜淋巴结、肾、膀胱、肾上腺固定于10 %中性缓冲福尔马林溶液,并按常规程序制备成4 μm 厚的石蜡切片,经HE 染色后在显微镜下观察组织学病变,按照1.3 中的方法对各组织进行免疫组化检测,以定位PRV 抗原。
2 结果
2.1 临床病例的PCR检测和病毒分离 经PRV 特异性PCR 扩增,从患犬的脑干样品中扩增得到约370 bp 的DNA 片段,与预期相符(372 bp),而大脑、小脑样品扩增结果均为阴性(图1)。免疫组化检测显示,在患犬脑干的神经元细胞的胞质和胞核中发现棕色颗粒样阳性信号(图2)。将患犬脑干研磨液接种VERO 细胞后,盲传至第4 代出现CPE。细胞培养物经PCR 扩增获得约370 bp 的目的片段(图3)。对病毒进行全序列测定,并将测序结果登录至GenBank 中(KC981239)。结果显示,该分离株与GenBank 中登录的猪源PRV 的gE 基因核苷酸序列(KC415028)同源性为100 %[7]。综合上述实验结果,确诊病犬死于PRV 感染,并将分离株命名为BJ-YT。
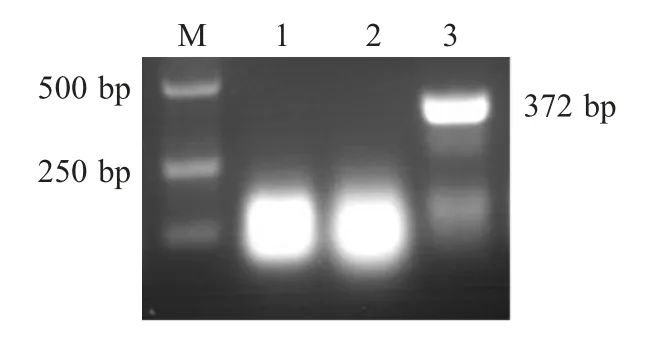
图1 临床病例组织样品中PRV gB 基因PCR 扩增结果Fig.1 PCR amplification of PRV gB gene from tissue sample of the clinical case
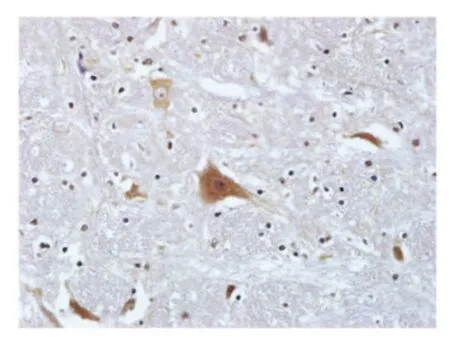
图2 临床病例脑干免疫组化结果Fig.2 Immunoreactivity for PRV antigen in the brainstem of clinical case
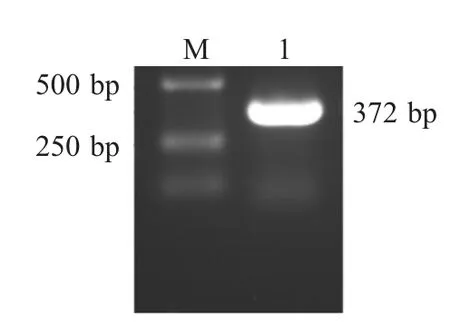
图3 细胞培养物中PRV gB 基因的PCR 扩增Fig.3 PCR amplification of PRV gB gene from cell culture
2.2 BJ-YT分离株的TCID50测定 对第4 代~7代细胞培养物进行TCID50测定,结果显示病毒连续传代至第6 代后毒力稳定,TCID50为10-6/mL。
2.3 人工感染犬的临床症状和生化指标 采用分离株BJ-YT 人工感染健康比格犬,感染后实验动物的潜伏期为4 d~7 d,并且感染犬在出现症状后24 h~36 h 内死亡。所有感染犬均表现为精神沉郁、厌食、剧痒以及后期进行性的呼吸急迫至呼吸困难。患犬持续抓挠注射部直至死亡,造成颈背部被毛脱落、充血、出血。感染犬的奇痒症与发热同时出现,发热持续10 h~29 h,随后体温下降至正常或偏低,之后死亡。另外3 号犬出现流涎,2 号犬出现血尿。所有实验组动物均有AST、AST/ALT 及CK 指标的升高,但ALT 仍在正常范围内(图4)。对照组动物均未见异常。
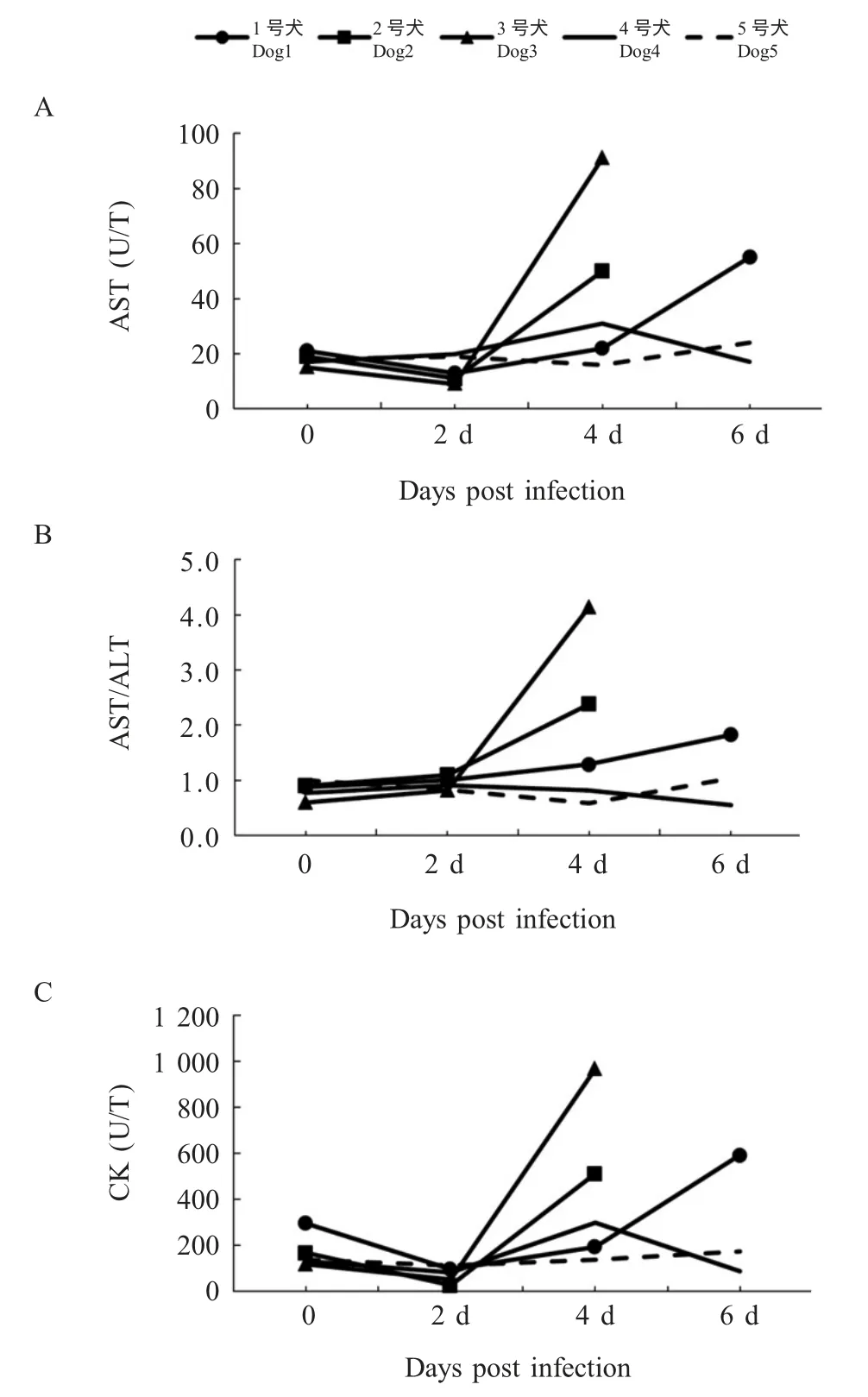
图4 人工感染比格犬AST、AST/ALT、CK 变化水平Fig.4 The changes of AST,AST/ALT and CK in beagle dogs experimentally infected with the PRV BJ/YT isolate
2.4 人工感染犬的病理变化 1 号、3 号犬自然死亡,2 号犬于濒死期实施安乐术。4、5 号犬于实验组动物死亡后进行安乐术。3 号犬在颈部、背部和腿部出现水肿。所有实验组犬心脏的乳头肌均有不同程度出血(图5A,箭头所示)。2、3 号犬心脏二尖瓣出血(图5B),1、3 号犬心脏二尖瓣可见血栓(图5A)。另外2 号犬心外膜轻微出血,3 号犬冠状沟出血(图5C)。
实验组犬的肺脏均有不同程度的充血、出血斑(图5D),其中2 号犬气管内含有大量白色泡沫(图5E)。
1、2 号犬胃粘膜广泛性潮红(图5F)。所有实验组犬小肠均有大小不一的瘀点和瘀斑(5G)。病变向大肠逐渐减弱。
实验组犬胸腺弥漫性出血(图5H),1、2 号犬的脾脏表面有暗红色的不规则凸起(图4I)。所有感染犬的扁桃体、下颌淋巴结、肠系膜淋巴结均有不同程度的出血点和出血斑。
对照组犬各组织器官均未见异常。
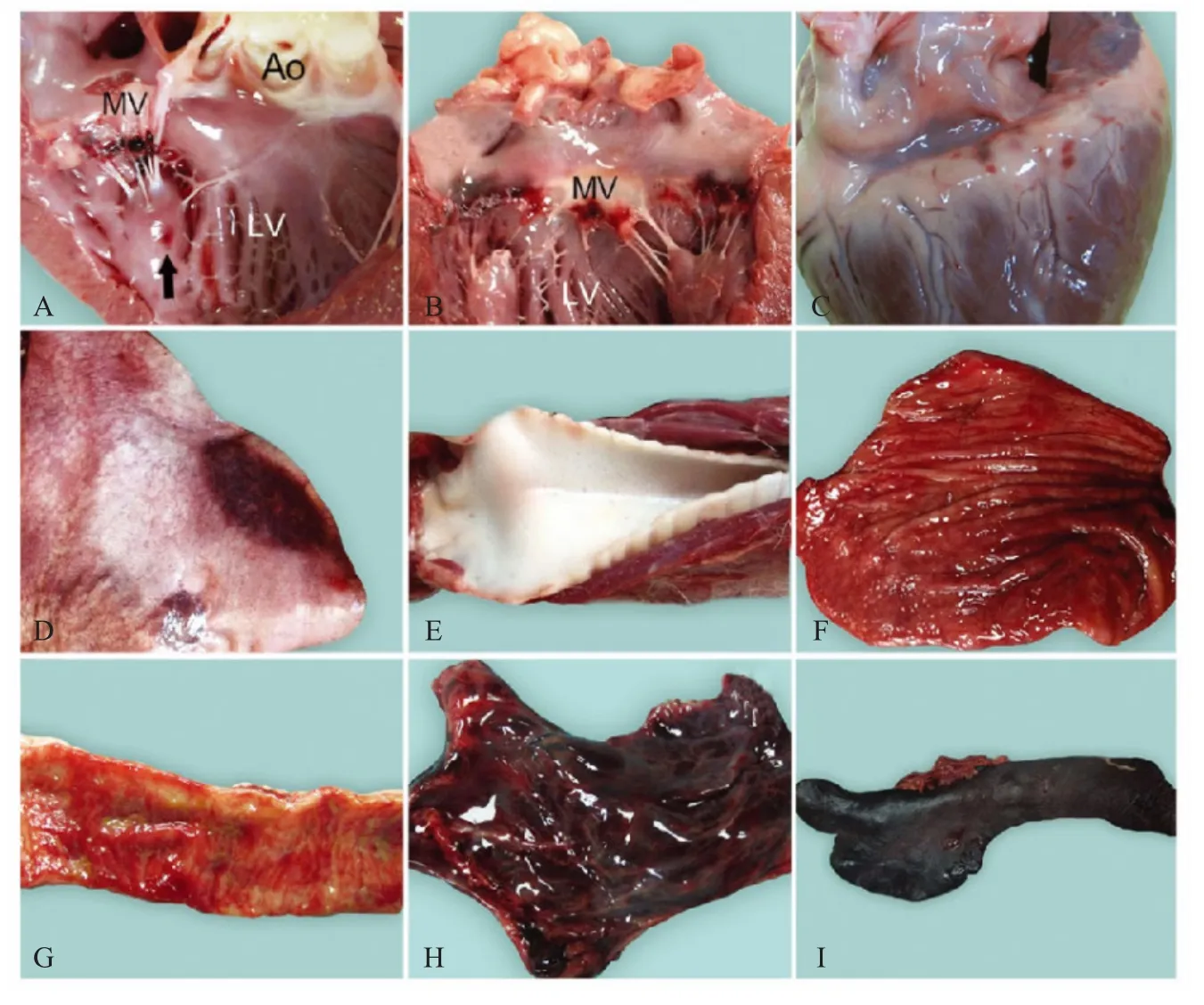
图5 人工攻毒比格犬的病理学变化Fig.5 Gross lesions of beagle dogs experimentally infected with PRV BJ/YT isolate
2.5 人工感染犬的组织病理学变化 所有实验组犬的脑干灰质均出现了以轻微血管套(图6A)、嗜神经现象(图6B)和胶质细胞增生(图6C)为特征的非化脓性脑炎。3 号犬小脑颗粒层有轻度出血(图6D)。
所有感染犬均有心肌出血(图6E),2 号犬二尖瓣严重出血(图6F)。
所有感染犬的肺均有不同程度的充血和出血(图6G),肝、胃、小肠轻度到中度的充血。
肾脏病变显著,主要表现为急性非化脓性肾炎。所有实验组犬的肾间质中度到严重充血,肾小囊扩张,肾小囊和肾小管中聚集有多量嗜酸性物质,但基膜尚完整(图6H)。肾间质中未见明显白细胞浸润。
所有感染犬的胸腺均严重出血(图6I)和淋巴细胞排空。脾脏不同程度充血。扁桃体和淋巴结水肿,淋巴结不同程度排空(图6J),有轻度到中度的出血。
2 号和3 号犬肾上腺皮质束状带有多灶性轻度到中度出血(图6K)。
膀胱、胰腺未见异常。
2.6 人工感染犬免疫组化检测结果 所有实验犬的脑干的神经元胞质中均有棕色颗粒样的PRV 抗原阳性信号(图6L)。其他组织均未检测到抗原阳性信号。
3 讨论
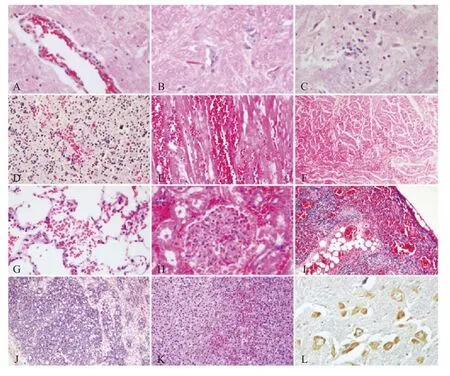
图6 人工感染比格犬的组织病理变化和免疫组化结果Fig.6 Histopathological findings and immunostaining of beagle dogs experimental infected with PRV BJ/YT isolate
本研究中全身性广泛出血是大体剖检最主要的病理变化,这种全身性广泛出血可引起病犬失血性休克。而心脏二尖瓣的血栓可能继发于心脏瓣膜损伤和全身出血[8],心脏尤其是心内膜的出血和血栓,可导致心脏输出功能下降,进而引起心力衰竭。全身广泛性出血及心脏损伤可能导致循环性休克从而引起脾的不完全收缩[8],由此推测,循环衰竭可能是导致病犬急性死亡的重要原因。
组织病理学检测显示,中枢神经系统的组织学病变主要集中在脑干,但病变程度在个体间存在差异。该现象与之前报道的PRV 感染非自然宿主[9-10]以及自然宿主一致。但本次人工感染试验的非化脓性脑炎程度轻微,可能与人工感染造成的发病急、病程短有关。有报道表明仔猪感染PRV 后可见肾脏有广泛点状出血[11],本研究显示PRV 可造成感染犬严重的急性肾小球肾炎,但机制尚不清楚。在本实验中,所有的感染犬在后期均表现出进行性的呼吸急促至困难,但在其肺脏中并未检出病毒抗原和坏死现象,仅是轻度到中度的充血和轻度出血并不足以造成急性的呼吸系统症状。有研究表明PRV 感染大鼠脊髓的横膈膜运动神经元以及延髓的呼吸中枢均未检测到PRV 抗原[12],因此PRV 造成非自然宿主的急性死亡并非源于呼吸衰竭。生化指标中AST、AST/ALT 和CK 升高,但ALT 仍正常表明心脏存在损伤的可能,同时心脏的病变在本实验以及其他报道[2,13]中也相对明显。因此感染犬的呼吸困难可能是继发于心脏的损伤。
本研究显示无论是自然还是人工感染致死的犬伪狂犬病例,几乎均存在程度不一的胸腺出血现象,本实验中还存在胸腺和淋巴结淋巴细胞的排空现象,但这种损伤对成年犬造成的危害有待于进一步研究。本实验仅在脑干的神经元中检出病毒抗原,而其他病变显著的内脏器官和组织中却未检出病毒,表明这些病变并非由病毒直接引起。导致PRV 感染犬死亡的最终原因尚须进一步研究。
[1]Pomeranz L E,Reynolds A E,Hengartner C J.Molecular biology of pseudorabies virus:Impact on neurovirology and veterinary medicine[J].Microbiol Mol Biol Rev,2005,69(3):462-500.
[2]Quiroga M I,Nieto J M,Sur J,et al.Diagnosis of aujeszky's disease virus infection in dogs by use of immunohistochemistry and in-situ hybridization[J].J Vet Med,1998,45:75-81.
[3]张乐天,陆梓杰,吕艳丽.犬伪狂犬病病毒致病机理研究进展[J].动物医学进展,2013,34(6):145-149.
[4]Wu Rui,Bai Chao-yong,Sun Jin-zhong,et al.Emergence of virulent pseudorabies virus infection in northern china[J].J Vet Sci,2013,14(3):363-365.
[5]Maresch C,Lange E,Teifke J P,et al.Oral immunization of wild boar and domestic pigs with attenuated live vaccine protects against pseudorabies virus infection[J].Vet Microbiol,2012,161(1-2):20-25.
[6]赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE 基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509.
[7]钟承,张乐天,王巨实,等.犬源伪狂犬病毒BJ/RD 株的分离鉴定及gE 基因分析[J].中国动物传染病学报,2013,21(5):1-6.
[8]Zachary J F,McGavin M D.Pathologic basis of veterinary disease[M].St Louis,US.:Elsevier Medicine,2011.
[9]Quiroga M I,Vazquez S,Lopez-pena M,et al.Experimental aujeszky's disease in blue foxes[J].J Vet,1995,42:649-657.
[10]Schoniger S,Klose K,Werner H,et al.Nonsuppurative encephalitis in a dog[J].Vet Pathol,2012,49(4):731-734.
[11]陈焕春,方六荣,何启盖,等.猪伪狂犬病病毒鄂a 株的分离鉴定[J].畜牧兽医学报,1998,29(2):97-104.
[12]Hoirimi T,Yasuhiro Y,Chieko K,et al.Mechanism of pruritus and peracute death in mice induced by pseudorabies virus(PRV)infection[J].J Vet Med Sci,1993,55:913-920.
[13]Cramer S D,Campbell G A,Njaa B L,et al.Pseudorabies virus infection in oklahoma hunting dogs[J].J Vet Diagn Invest,2011,23(5):915-923.
