消栓肠溶胶囊对大脑中动脉栓塞大鼠远隔脑区星形胶质细胞活化及凋亡蛋白表达的影响
2014-03-07王雅丽张宁刘菁吴曦王蕾赵晖
王雅丽,张宁,刘菁,吴曦,王蕾,赵晖
大脑中动脉栓塞后远离梗死灶的相关脑区在亚急性期也会发生病理改变,目前认为反应性星形胶质细胞活化、细胞凋亡是导致远隔部位损害的重要因素[1]。脑缺血缺氧后,神经细胞出现多种形式的氧化性脱氧核糖核酸(deoxyribonucleic acid,DNA)损伤,如不及时修复,则可启动凋亡程序。半胱氨酸天冬氨酸蛋白酶(cystein-aspartate protease 3,caspase3)是细胞凋亡过程的执行蛋白酶,多聚腺苷酸二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)为最主要的底物,Caspase-3因降解PARP,而被认为是细胞凋亡的一个早期分子标志[2]。星形胶质细胞参与细胞凋亡在内的多种形式的细胞死亡调节,在继发性脑组织损伤中的作用受到了普遍关注[3]。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)为星形胶质细胞的特异性标志蛋白,是其活化和增殖的标志物之一[4]。通过各种有效手段保护缺血远隔部位,抑制星形胶质细胞异常活化,阻断凋亡信号级联分子的活化对卒中康复具有重要意义。
补阳还五汤是治疗缺血性卒中的代表方[5],消栓肠溶胶囊以补阳还五汤为基础,依托现代定量生物萃取工艺制备的中成药制剂,本实验采用大脑中动脉栓塞模型从星形胶质细胞活化以及Caspase-3、PARP的表达变化,探讨消栓肠溶胶囊保护缺血远隔脑区的作用及机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性Sprague-Dawley(SD)大鼠,3月龄,体重为300~350 g,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(京)2012-0001。饲养在首都医科大学实验动物中心SPF级实验室,动物实验设施许可证号:SYXK(JING)2010-0020。实验条件下自然饮食,适应环境1周后进行实验。
1.1.2 试剂与仪器 消栓肠溶胶囊,三门峡赛诺维制药有限公司(批号20130407);脑心通胶囊,陕西步长制药有限公司(批号Z20025001);兔抗GFAP单克隆抗体,北京中杉金桥公司(13114A06);兔抗Caspase-3单克隆抗体,abcam公司(ab4051);兔抗PARP单克隆抗体,abcam公司(Lot#784578);山羊抗兔IgG/DylightTM488,北京中杉金桥公司(96184);山羊抗兔IgG/Alexa Fluor 594,北京中杉金桥公司(103320);羊血清工作液,北京中杉金桥公司(ZLI-9021);大小鼠抓力测试仪(YLS-13A,山东科学技术设备站);Eclipse生物显微镜(Nikon,日本);图像采集分析系统(NIS-Elements Basic Research,日本);Centrifuge 5810R高速冷冻离心机(Eppendorf,美国)。
1.2 方法
1.2.1 大鼠中动脉栓塞模型制备 参照文献[6]线栓法制备大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)永久性缺血模型。大鼠麻醉后,仰卧位固定,在颈总动脉分叉下方剪一切口,将栓线(直径0.265 mm,长4 cm)置于颈内动脉18 mm,扎紧动脉残端,缝合皮肤。假手术组大鼠麻醉后,仅暴露颈内外动脉分支,不闭塞大脑中动脉。术中、术后室温严格控制在24~25℃,大鼠体温维持在36.5~37.5℃。大鼠麻醉清醒后出现明显左侧偏瘫体征(不能完全伸展左前肢、行走时向左侧倾倒或转圈者)纳为实验对象。
1.2.2 分组与给药 根据药理实验动物与人体临床等效剂量换算关系确定消栓肠溶胶囊和脑心通胶囊的给药剂量。实验大鼠共计90只随机分为6组,每组15只:假手术组、模型组、消栓肠溶胶囊(420 mg/kg、140 mg/kg、47 mg/kg)3个剂量组和脑心通胶囊600 mg/kg组。造模后2 h给药组大鼠灌胃给药1次,造模24 h再次灌胃给药,连续给药15 d,每天1次。假手术组、模型组灌胃等容量生理盐水。
1.2.3 大鼠抓握力量检测 参照YLS-13A大小鼠抓力测定仪使用说明书进行抓握力量检测,大鼠双前肢抓住拉力测试仪的拉力横杆,测试者左手先固定拉力板,右手向后拉住鼠尾,松开左手,右手向后拉拽大鼠身体,大鼠为了不从横杆滑落会抓握横杆不放,直至滑落,读取使大鼠滑脱的最大拉力值,每只大鼠测2次,取平均值。
1.2.4 取材与标本处理 缺血15 d后,各组随机取4只大鼠,麻醉后,先用300 ml生理盐水快速左心室灌注冲洗,再进行4%多聚甲醛心内灌注固定,恒定灌注时间60 min,待固定充分后,开颅取脑,切取视交叉后4 mm组织块,投入相同固定液于4℃固定1周后,常规石蜡包埋,切片染色。
1.2.5 免疫荧光组织化学染色 0.1 mol/L柠檬酸缓冲液(pH 6.0)高热修复抗原20 min,10%羊血清封闭1 h,一抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(抗体稀释1∶200)、PARP(抗体稀释1∶80)、Caspase-3(抗体稀释1∶90),于湿盒中4℃孵育40 h。二抗山羊抗兔(抗体稀释1∶800),室温孵育2 h后,0.01 mol/L PBS洗涤,4’,6-二脒基-2-苯基吲哚(4,6-Diamidino-2-phenylindole dihydrochloride,DAPI)封片。
1.2.6 图像处理 在激发/发射波长470/490 nm条件下,GFAP阳性细胞呈现绿色荧光。在激发/发射波长540/580 nm条件下,PARP和Caspase-3阳性细胞呈红色荧光。NISElements Basic Research图像采集分析系统采集每张切片右侧(缺血侧)海马区相互不重叠的3个视野,对每个视野Caspase-3阳性表达细胞计数;对每个视野GFAP、PARP阳性表达细胞进行分析,以积分光密度(integrated optical density,IOD)反映阳性表达的免疫强度。
1.2.7 统计学处理 采用SPSS 10.0进行数据处理和统计分析,符合正态分布的计量资料采用均数±标准差表示,大鼠抓握力量检测数据采用重复测量的单因素方差分析,免疫荧光染色图像分析数据进行单因素方差分析,组间比较采用LSD检验。P<0.05具有显著性。
2 结果
2.1 消栓肠溶胶囊对大脑中动脉栓塞大鼠前肢抓握力量的影响 造模后3 d、7 d、12 d和15 d,各组大鼠前肢抓握力量之间差异明显(F=6.432,P=0.000;F=3.345,P=0.011;F=2.744,P=0.029;F=3.286,P=0.012),模型组和假手术组大鼠的前肢抓握力量之间差异具有显著性(P均<0.01);造模后7 d,消栓肠溶胶囊420 mg/kg组大鼠前肢抓握力量较模型组增加,差异具有显著性(P<0.05);造模后12 d,消栓肠溶胶囊140 mg/kg组大鼠前肢抓握力量较模型组增加,差异具有显著性(P<0.05);造模后15 d,消栓肠溶胶囊420 mg/kg、140 mg/kg、47 mg/kg组和脑心通胶囊组大鼠前肢抓握力量较模型组增加,差异具有显著性(P<0.05或P<0.01)(表1)。
2.2 消栓肠溶胶囊对大脑中动脉栓塞大鼠海马GFAP表达的影响 缺血后,星形胶质细胞骨架蛋白GFAP表达增强,胞体肥大,有多个短至中等长度的增粗突起。图像分析结果显示,各组大鼠的海马GFAP表达之间差异有显著性(F=9.744,P=0.000)(图1)。模型大鼠海马区GFAP阳性表达较假手术组增强(P<0.01)。消栓肠溶胶囊420 mg/kg、140 mg/kg、47 mg/kg 3个剂量组及脑心通组大鼠海马区GFAP阳性表达较模型组减弱(P<0.01)(表2)。
表1 各组大鼠前肢抓握力量的比较(

表1 各组大鼠前肢抓握力量的比较(
注:与模型组比较,*:P<0.05,**:P<0.01
组别 N(例) 3 d 7 d 12 d 15 d假手术组 8 1448.45 116.83消栓肠溶胶囊420组 9 827.46 145.10**模型组 10 935.92 309.29** 1207.05233.17** 1173.76120.77** 1205.46 271.72 707.32146.71 700.80145.09 763.00 364.97**消栓肠溶胶囊140组 9 1037.97 388.59 1043.93276.25* 899.02405.53 1114.56 268.50*消栓肠溶胶囊47组 12 919.86 189.15 819.14289.34 972.09330.77* 1023.87 205.46*F值 6.432 3.345 2.744 3.286 P值 0.000 0.011 0.029 0.012 293.41**脑心通胶囊组 8 687.05 272.82 825.00380.42 865.64318.19 1062.18 295.18 858.15357.44 834.21233.96 1013.86

图1 各组大鼠海马区GFAP的表达 (免疫荧光染色,×400)
2.3 消栓肠溶胶囊对大脑中动脉栓塞大鼠海马Caspase-3、PARP表达的影响 图像分析结果显示,各组大鼠的海马Caspase-3阳性细胞数及PARP表达比较差异有显著性(F=6.362,P=0.000;F=8.863,P=0.000)(图2~3)。和假手术组相比,大脑中动脉栓塞模型组大鼠海马区Caspase-3阳性细胞数增多,PARP表达增强(P<0.01);消栓肠溶胶囊(420 mg/kg、140 mg/kg、47 mg/kg)均可不同程度减少海马Caspase-3阳性细胞,下调PARP表达,差异较模型组显著(P<0.05或P<0.01);脑心通胶囊组大鼠PARP阳性表达也较模型组降低(P<0.01)(表3)。
3 讨论
临床研究和动物实验表明,脑梗死后,远离梗死灶的纹状体、丘脑、黑质、海马、脑干和脊髓均可发生继发性损害,出现低灌注状态,神经元数量减少、功能下降和轴突再生减弱[7-8]。氧化性DNA损伤及凋亡过程的启动是远隔脑区神经元损害的重要机制[9]。本研究显示:大脑中动脉栓塞15 d后,远离梗死灶的海马脑区Caspase-3阳性细胞明显增多,PARP表达增强。Caspase是一组半胱氨酸天冬氨酸蛋白酶,Caspase-3通过降解细胞内作用底物PARP蛋白而诱发凋亡,是启动凋亡过程的重要“执行者”。PARP为真核细胞内具有多聚腺苷酸二磷酸核糖基催化活性的蛋白酶,作为重要的DNA修复酶,PARP可识别DNA单链断裂位点,当DNA少量损伤时,PARP可修复DNA单链及双链断裂,维持基因组的完整性。当DNA大量损伤时,PARP持续激活可耗竭细胞内NAD+和ATP,降低神经细胞抗氧化损伤能力,激活凋亡关键蛋白酶Caspase-3,启动细胞凋亡程序,最终导致细胞坏死或凋亡[10-11]。因此,PARP蛋白表达水平反映了DNA单链损伤情况及细胞修复能力[12]。本研究结果提示大脑中动脉栓塞虽不直接影响海马区的血液供应,但可造成海马神经细胞DNA氧化损伤,Caspase-3/PARP凋亡信号激活。
表3 消栓肠溶胶囊对海马Caspase-3、PARP表达的影响(
注:PARP:多聚腺苷酸二磷酸核糖聚合酶;Caspase-3:半胱氨酸天门冬氨酸蛋白酶3;与模型组比较,*:P<0.05,**:P<0.01
组别 N(例) PARP积分光密度 Caspase-3细胞数(个)/mm2假手术组 4 4889.54 1452.38** 6.45 1.86**模型组 4 8378.45 1220.79 11.46 2.57消栓肠溶胶囊420组 4 6097.10 1887.49** 7.67 2.35**消栓肠溶胶囊140组 4 6426.01 1631.63** 8.58 1.83**消栓肠溶胶囊47组 4 5341.56 1518.64** 9.67 2.64*脑心通胶囊组 4 5600.11 1411.69** 9.67 1.94 F值 8.863 6.362 P值 0.000 0.000
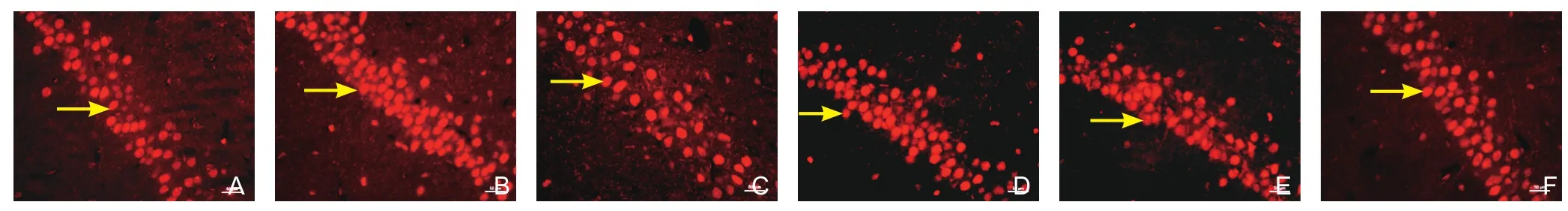
图2 各组大鼠海马区PARP的表达(免疫荧光染色,×400)

图3 各组大鼠海马区Caspase-3的表达(免疫荧光染色,×400)
星形胶质细胞在维持脑缺血微环境的稳态及神经元存活等方面发挥关键作用。研究发现,大脑中动脉栓塞后,海马区星形胶质细胞标志蛋白GFAP表达明显增强。Block等[13]发现,局灶性脑缺血后,丘脑、黑质网状部、海马和脊髓等缺血远隔部位出现以小胶质细胞和星形胶质细胞激活为特征的炎症改变,与本研究结果相似。
过度活化的星形胶质细胞中还原型辅酶活性增高,产生大量NO,影响DNA修饰,可促使神经元损伤和凋亡[14]。同时,增生的胶质细胞分泌大量的细胞毒性因子,如白细胞介素1-β(interleukin,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、环氧化酶2(cyclooxygenase,COX-2)和诱导型一氧化氮合酶(iducible nitric oxide synthase,iNOS),这些细胞因子相互作用,既可通过星形胶质细胞上的相应受体刺激其分裂和增生,形成胶质瘢痕,又可参与炎症级联反应,最终导致神经细胞坏死、凋亡[15]。
补阳还五汤为临床治疗缺血性卒中的常用有效复方,其药理作用主要环节包括:降低脑组织的耗氧量,提高脑组织对缺血缺氧刺激的耐受性,抗自由基损伤,抑制炎性级联反应,降低兴奋性氨基酸毒性,减轻神经细胞凋亡[16-18]。消栓肠溶胶囊以该方为基础,通过现代工艺技术制备而成,既解决了汤剂煎煮、携带不便的问题,又可对其制剂质量进行有效的控制。本研究结果显示消栓肠溶胶囊可促进脑缺血大鼠肢体功能恢复,同时可减轻大脑中动脉栓塞大鼠海马星形胶质细胞异常活化程度,抑制Caspase-3/PARP信号分子的活化。
目前治疗缺血性卒中的有效药物治疗为溶栓治疗,但溶栓存在安全窗的时间限制。众多的神经保护剂,通常在动物实验阶段有效而到临床应用则无效[19]。神经保护剂的研究困惑引发了科研工作者对卒中治疗策略的深层次思索[20]。研究发现神经元、胶质细胞形成复杂的信号网络,任何致神经元损伤的因素均可同时损伤胶质细胞,后者的一系列病理改变会加剧神经元损伤[21]。本研究发现消栓肠溶胶囊可抑制星形胶质细胞异常活化,阻抑Caspase-3、PARP凋亡信号分子激活,保护缺血远隔脑区,为临床上治疗卒中提供实验依据。但本研究存在的主要不足是目前尚不清楚GFAP、Caspase-3/PARP凋亡信号在缺血远隔部位的变化规律,因此无法判断消栓肠溶胶囊调控GFAP、Caspase-3、PARP表达的时间窗,在后续研究中,本课题组将制作不同缺血时间点的永久性大脑中动脉栓塞大鼠模型,动态观察GFAP、Caspase-3、PARP蛋白在缺血远隔部位的表达,分析消栓肠溶胶囊的调控作用,明确星形胶质细胞活化与细胞凋亡信号启动的关系,准确评价消栓肠溶胶囊的治疗作用。目前认为脑血流量不足、轴突退行性改变、神经营养障碍、神经递质代谢异常等因素均与远隔脑区的损害关系密切[22]。此外,消栓肠溶胶囊作为中药复方,具有多成分、多靶点的治疗作用特点,本研究结果仅提示消栓肠溶胶囊可通过抑制星形胶质细胞反应性增生,Caspase3/PARP蛋白激活减轻远隔脑区损伤。在后续研究中,本课题组将进一步从氧自由基代谢、营养因子表达、神经递质调节以及轴突再生等多个环节探讨消栓肠溶胶囊对远隔脑区的保护作用机制。
1 Karpuk N, Burkovetskaya M, Fritz T, et al.Neuroinflammation leads to region-dependent alterations in astrocyte gap junction communication and hemichannel activity[J]. J Neurosci, 2011, 31:414-425.
2 Andrabi SA, Kim NS, Yu SW, et al. Poly (ADP-ribose)(PAR) polymer is a death signal[J]. PNAS, 2006,103:18308-18313.
3 Perea G, Araque A. Astrocytes potentiate transmitter release at single hippocampal synapses[J]. Science, 2007,317:1083-1086.
4 Lee Y, Su M, Messing A, et al. Astrocyte heterogeneity revealed by expression of a GFAP-LacZ transgene[J].Glia, 2006, 53:677-687.
5 陈佩斯, 陈卫银. 补阳还五汤研究概况[J]. 实用中医药杂志, 2012, 03:228-229.
6 田金洲. 血管性痴呆[M]. 北京:人民卫生出版, 2003:598-607.
7 Zhao S, Kong W, Zhang S, et al. Pretreatment with scutellaria baicalensis stem-leaf total fl avonoid prevents cerebral ischemia-reperfusion injury[J]. Neural Regen Res, 2013, 34:3183-3192.
8 Wang SS, Wang YG, Chen HY, et al. Expression of genes encoding cytokines and corticotropin releasing factor are altered by citalopram in the hypothalamus of post-stroke depression rats[J]. Neuro Endocrinol Lett,2013, 34:773-779.
9 Dihné M, Grommes C, Lutzenburg M, et al. Different mechanisms of secondary neuronal damage in thalamic nuclei after focal cerebral ischemia in rats[J]. Stroke,2002, 33:3006-3011.
10 Sairanen T, Szepesi R, Karjalainen-Lindsberg ML, et al.Neuronal caspase-3 and PARP-1 correlate differentially with apoptosis and necrosis in ischemic human stroke[J]. Acta Neuropathol, 2009, 118:541-552.
11 Siegel C, McCullough LD. NAD+ depletion or PAR polymer formation:which plays the role of executioner in ischaemic cell death[J]. Acta Physiol, 2011, 203:225-234.
12 Sriram CS, Jangra A, Kasala ER, et al. Targeting poly(ADP-ribose) polymerase1 in neurological diseases:A promising trove for new pharmacological interventions to enter clinical translation[J]. Neurochem Int, 2014,15:70-81.
13 Block F, Dihné M, Loos M. Inf l ammation in areas of remote changes following focal brain lesion[J]. Prog Neurobiol, 2005, 75:342-365.
14 Andersson M, Blomstrand F, Hanse E. Astrocytes play a critical role in transient heterosynaptic depression in the rat hippocampal CA1 region[J]. J Physiol, 2007,10:843-852.
15 Dienel GA, Hertz L. Astrocytic contributions to bioenergetics of cerebral ischemia[J]. Glia, 2005,50:362-388.
16 Zhang H, Wang WR, Lin R. Buyang Huanwu decoction ameliorates coronary heart disease with Qi def i ciency and blood stasis syndrome by reducing CRP and CD40 in rats[J]. J Ethnopharmacol, 2010, 6:98-102.
17 Wang L, Huang Y, Wu J, et al. Effect of Buyang Huanwu decoction on amino acid content in cerebrospinal fl uid of rats during ischemic/reperfusion injury[J]. J Pharm Biomed Anal, 2013, 10:143-150.
18 Kong X, Su X, Zhu J, et al. Neuroprotective effect of buyang huanwu decoction on rat ischemic/ reperfusion brain damage by promoting migration of neural precursor cells[J]. Rejuvenation Res, 2014, 6:264-275.
19 高梅, 刘睿, 杜冠华.缺血性中风治疗新策略--靶向神经血管单元[J]. 中国临床药理学与治疗学, 2008, 13:813-821.
20 刘庆山, 方亮, 王维群. 脑梗死神经血管单元的病变机制与治疗策略[J]. 国际药学研究杂志, 2011, 38:105-108.
21 Macrez R, Ali C, Toutirais O, et al. Stroke and the immune system:from pathophysiology to new therapeutic strategies[J]. Lancet Neurol, 2011, 10:471-480.
22 杜一星. 扩散性抑制与局灶性脑缺血后远隔脑区损伤之间关系的研究[D]. 武汉:华中科技大学, 2007.
【点睛】
本研究发现消栓肠溶胶囊可抑制星形胶质细胞异常活化及Caspase-3、PARP表达,保护缺血远隔脑区,改善缺血动物模型的行为学功能
