辅色素对单体花色苷辅色效果的研究
2014-03-03刘婷婷韩业慧李记明
刘婷婷,唐 柯,韩业慧,李记明,2,于 英,2,徐 岩,*
(1.江南大学生物工程学院酿酒微生物与酶技术研究室,工业生物技术教育部重点实验室,江苏无锡 214122;2.烟台张裕葡萄酿酒股份有限公司,山东烟台 264000)
辅色素对单体花色苷辅色效果的研究
刘婷婷1,唐 柯1,韩业慧1,李记明1,2,于 英1,2,徐 岩1,*
(1.江南大学生物工程学院酿酒微生物与酶技术研究室,工业生物技术教育部重点实验室,江苏无锡 214122;2.烟台张裕葡萄酿酒股份有限公司,山东烟台 264000)
比较模拟酒体系下,六种辅色素(槲皮素,quercetin;槲皮苷,quercetin 3-rhamnoside;表儿茶素,epicatechin;表焙儿茶素,epigallocatechin;咖啡酸,caffeic acid;丁香酸,syringic acid)与三种单体花色苷储存过程中辅色效果与颜色变化,旨在研究不同结构辅色素与花色苷对辅色作用的影响。结果表明,槲皮素、槲皮苷以及咖啡酸与花色苷形成较好的辅色作用,但在储存后期槲皮素出现大幅减弱;六种辅色素对于花色苷二甲花翠素-3-O-葡萄糖苷(malvidin-3-O-glucoside,Mv-3-Glu)和二甲花翠素乙酰葡萄糖苷(malvidin-3-O-acetylglucoside,Mv-acet-Glu)的辅色大小明显高于对花色苷花翠素-3-O-葡萄糖苷(delphinidin-3-O-glucoside,Dp-3-Glu)的辅色大小。辅色素与花色苷的不同对颜色的保持程度也不同,槲皮苷和咖啡酸对花色苷颜色起到较好的保持作用,且对Mv-3-Glu、Mv-acet-Glu的保持程度高于对Dp-3-Glu的保持程度。研究证明:辅色素与花色苷的结构差异都会导致辅色作用的差异。
单体花色苷,辅色作用,酚类物质,CIELAB颜色
花色苷是葡萄酒中赋予其颜色的主要化合物,可以与一部分非花色苷酚相互作用,通过提高花色苷的稳定性来提高葡萄酒的颜色[1]。辅色作用包括通过共价键方式连接形成分子内辅色作用和以范德华力、疏水及离子相互作用为主要驱动力的分子间辅色作用[2-6]。与未添加辅色素的花色苷溶液相比,添加辅色素的花色苷溶液会出现最大吸收波长转移和吸光度值增加的现象,即红移现象和增色效应[3,5]。辅色作用对于年轻红葡萄酒的色泽强度和稳定性具有重要的意义,同时也是一种绿色自然而又安全的葡萄酒增色法[4]。
为探明花色苷与辅色素间的辅色效应,许多作者在模拟酒溶液中进行了相应的研究[6]。目前研究较多的辅色素为酚酸以及类黄酮中的黄酮醇、黄烷醇[3-4,6-8]。研究发现,不同辅色素的辅色效果不同;黄酮醇的辅色效果最好,酚酸次之,而黄烷醇的辅色效果 较 弱[3,6]。 这 些 报 道 中 多 用Mv-3-Glu作 为 研 究 对象,因其是年轻葡萄酒中含量最多的花色苷[3,6-9]。但有些研究报道发现,花色苷对葡萄酒颜色的贡献度并不是与其含量简单的成正比,还与花色苷的结构有关,即花色苷结构不同,它们显示的颜色(吸光率和CIELAB色值)也不相同[1,10-12]。但关于花色苷结构对辅色效果影响的相关研究还较少见报道[6,12-13]。
本研究选择六种酚类物质(黄酮醇:槲皮素、槲皮苷;黄烷醇:表儿茶素、表焙儿茶素;酚酸:咖啡酸、丁香酸)与分离纯化得到的三种结构不同的花色苷单体进行辅色作用研究。通过分析储存过程中辅色作用大小及CIELAB颜色参数的变化探讨不同辅色素及花色苷结构导致的辅色效果差异,以期为稳定葡萄酒颜色及提高红葡萄酒色度提供相关理论依据。
1 材料与方法
1.1 材料与仪器
单体花色苷Dp-3-Glu、Mv-3-Glu、Mv-acet-Glu(纯度分别为96.8%,95.3%,91.7%) 实验室制备;烟73葡萄 张裕葡萄酿酒股份有限公司;表儿茶素、表焙儿茶素、槲皮素、槲皮苷、咖啡酸、丁香酸 均为色谱纯,购自Sigma;乙醇、酒石酸 均为分析纯,国药集团化学试剂有限公司;乙腈、甲酸 均为色谱纯,上海安谱科学仪器有限公司。
制备液相 美国Waters公司;旋转蒸发仪 瑞士BUCHI公司;冷冻干燥机 美国LABCONCO公司;酶标仪 美国Thermo Scientific公司;氮吹仪 上海安谱科学仪器有限公司;SHB-3型循环多用真空泵 郑州杜甫仪器厂;分析天平 瑞士METTLER TOLEDO公司。
1.2 实验方法
1.2.1 花色苷制备 采用实验室已建立的花色苷制备方法:利用染色葡萄烟73的葡萄皮提取花色苷混合物,通过乙醇浸提后经XAD-7HP大孔树脂进行初步纯化,再利用制备液相进行分离得到三种花色苷的高纯单体,冻干备用[14]。
1.2.2 辅色素对花色苷的辅色作用 称取适量三种花色苷粉末,依次用pH3.6含5g/L酒石酸、12%乙醇水的模拟酒溶液溶解,使其浓度为100mg/L,分别溶解辅色素表儿茶素、表焙儿茶素、槲皮素、槲皮苷、咖啡酸和丁香酸,使其辅色剂/花色苷摩尔比为1∶1,以不添加辅色素的花色苷溶液作为对照。模拟酒溶液置于棕色具塞试剂瓶中,25℃黑暗条件下储存60d,前20d每4d取样,后40d每10d取样。
1.2.3 辅色作用大小分析 参照文献[3,15]的方法,利用以下公式表示量化辅色作用过程的大小(The magnitude of the copigmentation effect,M),简称辅色大小M值:

其中,A、A0分别为520nm处添加辅色素的花色苷模拟酒溶液与对照组模拟酒溶液的吸光度值。
1.2.4 CIELAB颜色分析 样品经过0.45μm微孔滤膜过滤,蒸馏水作为对照,分别在440、530、600nm测定吸光度值,采用CIELAB法计算亮度L*、红色色调a*、黄色色调b*、色度C*以及色调h[16-17]。
红色色调a*和黄色色调b*都在-120~120间,为坐标参数。若a*>0,与红色相关;a*<0,与绿色相关。当b*>0,与黄色相关;b*<0,与蓝色相关。亮度L*值在0~100间,它与颜色的深浅呈反比。色度C*与葡萄酒的颜色饱和度(鲜艳程度)成正比。色调h表示不同的颜色,如红、橙、黄、绿、青、蓝、紫。
2 结果与讨论
2.1 储存过程辅色大小M值比较
2.1.1 辅色素对辅色大小M值影响 由图1可见,不同辅色素的M值不同。整个储存过程中黄烷醇的M值最小,基本可以忽略,比较发现表焙儿茶素的M值稍高于表儿茶素,这一结果与Teixeira N等研究结果一致[7]。表焙儿茶素B环上的三个羟基使其结构更接近于平面,因而表焙儿茶素比表儿茶素更易与花色苷结合。对于酚酸,咖啡酸的M值高于丁香酸;且储存20d后,咖啡酸的M值逐渐增大,60d后,咖啡酸对Mv-3-Glu的M值达最大值(25.6)。两种黄酮醇的M值相差较大,槲皮苷的M值整个储存过程基本不变;槲皮素在储存初期具较好的辅色效果,但在储存到一定时期后会大幅度逐渐降低,降低74%~83%。Gómez-Míguez M等也发现了相应的现象,且发现储存过程中槲皮素的含量大幅减少,推测这是导致槲皮素储存后期辅色效果降低的原因[3]。
辅色素不同导致M值不同,其中黄酮醇的M值较黄烷醇和酚酸高,结果与前人研究相似,这与黄酮醇的平面多酚核结构易于花色苷紧密结合有关[3,18-20]。
2.1.2 花色苷对辅色大小M值影响 同一辅色素对不同花色苷M值也不同。辅色素对花色苷Mv-3-Glu、Mv-acet-Glu的M值高于对Dp-3-Glu的M值,其中以咖啡酸、槲皮苷以及槲皮素的M值相差最大。槲皮苷对Mv-3-Glu、Mv-acet-Glu的M值为对Dp-3-Glu M值的4倍,咖啡酸为2~3倍。槲皮素与Dp-3-Glu的M值在储存12d后出现明显的降低现象,远早于花色苷Mv-3-Glu、Mv-acet-Glu的30d,表明槲皮素与Dp-3-Glu形成的辅色复合物稳定性偏低。另外丁香酸及两种黄烷醇的M值变化趋势也不同,它们对Dp-3-Glu的M值随储存时间延长缓慢增长,而对花色苷Mv-3-Glu、Mv-acet-Glu则基本不变。
2.2 储存过程中模拟酒溶液CIELAB颜色参数变化
许多研究仅观察储存过程中花色苷最大吸收波长(λmax)处的颜色变化[2],但是为了更全面的了解颜色变化情况,整个可见光谱都应该被跟踪观察[3]。因而本研究采用可以较全面表征颜色变化的CIELAB法进行。图2~图6分别列出花色苷Dp-3-Glu、Mv-3-Glu、Mv-acet-Glu及添加辅色素的模拟酒溶液在储存过程中颜色参数L*、a*、b*、C*和h的变化。
2.2.1 模拟酒溶液亮度L*值变化
2.2.1.1 辅色素对亮度L*变化的影响 添加不同辅色素的模拟酒溶液L*变化不同。储存过程中添加黄酮醇的模拟酒溶液L*都低于对照组。而添加咖啡酸的Dp-3-Glu模拟酒溶液L*在储存10~30d内高于对照组,30d后,低于对照组;且添加咖啡酸的Mv-3-Glu、Mv-acet-Glu模拟酒溶液L*值逐渐降低;推测咖啡酸的辅色作用是逐渐形成的。添加黄烷醇和丁香酸的模拟酒溶液L*与对照组相差不大。

图1 添加辅色素的花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mvacet-Glu(C)模拟酒溶液储存过程中辅色大小变化Fig.1 Changes in the ratio[(A-A0)/A0]×100 in the model solutions containing six copigments and three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)during storage
总结发现,黄酮醇对模拟酒溶液的颜色加深作用高于酚酸和黄烷醇,但储存过程中槲皮素的加深作用后期降低,咖啡酸的加深作用逐渐增强。与辅色大小结果一致。
2.2.1.2 花色苷对亮度L*变化的影响 添加辅色素的Mv-3-Glu、Mv-acet-Glu模拟酒溶液比Dp-3-Glu模拟酒溶液相比,其L*值偏低。槲皮素处理的三种模拟酒溶液亮度变化不同,Dp-3-Glu溶液其亮度逐渐增大;Mv-3-Glu溶液则是在30d之前基本不变,30d之后大幅升高;Mv-acet-Glu溶液则开始降低后升高。推测与储存过程中槲皮素含量减少及辅色复合物稳定性有关[3]。添加黄烷醇及丁香酸 3种辅色素的模拟酒溶液亮度与未添加辅色素的模拟酒溶液亮度相差较小。
储存过程中,添加黄烷醇和丁香酸对Dp-3-Glu模拟酒溶液L*值未起到维持作用,对Mv-3-Glu、Mvacet-Glu起到的维持作用较弱;黄酮醇与咖啡酸对三种花色苷的模拟酒溶液的颜色深度都起到维持并加深的作用。

图2 添加辅色素的三种花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mv-acet-Glu(C)模拟酒溶液储存过程中L*变化Fig.2 Changes in lightness L*of model solutions containing three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)and six copigments during storage
2.2.2 模拟酒溶液红色色调a*及色度C*变化
2.2.2.1 辅色素对红色色调a*及色度C*变化的影响
由图3和图4可见,储存过程中同一种辅色素处理模拟酒溶液色度C*值变化与红色色调变化基本一致,而不同辅色素之间的变化趋势则略有不同。
添加咖啡酸和槲皮苷对花色苷Mv-3-Glu、Mvacet-Glu溶液的a*及C*值起到较好的保持作用,对花色苷Dp-3-Glu溶液则影响较小;添加槲皮素和表儿茶素的三花色苷模拟酒溶液a*及C*值低于对照组,其中以Dp-3-Glu溶液最低;而添加丁香酸及表焙儿茶素的模拟酒溶液稍高于对照组的a*值与C*值。
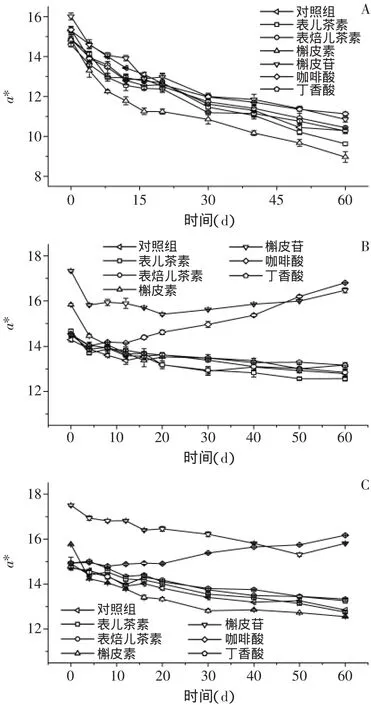
图3 添加辅色素的三种花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mv-acet-Glu(C)模拟酒溶液储存过程中a*变化Fig.3 Changes in redness a*of model solutions containing three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)and six copigments during storage
结合储存过程中添加槲皮素模拟酒溶液的辅色大小、L*值、a*及C*值变化情况可以发现,槲皮素虽与Dp-3-Glu形成辅色作用,但由于自身的黄色色调影响较大且在后期含量大幅减少,导致对花色苷溶液红色色调的保护作用基本可以忽略。
2.2.2.2 花色苷对红色色调a*及色度C*变化的影响比较储存过程中三种花色苷模拟酒溶液a*及C*值变化趋势发现,Dp-3-Glu模拟酒溶液的a*及C*值降低幅度大于Mv-3-Glu、Mv-acet-Glu两花色苷溶液的a*及C*值。这表明辅色作用对花色苷Mv-3-Glu、Mvacet-Glu的颜色保持作用高于Dp-3-Glu,与辅色大小及L*值结论一致。
2.2.3 模拟酒溶液黄色色调b*变化
2.2.3.1 辅色素对黄色色调b*变化的影响 结果见图5,所有添加辅色素的模拟酒溶液中添加表儿茶素的模拟酒溶液b*值升高幅度最大,添加槲皮素的模拟酒溶液整个储存过程中都呈现较高的黄色色调且变化不大,含另外四种辅色素的模拟酒溶液b*值缓慢升高且变化幅度相似。

图4 添加辅色素的三种花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mv-acet-Glu(C)模拟酒溶液储存过程中C*变化Fig.4 Changes in chroma C*of model solutions containing three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)and six copigments during storage
2.2.3.2 花色苷对黄色色调b*变化的影响 Dp-3-Glu模拟酒溶液的黄色色调升高程度普遍高于Mv-3-Glu、Mv-acet-Glu模拟酒溶液,花色苷Dp-3-Glu自身较易变化,推测与花色苷结构导致稳定性及显色情况不同有关。
2.2.4 模拟酒溶液色调h值变化
2.2.4.1 辅色素对色调h值变化的影响 结果见图6,添加槲皮素模拟酒溶液储存过程中h值变化较小,一直呈现橘红色。添加其他五种辅色素的Dp-3-Glu模拟酒溶液的颜色都由带蓝色色调的紫红色向橘红色转移。含有表儿茶素的Mv-3-Glu、Mv-acet-Glu的模拟酒溶液在储存20d后由红色转向橘红色,且变化幅度大于其他辅色素。表明表儿茶素对于防止花色苷溶液褐化的能力最差,这一现象与储存过程中表儿茶素与花色苷形成的黄色色素有关,新色素的最大吸收区域在430~470nm内[3,21]。对于添加咖啡酸的Mv-3-Glu、Mv-acet-Glu模拟酒溶液其颜色色调变化较小,多呈紫红色。Gómez-Míguez M等也发现相似的现象[3],推测与形成新色素的吡喃花色苷结构有关[22-23]。
2.2.4.2 花色苷对色调h值变化的影响 不同花色苷模拟酒溶液色调h的变化趋势一致,但变化幅度不同。花色苷Mv-3-Glu、Mv-acet-Glu模拟酒溶液的变化幅度低于Dp-3-Glu模拟酒溶液。

图5 添加辅色素的三种花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mv-acet-Glu(C)模拟酒溶液储存过程中b*变化Fig.5 Changes in yellowness b*of model solutions containing three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)and six copigments during storage

图6 添加辅色素的三种花色苷Dp-3-Glu(A)、Mv-3-Glu(B)、Mv-acet-Glu(C)模拟酒溶液储存过程中h变化Fig.6 Changes in hue h of model solutions containing three monomeric anthocyanins Dp-3-Glu(A),Mv-3-Glu(B),Mv-acet-Glu(C)and six copigments during storage
3 结论
不同辅色素对同一种花色苷的辅色大小不同,其中槲皮素、槲皮苷以及咖啡酸与花色苷可形成较好的辅色效果,另外三种辅色素的辅色效果相对较弱,但槲皮素在储存后期辅色效果大幅减弱。
同一种辅色素对不同花色苷的辅色大小也不同,六种辅色素对于花色苷Mv-3-Glu和Mv-acet-Glu的辅色效果明显高于对花色苷Dp-3-Glu的辅色效果,推测与花色苷取代基位置及种类有关。
辅色素与花色苷的不同导致颜色的保持程度也不同,槲皮苷和咖啡酸对花色苷Mv-3-Glu、Mv-acet-Glu的颜色保持效果放较好,且两者的保持程度高于对花色苷Dp-3-Glu的保持程度。
[1]韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关 系研究 进 展[J]. 食品 与 生 物 技 术 学 报 ,2011,30(3):328-335.
[2]Boulton R.The copigmentation of anthocyanins and its role in the color of red wine:a critical review[J].American Journal of Enology and Viticulture,2001,52(2):67-87.
[3]Gómez-Míguez M,González-Manzano S,Escribano-Bailón M T,et al.Influence of different phenolic copigments on the color of malvidin 3-glucoside[J].Journal of Agricultural and Food Chemistry,2006,54(15):5422-5429.
[4]刘延琳,刘苑.红葡萄酒中花色苷辅助成色作用的研究进展[J]. 中国农业科学,2010,43(12):2518-2526.
[5]Rodrigo N Cavalcanti,Diego T Santos,Maria Angela A.Nonthermal stabilization mechanisms of anthocyanins in model and food system:an overview[J].Food Research International,2011,44(2):499-509.
[6]Escribano-Bailon M T , Santos-Buelga C.Anthocyanincopigmentation-evaluation,mechanisms and implications for the colour of red wines[J].Current Organic Chemistry,2012,16(6):715-723.
[7]Teixeira N,Cruz L,Brás N F,et al.Structural Features of copigmentation of oenin with different polyphenol copigments[J]. Journal of Agricultural and Food Chemistry,2013,61(28):6942-6948.
[8]Lambert S G,Asenstorfer R E,Williamson N M,et al. Copigmentation between malvidin-3-glucoside and some wine constituents and its importance to colour expression in red wine [J].Food Chemistry,2011,125(1):106-115.
[9]Gordillo B,Rodríguez-Pulido F J,Escudero-Gilete M L,et al. Comprehensive colorimetric study of anthocyanic copigmentation in model colutions.Effects of pH and Molar Ratio[J].Journal of Agricultural and Food Chemistry,2012,60(11):2896-2905.
[10]Han F L,Zhang W N,Pan Q H,et al.Principal component regression analysis of the relation between CIELAB color and monomeric anthocyanins in young Cabernet Sauvignon wines[J]. Molecules,2008,13(11):2859-2870.
[11]Han F L,Jiang S M ,He J J,et al.Anthocyanins in‘Cabernet Gernischet’(Vitis vinifera L.cv.) Aged Red Wine and Their Color in Aqueous Solution Analyzed by Partial Least Square Regression[J].Food Science and Biotechnology,2009,18(3):724-731.
[12]Cabrita L,Fossen T,Andersen M.Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J]. Food Chemistry,2000,68(1):101-107.
[13]Eiro M J,Heinonen M.Anthocyanin color behavior and stability during storage:Effect of intermolecular copigmentation [J].Journal of Agricultural and Food Chemistry,2002,50(25):7461-7466.
[14]李杨.烟73葡萄皮中七种花色苷单体的制备及分析应用[D].无锡:江南大学,2012.
[15]González-Manzano S,Dueñas M,Rivas-Gonzalo J C,et al. Studies on the copigmentation between anthocyanins and flavan-3-ols and their influence in the colour expression of red wine[J]. Food Chemistry,2009,114(2):649-656.
[16]Ayala F,Echávarri J,Negueruela A.A new simplified method for measuring the color of wines.I.Red and rosé wines [J].American Journal of Enology and Viticulture,1997,48(3):357-363.
[17]Ayala F,Echávarri J,Negueruela A.A new simplified method for measuring the color of wines.III.All wines and brandies[J]. American Journal of Enology and Viticulture,1999,50(3):359-363.
[18]Baranac J M,Petranovic N A ,Dimitric-Markovic J M. Spectrophotometric study of anthocyan copigmentation reactions [J].Journal of Agricultural and Food Chemistry,1996,44(5):1333-1336.
[19]Baranac J M,Petranovic N A,Dimitric-Markovic J M. Spectrophotometric study of anthocyan copigmentation reactions. 2.Malvin and the nonglycosidized flavone quercetin[J].Journal of Agricultural and Food Chemistry,1997,45(5):1694-1697.
[20]Baranac J M,Petranovic N A,Dimitric-Markovic J M. Spectrophotometric study of anthocyan copigmentation reactions. 3.Malvin and the nonglycosidized flavone morin[J].Journal of Agricultural and Food Chemistry,1997,45(5):1698-1700.
[21]Santos-Buelga C,Francia-Aricha E M,Pascual-Teresa S,et al.Contribution to the identification of the pigments responsible for the browning of anthocyanin-flavanol solutions[J].European Food Research and Technology,1999,209(6):411-415.
[22]Fulcrand H,Santos P-J C,Sarni-Manchado P,et al.Structure of new anthocyanin-derived wine pigments[J].Journal of the Chemical Society,Perkin Transactions 1,1996(7):735-739.
[23]Monagas M,Bartolomé B,Gómez-Cordovés C.Evolution of polyphenols in red wines from Vitis vinifera L.during aging in the bottle[J].European Food Research and Technology,2005,220(3-4):331-340.
Copigmentation reactions between six copigments and three monomeric anthocyanins
LIU Ting-ting1,TANG Ke1,HAN Ye-hui1,LI Ji-ming1,2,YU Ying1,2,XU Yan1,*
(1.Lab of Brewing Microbiology and Applied Enzymology,The Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Yan Tai ChangYu Pioneer Wine Company Limited,Yantai 264000,China)
These reactions were investigated with three monomeric anthocyanins and six copigments (quercetin,quercetin 3-rhamnoside,epicatechin,epigallocatehin,caffeic acid,syringic acid) in model wine solutions.And the aim of research was to study the influences of anthocyanins,and copigments,structures on copigmentation. The results showed that: quercetin , quercetin 3-rhamnoside and caffeic acid appeared as the effective copigments.But the effect of copigmentation induced by quercetin was not stable ,decreased largely in the later storage period.The copigmentation effect induced by six copigments on malvidin-3-O-glucoside (Mv-3-Glu ) and malvidin-3-O-acetylglucoside (Mv-acet-Glu ) was higher than on delphinidin-3-O-glucoside(Dp-3-Glu).The differences of copigments and anthocyanins resulted in different capacity of maintaining the color.Quercetin 3-rhamnoside and caffeic acid helped to maintain the color in anthocyanins solutions during storage.And the degree of maintaining for Mv-3-Glu、Mv-acet-Glu solutions were higher than that for Dp-3-Glu.This indicated that the copigmentation differed by the structures of both copigments and anthocyanins.
monomeric anthocyanins;copigmentation;phenolic compounds;CIELAB color
TS262.6
A
1002-0306(2014)20-0111-06
10.13386/j.issn1002-0306.2014.20.015
2014-02-11
刘婷婷(1988-),女,硕士研究生,研究方向:葡萄酒风味化学。
* 通讯作者:徐岩(1962-),男,博士,教授,研究方向:微生物酿酒科学与酶技术。
国家863计划项目(2013AA102108);山东省泰山学者计划。
