传统豆酱中脂肪酸酯化方法的选择与组成分析
2014-02-27武俊瑞岳喜庆
田 甜,武俊瑞,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
传统豆酱中脂肪酸酯化方法的选择与组成分析
田 甜,武俊瑞,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
为更好地研究传统豆酱中脂肪酸的组成,先用索氏提取法提取豆酱中的脂肪酸,分别利用酸酯化法、碱酯化法和酸碱酯化法对脂肪酸进行甲酯化,正己烷萃取后,采用气相色谱-质谱法检测,根据标准谱库NIST11.L,结合有机质谱学规律对脂肪酸甲酯进行定性分析,并用面积归一化法测定其相对含量。结果表明:衍生化后,脂肪酸甲酯在33 min内完全分离,利用酸酯化法可分析出10 种脂肪酸,其中含量较高的物质有棕榈酸甲酯13.62%、油酸甲酯23.95%、亚油酸甲酯48.91%;利用碱酯化法可分析出4 种脂肪酸,其中含量较高的物质有油酸甲酯10.42%、亚油酸甲酯19.63%;利用酸碱酯化法可分析出10 种脂肪酸,其中含量较高的物质有棕榈酸甲酯13.64%、油酸甲酯24.16%、亚油酸甲酯49.07%。本方法无需标准品 即可快速定性检测豆酱中的脂肪酸,结果准确、可靠。
传统豆酱;脂肪酸;甲酯化;气相色谱-质谱法
东北传统豆酱是以大豆为主要原料,经自然发酵而成的半流动状态的发酵食品,也称黄豆酱、黄酱或大酱[1]。脂肪酸不仅作为豆酱中的营养成分,更是豆酱风味形成的前体物质[2],因此研究豆酱中脂肪酸的种类和数量具有重要意义。
脂肪酸沸点高、极性强,是一种热敏性物质,在高温条件下易发生聚合、脱酸、裂解等副反应,因此,气相色谱分析之前一般都将脂肪酸甲酯化。目前国内外已报道的脂肪酸甲酯化方法有重氮甲烷法、BF3-甲醇法[3]、季铵盐法、酸催化和碱催化法等。但相比之下,重氮甲烷法易 使双键结构发生变化,影响甲酯化率。季铵盐法由于强碱和高温条件,常引起多不饱和脂肪酸发生异构化和降解现象。BF3-甲醇法虽然甲酯化速度快,但试剂昂贵,并且有毒性[4]。因此本实验采用酸酯化法、碱酯化
法和酸碱酯化法对脂肪酸进行甲酯化,意在确定一种安全有效,甲酯化率高的方法。
气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术具有方便、准确、快捷的特点,避免标样对检测结果的限制,有利于新化合物的发现[5],现已成为一种国际通用的油脂脂肪酸测定方法[6],因此运用GC-MS联用技术研究传统豆酱中脂肪酸的组成和数量,可以很好的了解传统豆酱的营养价值。
1 材料与方法
1.1 材料与试剂
传统豆酱 实验室自制。
石油醚、乙醚、乙酸乙酯、硫酸、甲醇、氯化钠、氢氧化钾、盐酸(均为分析纯),正己烷(色谱纯)国药集团化学试剂有限公司;所有实验用水均取自Milli2Q系统。
1.2 仪器与设备
7890A-5975C GC-MS联用仪 美国Agilent公司;XS2002S分析天平 瑞士Mettle-Toledo公司;N1000系列旋转蒸发仪 日本Eyela公司;Milli-Q Synthesis超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 实验室自制传统豆酱工艺
大豆→净化→蒸煮→研碎→制酱块→自然接种、发酵3 个月→水洗、分割→下酱→晒酱→打靶→成熟
豆酱成熟参数:pH 6.13~6.15;总酸0.58~0.60 g/100 mL;水分质量分数68%~73%;氨基酸态氮0.37 ~0.39 g/100 mL;可溶性糖0.31~0.32 g/100 g;粗蛋白质量分数23.05%~23.11%。
1.3.2 豆酱中粗脂肪提取
取豆酱50 g,放入90 ℃烘箱中干燥3 h,然后研磨过80 目筛子得到豆酱干粉。取豆酱干粉8 g装于一个滤纸筒内,置于索氏抽提器中,加入350 mL有机溶剂水浴提取8 h,提取结束后,将提取液加入旋转蒸发器中进行蒸馏,全部溶剂蒸出后即得到豆酱粗油[7]。
1.3.3 脂肪酸甲酯化
1.3.3.1 酸酯化法
取油样0.3 g,加入体积分数3%硫酸-甲醇溶液4 mL,60 ℃ 水浴酯化30 min,冷却后转入100 mL分液漏斗,加入 2 mL正己烷,加入2 mL饱和氯化钠溶液振摇,静置分层后收集有机相于25 mL容量瓶,水相连续用4 mL正己烷萃取2 次,收集有机相并入25 mL容量瓶,正己烷稀释至刻度[8]。
1.3.3.2 碱酯化法
取油样0.3 g,加入0.5 mol/L氢氧化钾-甲醇溶液8 mL,于60 ℃水 浴中皂化20 min至无油,冷却到室温,加2 mL蒸馏水,混合均匀后用2 mol/L的盐酸调节pH值至3~4,用4 mL正己烷萃取,水相连续用4 mL正己烷萃取2 次,收集有机相并入25 mL容量瓶,正己烷稀释至刻度[9]。
1.3.3.3 酸碱酯化法
取油样0.3 g,加入0.5 mol/L氢氧化钾-甲醇溶液8 mL,于60 ℃水浴中皂化20 min至无油,滴加体积分数50%硫酸(以浓硫酸为基准)调pH值至中性,再加入4 mL硫酸-甲醇(12.5%,V/V)溶液,酯化反应30 min,加入5 mL正己烷,振摇,加入2 mL饱和氯化钠溶液盐析,分液漏斗萃取,收集有机相于25 mL容量瓶中,水相用正己烷4 mL萃取2 次,收集有机相并入25 mL容量瓶,正己烷稀释至刻度[10]。
1.3.4 气相色谱条件
石英毛细管柱DB-17MS(30 m×0.25 mm,0.25 μm);升温程序:柱初温60 ℃,保持2 min,以5 ℃/min升到100 ℃,保持1 min,以10 ℃/min升至220 ℃,保持10 min,整个分析过程33 min;载气He,柱流量1.0 mL/min;分流比50∶1;进样口温度250 ℃;进样量1.0 μL。
1.3.5 质谱条件
电子电离源;电子能量70 eV;进样口温度250 ℃;离子源温度230 ℃;传输线温度280 ℃;剂延迟时间5 min;扫描方式:全离子扫描;质量扫描范围m/z 50~550。
1.3.6 脂肪酸甲酯质谱特征
根据脂肪酸甲酯的总离子流图和质谱图对豆酱中的脂肪酸甲酯进行定性分析。根据总离子流图的保留时间确定脂肪酸的分离情况;根据质谱图中基峰离子和分子离子的质荷比确定脂肪酸甲酯的双键数目和碳原子数;根据γ氢迁移、麦氏重排等有机质谱学规律确定脂肪酸甲酯中离子的断裂规律,从而对脂肪酸甲酯进行定性分析。
1.3.7 定性定量分析
用GC-MS进行全离子扫描分析,得GC-MS总离子流图;用化学工作站数据处理系统NIST11.L谱图库进行谱图解析并结合人工分析质谱图,确认其化学成分;用面积归一化法定量计算豆酱中各脂肪酸的相对含量[11]。
2 结果与分析
2.1 脂肪酸甲酯质谱特征
2.1.1 饱和脂肪酸甲酯质谱特征
目前脂肪酸定性一般需要将标准品与样品在相同色谱条件下进样分析,通过与标准脂肪酸甲酯的保留时间进行比较,确定样品中脂肪酸甲酯的组成[12],但这造成
价格昂贵的标准品在不同实验条件下重复使用,因此本实验根据GC-MS标准质谱数据库检索,结合有机质谱学规律对脂肪酸定性,在节约标准品的同时,保证了实验的准确性。
直链饱和脂肪酸的质谱规律较为简单,易于准确识别。根据有机质谱学规律,直链饱和脂肪酸甲酯通过γ氢迁移和麦氏重排,使C2-C3键断裂,γ氢通过六元环过渡态转移到羰基氧而产生碎片离子[CH3-O-C(OH)=CH2]+(m/z 74),该离子为直链饱和脂肪酸甲酯的基峰离子[13-14],其经历置换反应可产生m/z 87离子,并且m/z 87处的质谱峰的相对强度明显高于除基峰外的其他特征离子[12]。一般分子离子峰会出现,并伴有[M-43]+、[M-31]+和[M-29]+等碎片离子[12]。因此运用质谱中基峰,高强度峰和分子离子峰的质荷比可以确定样品中的饱和脂肪酸甲酯。支链饱和脂肪酸甲酯在甲基支链处易发生断裂,产生相差[-CH(OH3)-]的2个较强的碎片离子,离子质荷比相差28,因此可根据28规律判断甲基支链在碳链中所处的位置[15],同时结合分子离子以及麦氏重排离子等特征离子可以准确鉴定支链饱和脂肪酸,见图1。
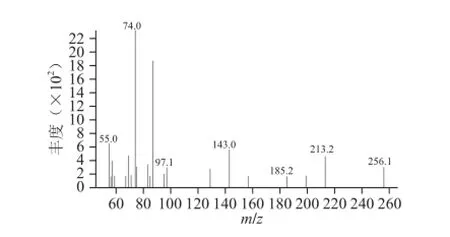
图1 豆酱中9-甲基十四烷酸甲酯质谱图Fig.1 Mass spectrum of 9-methy-tetradecanoic acid methyl esters for soybean paste
如图1所示,脂肪酸甲酯的分子离子质荷比为256,据此可确定脂肪酸的碳原子数目为15,质谱图中存在离子强度较大的离子m/z 185和m/z 213,二者质荷比相差28,如此可得出甲基支链位于脂肪酸的C9上,同时根据基峰离子m/z 74可以确定其为饱和脂肪酸,因此该物质为9-甲基十四烷酸甲酯。
2.1.2 单不饱和脂肪酸甲酯质谱特征
单不饱和脂肪酸的分子离子通过γ氢转移、i诱导断裂产生[M-32]+离子。双键迁移发生α断裂产生C4H7+离子m/z 55,该离子为单不饱和脂肪酸的基峰离子,因此可根据特征离子m/z 55、[M-32]+和分子离子来确定单不饱和脂肪酸的种类[13]。双键位置不同的异构体,质谱图相同,这是因为双键有相似的活动性[12-13],见图2。
如图2所示,脂肪酸甲酯的分子离子质荷比为296,据此可确定脂肪酸的碳原子数目为18,分子离子通过γ氢转移、i诱导断裂产生[M-32]+离子m/z 264,双键迁移发生α断裂产生C4H7+离子m/z 55,由此可知其含有一个不饱和双键,同时根据离子m/z 55、74、97、123、180、222、264、296可以确定其为油酸甲酯。
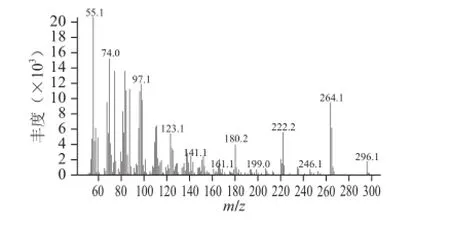
图2 豆酱中油酸甲酯质谱图Fig.2 Mass spectrums of 9-octadecenoic acid methyl esters from soybean paste
2.1.3 双不饱和脂肪酸甲酯质谱特征
双不饱和脂肪酸甲酯的分子离子中羰基发生α断裂,产生[M-31]+,双键迁移进行α断裂产生C5H7+离子m/z 67,由此可得到双不饱和脂肪酸的特征离子为m/z 67、[M-31]+和分子离子[13]。双键位置不同的异构体,质谱图相同,这是因为双键有相似的活动性,见图3。

图3 豆酱中亚油酸甲酯质谱图Fig.3 Mass spectrum of 9,12-octadecadienoic acid methyl esters from soybean paste
由图3可知,脂肪酸甲酯的分子离子质荷比为294,据此可确定脂肪酸的碳原子数目为18,分子离子中羰基发生α断裂产生离子[M-31]+离子m/z 263,基峰离子为67,可确定其含有2 个不饱和双键,同时根据离子m/z 55、67、95、123、263和294可确定其为亚油酸甲酯。
2.1.4 多不饱和脂肪酸甲酯质谱特征
多不饱和脂肪酸甲酯的分子离子中羰基发生α断裂产生[M-31]+离子,双键迁移发生α断裂产生环状C6H7+离子m/z 79[16],此离子为多不饱和脂肪酸的基峰离子,形成此基峰离子的条件为脂肪链中至少有3个且间隔不得大于一个亚甲基的双键[16],因此可得到多不饱和脂肪酸的特征离子为m/z 79、[M-31]+和分子离子M+[17]。双键位置不同的异构体,质谱图相同,这是因为双键有相似的活动性,见图4。

图4 豆酱中亚麻酸甲酯质谱图Fig.4 Mass spectrum of 9,12,15-octadecatrienoicacid methyl esters from soybean paste
由图4可知,脂肪酸的分子离子质荷比为m/z 292,据此可确定脂肪酸的碳原子数目为18,分子离子中的羰基发生α断裂产生离子[M-31]+离子m/z 261,基峰离子为79,可确定其含有3 个不饱和双键,同时根据离子m/z 55、67、79、95、108、121、236、261和292可确定其为亚麻酸甲酯。
2.2 豆酱中脂肪酸酸酯化成分分析
采用酸酯化法对豆酱中的脂肪酸进行甲酯化,在设定条件下进样分析,见图5。

图5 脂肪酸酸酯化法的总离子流图Fig.5 Total ion chromatogram of fatty acids estered by acid from soybean paste
采用人工解析及NIST11.L谱库检索定性的方法对各色谱峰相应的质谱图进行解析,采用面积归一化法计算各成分的相对含量,结果见表1。

表1 豆酱中脂肪酸酸酯化法的组成及含量Table 1 Composition and contents of fat acids estered by acid in soybean paassttee
由表1可知,采用酸酯化法对豆酱中脂肪酸进行甲酯化,共检测到10 种脂肪酸,其中饱和脂肪酸有7 种,分别为9-甲基十四烷酸甲酯、十五酸甲酯、14-甲基十五烷酸甲酯、棕榈酸甲酯、14-甲基十六烷酸甲酯、十七酸甲酯和花生酸甲酯;不饱和脂肪酸有3 种,分别为油酸甲酯、亚油酸甲酯和亚麻酸甲酯。传统豆酱中含有人体所必需的亚油酸和亚麻酸,并且含量较高,占所鉴定出的脂肪酸总量的69.91%。值得注意的是,传统豆酱中含有9-甲基十四烷酸甲酯、14-甲基十六酸甲酯、十五酸甲酯和十七酸甲酯等支链脂肪酸和奇数碳原子脂肪酸。有研究报道称,奇数碳原子脂肪酸有很高的抗癌活性[18-23],这也说明食用自然发酵的豆酱有益于人体健康。
2.3 豆酱中脂肪酸碱酯化成分分析
采用碱酯化法对豆酱中的脂肪酸进行甲酯化,在设定条件下进样分析,见图6。

图6 脂肪酸碱酯化法的总离子流图Fig.6 Total ion chromatorgram of fatty acids estered by alkaline from soybean paste
由于脂肪酸及油脂的沸点高,高温条件下易裂解从而造成损失,因此需要进行甲酯化。碱酯化的目的是通过酯交换反应得到脂肪酸甲酯,但在反应过程中,油脂易与氢氧化钾发生皂化反应得到脂肪酸盐,脂肪酸盐能溶于有机溶剂,在GC-MS分析过程中,由于脂肪酸盐的影响造成脂肪酸总离子流图的基线漂移,因此分析豆酱中的脂肪酸不宜采用碱酯化方法。
采用人工解析及NIST11.L谱库检索定性的方法对各色谱峰相应的质谱图进行解析,采用面积归一化法计算各成分的相对含量,结果见表2。

表2 豆酱中脂肪酸碱酯化法的组成及含量Table 2 Composition and contents of fat acids estered by alkali in soybean paassttee
由表2可知,采用碱酯化法对豆酱中的脂肪酸进行甲酯化,共检测到4 种脂肪酸,其中饱和脂肪酸有1 种,为棕榈酸甲酯;不饱和脂肪酸有3 种,分别为油酸甲酯、亚
油酸甲酯和亚麻酸甲酯。通过与表1比较可知,碱酯化法分析出4 种脂肪酸,而酸酯化法分析出10 种脂肪酸,并且这4 种脂肪酸的数值明显低于酸酯化方法分析出的数值;萃取过程中,碱酯化方法得到的溶液浑浊,不易分层;在同样的质谱条件下,碱酯化法得到的总离子流图基线明显漂移而酸酯化法无此种情况,因此碱酯化法不适合分析豆酱中的脂肪酸。
2.4 豆酱中脂肪酸酸碱酯化成分分析
采用酸碱酯化法对豆酱中的脂肪酸进行甲酯化,在设定条件下进样分析,见图7。

图7 脂肪酸酸碱酯化法的总离子流图Fig.7 Total ion chromatogram of fatty acids estered by acid and alkali from soybean paste
采用人工解析及NIST11.L谱库检索定性的方法对各色谱峰相应的质谱图进行解析,采用面积归一化法计算各成分的相对含量,结果见表3。

表3 豆酱中脂肪酸酸碱酯化法的组成及含量Table 3 Composition and contents of fat acids estered by acid and alkali in soybean paste
由表3可知,采用酸碱酯化法对豆酱中脂肪酸进行甲酯化,共检测到10 种脂肪酸,其中饱和脂肪酸有7 种,分别为9-甲基十四烷酸甲酯、十五酸甲酯、14-甲基十五烷酸甲酯、棕榈酸甲酯、14-甲基十六烷酸甲酯、十七酸甲酯和花生酸甲酯;不饱和脂肪酸有3 种,分别为油酸甲酯、亚油酸甲酯和亚麻酸甲酯。
通过比较表1和表2可知,酸碱酯化法和酸酯化法分别得到10 种脂肪酸而碱酯化法得到4 种脂肪酸,数量上除亚麻酸甲酯的酸碱酯化法得到的数值略低于酸酯化法,其余脂肪酸甲酯的分析数值均大于或等于酸酯化法和碱酯化法;实验操作过程中酸碱酯化法处理后的溶液较酸酯化法处理的溶液更易分层,分离时间短并且效果较好,碱酯化处理的溶液不易分层,静置30 min仍达不到良好的分层效果;在相同的色谱条件下酸碱酯化法和酸酯化法得到的总离子流图基线稳定,分析状态良好,而碱酯化法得到的总离子流图在24 min后发生基线漂移影响分析结果。因此通过综合比较不同甲酯化方法的分析结果可知酸碱酯化法更适合分析豆酱中的脂肪酸。
3 结 论
采用GC-MS法检测,依据标准谱库NIST11.L同时结合有机质谱学规律对豆酱中脂肪酸甲酯进行定性分析。通过基峰可确定脂肪酸的不饱和度:基峰m/z 74为饱和脂肪酸,基峰m/z 55为含1 个双键的不饱和脂肪酸,基峰m/z 67为含2 个双键的不饱和脂肪酸,基峰m/z 79为含3 个双键的不饱和脂肪酸,再通过[M-43]+、[M-32]+、[M-31]+和重排离子进一步确认脂肪酸的种类[24]。本实验采用的定性方法不仅定性准确,同时节省昂贵的脂肪酸标准品在不同的色谱条件下重复使用。
本实验采用酸酯化法、碱酯化法和酸碱酯化法对豆酱中的脂肪酸进行甲酯化,经GC-MS分析,通过比较豆酱油脂在同一色谱条件下的质谱图可以得出:甲酯化方法直接影响脂肪酸的分离效果。酸酯化法和酸碱酯化法分别得到10 种脂肪酸,而碱酯化法得到4 种脂肪酸。酸碱酯化法甲酯化效率高,分析出的脂肪酸数值高于酸酯化法,这说明酸碱酯化法能够对多种脂肪酸进行甲酯化并且甲酯化效率高,这与柴沙驼等[25]采用不同甲酯化方法分析犊牦牛肉中的脂肪酸得到的结果一致,与张述琼等[26]采用不同甲酯化方法分析亚麻种子油的结果一致。酸酯化法适用面广,可分析游离脂肪酸和结合态脂肪酸,但甲酯化程度低[10,27];碱酯化法只适合分析结合态脂肪,但反应条件温和,避免了多不饱和脂肪酸的氧化和异构化[28]。酸碱酯化法结合了酸酯化法和碱酯化法的优点,分析效果最好,因此本实验采用酸碱酯化法分析豆酱中的脂肪酸。
传统豆酱中含有10 种脂肪酸,其中饱和脂肪酸有7 种,分别为9-甲基十四烷酸甲酯、十五酸甲酯、14-甲基十 五烷酸甲酯、棕榈酸甲酯、14-甲基十六烷酸甲酯、十七酸甲酯和花生酸甲酯。不饱和脂肪有3 种,分别为油酸甲酯、亚油酸甲酯和亚麻酸甲酯,其中必需脂肪酸亚油酸和亚麻酸含量占脂肪酸总量的59.76%。另外,传统豆酱中还含有9-甲基十四烷酸甲酯、14-甲基十六酸甲酯、十五酸甲酯和十七酸甲酯等支链脂肪酸和奇数碳原子脂肪酸,有研究报道,支链脂肪酸和奇数碳原子脂肪酸都具有一定的功能性,因此食用传统豆酱有益于人体健康。
[1] 高秀芝, 艾启俊, 仝其根, 等. 传统豆酱和商品豆酱发酵过程中营养及理化指标动态[J]. 中国食品学报, 2013, 13(2): 205-209.
[2] 邓文辉, 赵燕, 李建科, 等. 游离脂肪酸在几种常见食品风味形成中的作用[J]. 食品工业科技, 2012, 33(11): 422-425.
[3] BAUR L A, O’CONNER J, PAN D A, et al. Relationships between the fatty acid composition of muscle and erythrocyte membrane phospholipid in young children and the effect of type of infant feeding[J]. Lipids, 2000, 35(1): 77-78.
[4] 邹晓春, 徐小作, 李行方, 等. 气相色谱法检测人血清中7 种游离脂肪酸的研究[J]. 实用预防医学, 2009, 16(4): 1252-1254.
[5] 李金玉. 利用气相色谱-质谱联用技术测定燕麦中脂肪酸的组成[J].食品与机械, 2011, 27(3): 82-83.
[6] 林少宝, 丘通强, 李征, 等. 几种籽食中脂肪酸组成的研究及探讨[J].现代食品科技, 2007, 23(1): 23-27.
[7] 胡文杰, 陶远胜, 刘胜, 等. 索氏提取法提取东京野茉莉种子油的工艺[J]. 湖北农业科学, 2013, 52(1): 168-170.
[8] 吴春, 曹钰, 蔡国林, 等. 多级溶剂萃取-气相色谱法测定黄酒中的游离脂肪酸[J]. 食品工业科技, 2009, 30(12): 372-375.
[9] 钱宗耀, 刘河疆, 王建梅, 等. 气质联用技术分析测定阿魏菇中脂肪酸[J]. 安徽农业科学, 2011, 39(35): 21751-21752.
[10] 寇秀颖, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47.
[11] 赖毅东, 彭喜春. GC-MS面积归一化法测定食品中的反式脂肪酸[J].现代食品科技, 2009, 25(22): 205-207.
[12] 梁楠楠, 张良晓, 王向利, 等. 质谱特征结合等效链长定性分析植物油中的脂肪酸[J]. 分析化学, 2011, 39(8): 1166-1170.
[13] 吴惠勤, 黄晓兰, 林晓珊, 等. 脂肪酸的色谱保留时间规律与质谱特征研究及其在食品分析中的应用[J]. 分析化学, 2007, 35(7): 998-1003.
[14] 沈宏林, 向能军, 高茜, 等. 枸杞子脂肪酸成分的GC/MS分析[J]. 质谱学报, 2009, 30(2): 99-104.
[15] 楼乔明, 杨文鸽, 徐大伦, 等. 多支链饱和脂肪酸质谱特征及其在海洋动物中的含量分析[J]. 核农学报, 2013, 27(3): 334-339.
[16] HEJAZI L, EBRAHIMI D, GUILHAUS M, et al. Discrimination among geometrical isomers of α-linolenic acid methyl ester using low energy electron ionization mass spectrometry[J]. Journal of the American Society for Mass Spe ctrometry, 2009, 20(7): 1272-1280.
[17] 楼乔明, 王玉明, 刘小芳, 等. 南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J]. 中国水产科学, 2011, 18(4): 929-935.
[18] 许仁博. 脂肪酸的抗癌作用[J]. 粮油食品科技, 1988, 12(3): 441.
[19] 王蕾, 王加启, 刘仕军, 等. 乳脂中奇数和支链脂肪酸的研究进展[J].饲料工业, 2008, 29(6): 48-50.
[20] 陈韬, 葛长荣, 黄启超, 等. 云南3 个地方品种山羊肉脂中脂肪酸的比较[J]. 中国草食动物, 2005, 25(1): 10-11.
[21] 王蕊, 王杰, 杨明, 等. 成都麻羊肉脂中脂肪酸组成特点的研究[J].中国畜牧杂志, 2007, 43(17): 59-67.
[22] VENCL F V, MORTON T C. The shield defense of the sumac fleabeetle, Blepharida rhois (Chrysomelidae: Alticinae)[J]. Chemoecology, 1998, 8(1): 25-32.
[23] ALLEN N E, GRACE P B, GINN A, et al. Phytanic acid: measurement of plasma concentrations by gas-liquid chromatography-mass spectrometry analysis and associations with diet and other plasma fatty acids[J]. British Journal of Nutrition, 2008, 99(3): 653-659.
[24] HAMILTON J T G, CHRISTIE W W. Mechanisms for ion formation during the electron impact-mass spectrometry of picolinyl ester and 4,4-dimethyloxazoline derivatives of fatty acids[J]. Chemistry and Physics of Lipids, 2000, 105(1): 93-104.
[25] 柴沙驼, 侯丽, 崔占鸿, 等. 不同脂肪酸甲酯化法对犊牦牛肉脂肪酸分析的影响[J]. 黑龙江畜牧畜医, 2013, 4(7): 53-55.
[26] 张述琼, 孙毅毅, 赵燕. 亚麻种子油提取工艺及脂肪酸组成的GC-MS分析[J]. 药学服务与研究, 2009, 9(2): 134-136.
[27] 范亚苇, 邓泽元, 余永红, 等. 不同脂肪酸甲酯化方法对共轭亚油酸分析的影响[J]. 中国油脂, 2007, 32(1): 52-55.
[28] 薄海波, 王霞, 翟宗德, 等. 碱催化法衍生化气相色谱/质谱法分析青海湖裸鲤鱼油中的脂肪酸[J]. 色谱, 2006, 24(2): 181-184.
Selection of Optimal Fatty Acid Esterification Method for Analysis of Fatty Acid Composition of Traditional Soybean Paste
TIAN Tian, WU Jun-rui, YUE Xi-qing*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, Chin a)
The fatty acids of traditional soybean paste were extracted by Soxhlet extraction and esterified with acid and/or alkaline, and then the esterified products were analyzed by gas chromatography-mass spectrometry (GC-MS) after extraction with n-hexane, identified by spectral searching using the NIST11.L mass spectral library combined with organic mass spectral data and quantified by peak area normalization. Results showed that complete separation of the fatty acid methyl esters was achieved in 33 minutes after derivatization. Ten kinds of fatty acids were identified by acid esterification, among which the predominant fatty acids were n-hexadecanoic acid methyl ester (13.62%), oleic acid methyl ester (23.95%) and linoleic acid methyl ester (48.91%). Four kinds of fatty acids were identified by alkaline esterification, among which the predominant fatty acids were oleic acid methyl ester (10.42%) and linoleic acid methyl ester (19.63%). Ten kinds of fatty acids were identified by acid-alkaline esterification, among which the predominant fatty acids were n-hexadecanoic acid methyl ester (13.64%), oleic acid methyl ester (24.16%) and linoleic acid methyl ester (49.07%). To conclude, the acidalkaline esterification method allows rapid, accurate and reliable identification of fatty acids in traditional soybean paste without using
tandards.
traditional soybean paste; fatty acid; methylation; gas chromatography-mass spectrometry (GC-MS)
TS264.2
A
1002-6630(2014)18-0078-06
10.7506/spkx1002-6630-201418015
2013-11-28
国家自然科学基金重点项目(31000805);国家高技术研究发展计划(863计划)项目(2011AA100902);辽宁省教育厅科学技术研究项目(L2012249)
田甜(1988—),女,硕士研究生,研究方向为食品生物技术。E-mail:13898164546@163.com
*通信作者:岳喜庆(1966—),男,教授,博士,研究方向为食品科学。E-mail:yxqsyau@126.com
