花椒挥发油的提取工艺优化及抗肿瘤活性分析
2014-02-27韩胜男张晓杭蒋建兰
韩胜男,李 妍,张晓杭,蒋建兰*
(天津大学化工学院,天津 300072)
花椒挥发油的提取工艺优化及抗肿瘤活性分析
韩胜男,李 妍,张晓杭,蒋建兰*
(天津大学化工学院,天津 300072)
采用水蒸气蒸馏法提取花椒中的挥发油,以得油率为评价指标,以料液比、冷浸时间和提取时间为考察因素,通过星点设计-响应面法优选花椒挥发油提取工艺。结果表明:花椒挥发油水蒸气蒸馏提取的最佳工艺条件为料液比1∶12(g/mL)、冷浸时间2.5 h、提取时间4.7 h,得油率可达9.284%。采用MTT法检测花椒挥发油的体外抗肿瘤活性,测得花椒挥发油对HeLa、A549、K562 三种细胞的IC50值分别为(11.2±0.2)、(6.26±0.05)、(1.37±0.03) mg/mL。表明花椒挥发油具有较强的体外抗肿瘤活性,且对3种肿瘤细胞的生长均有抑制作用。
花椒;挥发油;水蒸气蒸馏提取;抗肿瘤
花椒,又称秦椒、川椒或山椒,为芸香科花椒属植物青椒(青花椒)(Zanthoxylum schinifolium Sieb.et Zucc.)或花椒(红花椒)(Zanthoxylum bungeaum Maxim.)的干燥成熟果皮[1],原产于我国,是一种传统的药食两用食物。花椒具有独特浓烈香气,是一种重要的调味品,也可作为香料香精原料[2];同时,花椒性温,归脾、胃、肾经,具有温中散寒、除湿、杀虫、止痛等功效[3-5]。花椒中含有多种化学成分,其主要成分为挥发油。现代研究表明花椒挥发油含有多种活性成分且具有抗菌、杀虫等多种药理活性[6-8],具有广阔的开发应用前景[9-10]。目前,花椒挥发油提取已有微波、超临界等多种方法的研究报道[11-13],关于花椒挥 发油的研究多集中于成分分析以及抗菌、杀虫等药理活性 研究[14-16]。臧林泉等[17]采用SRB方法对花椒挥发油进行抗人A549肺癌杀伤及诱导凋亡试验,结果表明高浓度花椒挥发油对其有杀伤作用,低浓度挥发油对其有诱导凋亡作用。Paik等[18]研究发现花椒挥发油可通过促进活性氧含量杀伤人HepG2肝癌细胞。尽管,近年来研究表明花椒挥发油具有抗肿瘤活性[17-18],但报道尚少。本研究采用水蒸气蒸馏法进行花椒挥发油提取,操作简单方便,节约成本,制 得挥发油杂质含量少,通过星点设计-响应面法对提取条件进行优化,提高挥发油得油率,同时采用MTT法检查挥发油对人宫颈癌HeLa细胞、人肺癌A549细胞和人红白血病K562细胞3 种不同细胞的体外抗肿瘤活性,为花椒挥发油的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
花椒购于安国市新东方药业有限责任公司,产地陕西,剔除枝叶和花椒籽,50 ℃烘干1 h,粉碎过40目筛,备用。
Na2SO4(分析纯) 天津江天化工技术有限公司;RPMI1640培养基、胰蛋白酶、青霉素、链霉素 美国生命技术公司;胎牛血清 北京鼎国生药技术有限责任公司;四甲基偶氮唑盐(MTT)、二甲亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;依托泊苷(批号:09090731) 江苏恒瑞医药股份有限公司;HeLa细胞、A549细胞、K562细胞均由武警医学院生药与药剂学教研室提供。
1.2 仪器与设备
JD100-3电子天平 沈阳龙腾电子有限公司;NAPCO5420-1型CO2培养箱 美国Napco公司;JJT-900/1300型超净工作台 北京半导体设备一厂;Model 680型酶标仪 美国伯乐生命医学公司;Olympus1×70倒置显微镜 日本Olympus公司;Adventurer万分之一电子天平 美国Ohaus公司。
1.3 方法
1.3.1 花椒挥发油提取工艺
准确称取花椒粉末100 g,冷水浸泡一定时间后,转移至2 000 mL圆底烧瓶,加一定量水用挥发油提取器提取一定时间。收集精油部分,缓慢加入适量Na2SO4干燥,除去Na2SO4,得挥发油称质量,按式(1)计算得油率[19]:

1.3.2 最佳提取工艺优化
根据相关文献资料[20-22]及预实验,选取影响提取工艺的主要因素料液比(A)、冷浸时间(B)、提取时间(C)作为考察因素,以花椒挥发油得油率为响应值,进行星点设计-响应面法。因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in response surface analysis
1.3.3 花椒挥发油体外抗肿瘤活性测定
1.3.3.1 样品制备及细胞培养
取最佳提取工艺条件下制备的花椒挥发油适量,加入DMSO溶解,用RPMI1640无血清培养液稀释成250、25、2.5、0.25、0.025 mg/mL;HeLa细胞、A549细胞、K562细胞细胞株分别培养于RPMI1640培养基中,内含体积分数10%的胎牛血清、100 kU/L青霉素、100 mg/L链霉素,置37 ℃、5% CO2培养箱中常规 培养。
1.3.3.2 MTT法检测抗肿瘤活性
采用MTT法,检测花椒挥发油分别对人宫颈癌HeLa细胞、A549肺癌细胞、白血病K562细胞3 种癌细胞的生长抑制作用[23]。取对数生长期的各细胞分别接种于96孔板中,调整细胞密度为4×104个/mL,每孔100 μL,37 ℃、5% CO2培养箱内培养24 h后给药。药物处理组每孔加入不同质量浓度的花椒挥发油溶液100 μL,使终质量浓度分别为125、1 2.5、1.25、0.125、0.0125 mg/mL,另设阳性对照组(加入不同浓度的依托泊苷100 μL)、阴性对照组(加入溶剂100 μL)和空白对照组(加入培养基100 μL)。每组均设4 个复孔。培养48 h后弃去培养液每孔加入MTT溶液(1 mg/mL)50 μL,37 ℃培养4 h,离心弃去上清液,每孔加入150 μL DMSO,轻度振荡10 min。酶标仪测定490 nm波长处各孔光密度(optical density,OD)值,计算药物对细胞的生长抑制率,计算公式为:

样品平行制备2 份,每份样品重复实验3 次。依据待测药物不同剂量下的细胞抑制率,用GraphPad软件计算药物半数抑制质量浓度(IC50)值。
2 结果与分析
2.1 花椒挥发油提取工艺优化
2.1.1 数学回归模型的建立及方差分析

表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
响应面试验设计与结果见表2。利用Design-Expert 8.0.5b软件对试验结果进行回归分析,得到花椒挥
发油得油率与料液比、冷浸时间、提取时间3 个因素之间的编码值回归模型:得油率Y=8.871+0.139A+0.349B+ 0.605C+0.117AB-0.304AC+0.045 8BC-0.518A2-0.382B2-0.433C2。

表3 回归模型方差分析结果Table 3 ANOVA results for the fitted regression model
对拟合的方程进行方差分析,结果见表3。由表3可知,模型P=0.010 5<0.05,表明回归模型显著;失拟项P=0.260 6>0.05,差异不显著,说明未知因素对试验结果干扰小,残差均由随机误差引起;回归方程的相关系数R2=0.800 2,说明模型拟合程度良好。因素C、交互项AC及二次项A2对花椒挥发油得油率有显著影响(P<0.05),其余项不显著,表明各因素对挥发油得油率的影响不是简单的线性关系。
2.1.2 工艺条件优化及预测
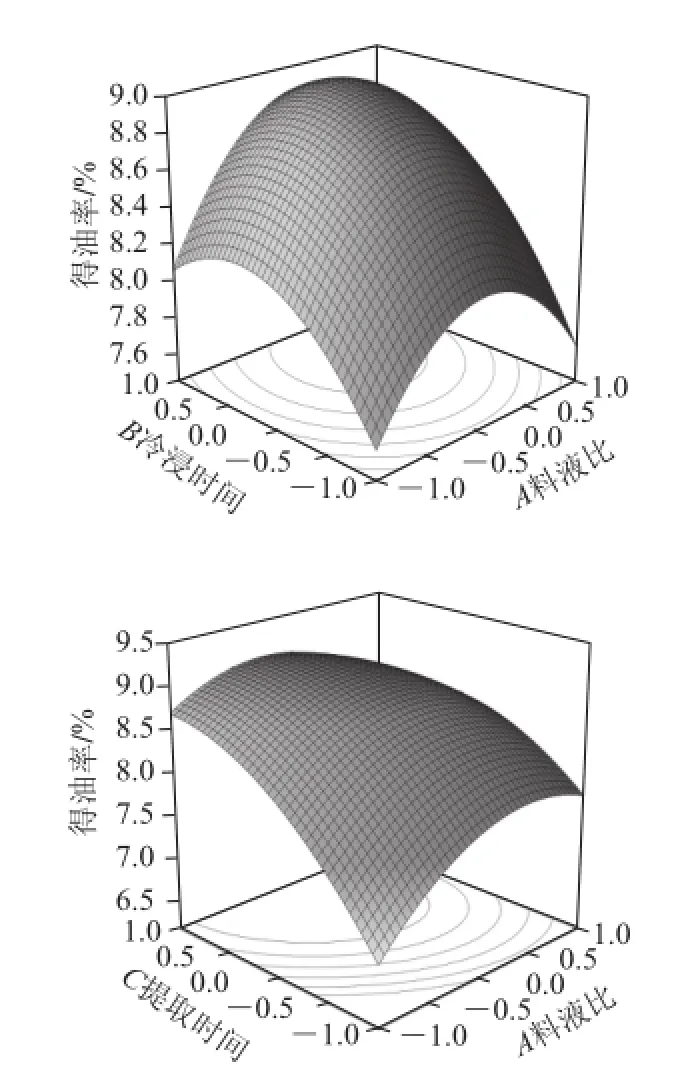

图1 料液比、冷浸时间和提取时间对挥发油得油率的响应面图Fig.1 Response surface plots showing the effects of solid to liquid ratio, soaking time and extraction time on the yield of essential oil
根据回归模型方程,将料液比(A)、冷浸 时间(B)、提取时间(C)对花椒挥发油得油率的影响绘制成响应面图(图1)。由图1可知,提取时间对挥发油得油率影响最显著,表现为曲线最陡,料液比次之,冷浸时间的影响最小。根据回归方程及响应面,得到最佳提取条件:料液比1∶11.95(g/mL)、冷浸时间2.5 h、提取时间4.74 h。考虑到实际操作的方便性,将最佳提取条件修正为料液比1∶12(g/mL)、冷浸时间2.5 h、提取时间4.7 h。在此条件下,平行提取花椒挥发油3 次,得到的实际得油率为9.284%,与理论预测值9.178%接近,说明该回归方程能较真实地反映各因素对花椒挥发油得油率的影响,可用于花椒挥发油提取工艺的优化。
2.2 花椒挥发油体外抗肿瘤活性
花椒挥发油对HeLa细胞、A549细胞和K562细胞的生长均表现出一定的抑制作用。花椒挥发油及阳性对照组对各细胞的IC50值计算结果见表4。本实验采用依托泊苷为阳性对照组,依托泊苷是常用的抗肿瘤药物,现已被广泛应用于癌症的化疗方案。由表4可知,花椒挥发油对K562细胞生长抑制作用较强,对HeLa细胞生长抑制作用相对较弱。与阳性对照组对比可知,花椒挥发油对A549细胞和K562细胞的IC50值偏小、对HeLa细胞的IC50值偏大,表明其对A549细胞和K562细胞的抑制作用略优于阳性对照药物,对HeLa细胞的抑制作用则偏差。总体说明,花椒挥发油具有良好的抗肿瘤作用,且对多种不同肿瘤细胞均有抑制作用。
表4 花椒挥发油对肿瘤细胞的IC50值Table 4 IC50of the essential oil for three cancer cell lines
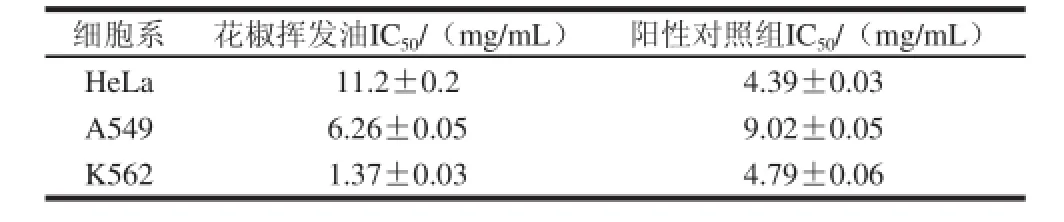
表4 花椒挥发油对肿瘤细胞的IC50值Table 4 IC50of the essential oil for three cancer cell lines
细胞系花椒挥发油IC50/(mg/mL)阳性对照组IC50/(mg/mL)HeLa11.2±0.24.39±0.03 A5496.26±0.059.02±0.05 K5621.37±0.034.79±0.06
3 结 论
影响花椒挥发油提取的因素主要有料液比、冷浸时间、提取时间,通过采用星点设计-响应面法对花椒挥发
油水蒸气提取的工艺条件进行优化,建立了花椒挥发油得油率与料液比、冷浸时间、提取时间之间关系的二次多项式回归方程,该模型准确有效,确定了提取花椒挥发油的最佳工艺条件,即料液比1∶12(g/mL)、冷浸时间2.5 h、提取时间4.7 h,得油率可达9.284%。在体外抗肿瘤活性实验中,采用MTT法检测了花椒挥发油对HeLa细胞、A549细胞和K562细胞的生长抑制活性,结果表明花椒挥发油对这3 种肿瘤细胞的生长均表现出一定的抑制作用,通过与阳性对照药物进行对比,表明花椒挥发油具有良好的体外抗肿瘤作用。本研究为花椒的深入开发利用提供了参考,其抗肿瘤活性成分及作用机制还需进一步探讨。
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010: 149.
[2] 张卫明, 肖正春. 中国辛香料植物资源开发利用[M]. 南京: 东南大学出版社, 2007: 640.
[3] 汤喜兰, 徐国良, 李冰涛, 等. 花椒水提物给药大鼠尿液代谢组学研究[J]. 中国实验方剂学杂志, 2010, 16(5): 127-130.
[4] 张明发, 沈雅琴. 花椒“温中止痛”药理研究[J]. 中国中药杂志, 1991, 16(8): 493-497.
[5] 张明发, 沈雅琴. 花椒温经止痛和温中止泻药理研究[J]. 中药材, 1994, 17(2): 37-40.
[6] 干信, 吴士筠, 高雯琪. 花椒挥发油抑菌作用研究[J]. 食品科学, 2009, 30(21): 128-130.
[7] 王朝晖. 花椒挥发油镇痛作用的实验研究[J]. 中国药房, 2011, 22(3): 218-219.
[8] 聂霄艳, 邓永学, 王进军, 等. 花椒精油和麻素对赤拟谷盗成虫的控制作用[J]. 中国调味品, 2012, 37(3): 6-10.
[9] 赵秀玲. 花椒的化学成分、药理作用及其资源开发的研究进展[J].中国调味品, 2012, 37(3): 1-5.
[10] 邵红军, 程俊侠, 段玉峰. 花椒挥发油化学成分、生物活性及加工利用研究进展[J]. 食品科学, 2013, 34(13): 319-322.
[11] 罗凯, 朱琳, 阚建全. 水蒸气蒸馏、溶剂萃取、同时蒸馏萃取法提取花椒挥发油的效果比较[J]. 食品科技, 2012, 37(10): 234-240.
[12] 邹小兵, 陶进转, 夏之宁, 等. 微波提取对挥发油化学成分的影响[J].分析化学, 2011, 39(1): 142-145.
[13] 霍文兰. 超临界CO2萃取花椒挥发油的研究[J]. 食品科学, 2005, 26(8): 153-156.
[14] 乐薇, 吴世筠, 高欣. 大红袍花椒挥发油的提取及化学成分的GC-MS分析[J]. 食品科学, 2014, 35(2): 261-265.
[15] 唐裕芳, 唐小辉, 张妙玲, 等. 花椒挥发油化学组成及抗菌活性研究[J].湘潭大学自然科学学报, 2013, 35(2): 64-69.
[16] 王步江, 李宁. 花椒精油的制备及其对米象生物活性的影响[J]. 天津农学院学报, 2010, 17(3): 17-20.
[17] 臧林泉, 胡枫, 韦敏. 花椒挥发油抗肿瘤药理作用研究[J]. 蛇志, 2006, 18(3): 183-186.
[18] PAIK S, KOH K, BEAK S, et al. The essential oils from Zanthoxylum schinifolium pericarp induce apoptosis of HepG2 human hepatoma cells through increased production of reactive oxygen species[J]. Biological and Pharmaceutical Bulletin, 2005, 28(5): 802-807.
[19] 赵志峰, 覃哲, 雷绍荣. 三种花椒精油的提取研究[J]. 食品工业科技, 2007, 28(12): 143-147.
[20] 崔红花, 赵英日, 沈志滨, 等. 花椒挥发油的多指标均匀试验数据的提取优化工艺研究[J]. 中成药, 2010, 32(7): 1132-1136.
[21] 石雪萍, 张宇思, 张卫明. 水溶性花椒生物碱及精油同时提取工艺研究[J]. 食品科学, 2009, 30(10): 74-76.
[22] 石雪萍, 张卫明. 花椒挥发油的超临界CO2萃取法与水蒸气蒸馏法提取的比较[J]. 中国野生植物资源, 2009, 28(6): 46-51.
[23] JIANG Jianlan, SU Xin, ZHANG Huan, et al. A novel approach to active compounds identification based on support vector regression model and mean impact value[J]. Chemical Biology and Drug Design, 2013, 81(5): 650-657.
Extraction and Antitumor Activity of Essential Oil from Zanthoxylum bungeanum Seeds
HAN Sheng-nan, LI Yan, ZHANG Xiao-hang, JIANG Jian-lan*
(School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
Response surface methodology was used to optimiz e the steam distillation extraction of essential oil from Zanthoxylum bungeanum seeds. The yield of essential oil was investigated with respect to solid-to-solvent ratio, cold water soaking time and extraction time. The optimum extraction conditions were determined as follows: solid-to-solvent ratio 1:12 (g/mL), cold water soaking time 2.5 h and extraction time 4.7 h, leading to an extraction yield of 9.284%. MTT assay was used to detect the antitumor activity of the essential oil. Its 50% inhibition concentration (IC50) for HeLa, A549 and K562 cells were (11.2±0.2), (6.26±0.05) and (1.37±0.03) mg/mL, respectively, suggesting potent antitumor activity in vitro and inhibitory effect on various cancer cells.
Zanthoxylum bungeanum; essential oil; steam distillation; antitumor activity
R284
A
1002-6630(2014)18-0013-04
10.7506/spkx1002-6630-201418003
2013-12-17
国家自然科学基金青年科学基金项目(81102900)
韩胜男(1989—),女,硕士,研究方向为中药现代化工程。E-mail:lingnanshengxue@163.com
*通信作者:蒋建兰(1972—),女,副教授,博士,研究方向为中药现代化工程。E-mail:jljiang@tju.edu.cn
