CYP2C9和CYP2C19基因多态性对药物代谢的影响及个体化用药研究进展
2014-02-27蔡泓敏冯端浩赵冠人解放军309医院药剂科北京0009北京市垂杨柳医院药学中心北京000
陈 珲,蔡泓敏,冯端浩,赵冠人(.解放军309医院药剂科,北京 0009;.北京市垂杨柳医院药学中心,北京 000)
CYP2C9和CYP2C19基因多态性对药物代谢的影响及个体化用药研究进展
陈 珲1,蔡泓敏2,冯端浩1,赵冠人1(1.解放军309医院药剂科,北京 100091;2.北京市垂杨柳医院药学中心,北京 100021)
CYP2C9、CYP2C19酶是细胞色素P450系统中重要的药物代谢酶,共同参与许多重要药物的体内代谢。CYP2C9、CYP2C19基因具有高度多态性,在基因编码区和非编码区存在许多碱基突变,这种突变会影响酶的活性,导致酶底物药物清除率改变,从而导致药品不良反应的发生。本文对CYP2C9、CYP2C19基因突变的发生频率及对药物代谢的影响做详细阐述。
CYP2C9;CYP2C19;基因多态性
细胞色素P450是存在于肝脏中混合功能氧化酶系(mixed function oxidase system,MFSO)的主要成分,对许多内源、外源性化合物在体内的Ⅰ相生物转化有重要作用,其活性的强弱决定药物代谢速率的快慢。CYP2C19和CYP2C9作为CYP450家族中的重要药物代谢酶,可影响到许多重要临床应用药物的代谢,如CYP2C9影响苯妥英钠、华法林、甲苯磺丁脲和许多非甾体类抗炎药等药物的代谢,CYP2C19影响奥美拉唑、地西泮、苯妥英钠、普萘洛尔等药物的代谢,而其基因多态性是引起个体对同一药物表现不同药效的重要原因之一。本文对CYP2C9和CYP2C19基因多态性及对药物代谢的影响进行概述。
1 CYP2C9的基因多态性
CYP2C9基因位于人染色体10q24.2,全长约50.71 kb,有9个外显子和8个内含子。迄今已发现CYP2C9存在CYP2C9*2 ~ CYP2C9*35多种突变等位基因,以野生型CYP2C9*1和突变型CYP2C9*2和CYP2C9*3最为常见,其他突变型除CYP2C9*13外,其他均只在单一民族中发现,相关研究较少,目前研究最多的是CYP2C9*2和CYP2C9*3。CYP2C9*2突变是3号外显子上发生C430 > T的突变,造成Arg144>Cys144氨基酸置换,CYP2C9*3是在7号外显子上发生A1075 > C突变,造成Ile359> Leu359氨基酸置换。不同人群CYP2C9*2和CYP2C9*3基因突变频率不同,且差异明显,如白种人突变发生率高于黄种人和黑种人,其在不同人种和不同民族间的频率见表1。
2 CYP2C19基因多态性
CYP2C19酶又称S-美芬妥英羟化酶,存在于肝微粒体中,位于染色体10q24,由490个氨基酸组成,分子量为55.933 kd,包含9个外显子和5个内含子。CYP2C19除了野生型等位基因CYP2C19*1外,存在CYP2C19*2 ~ CYP2C19*28等多种突变等位基因,其中CYP2C19*2和CYP2C19*3为CYP2C19基因的主要突变体。CYP2C19*2是由于外显子5第681位碱基发生G > A突变,形成一个异常剪切位点,使得在转录时外显子5起始端丢失40个碱基对,从而在核糖体翻译时丢失了第215 ~ 227位氨基酸,导致第215位氨基酸起始阅读框架发生移动,由此在第215位氨基酸下游第20个氨基酸处提前产生1个终止密码子,使得蛋白质合成过早被终止,导致这一段的蛋白质丧失了催化活性;CYP2C19*3是由于外显子4第636位碱基发生G > A突变,提前产生的终止密码子使得蛋白合成也提前终止,最终导致酶催化活性降低。
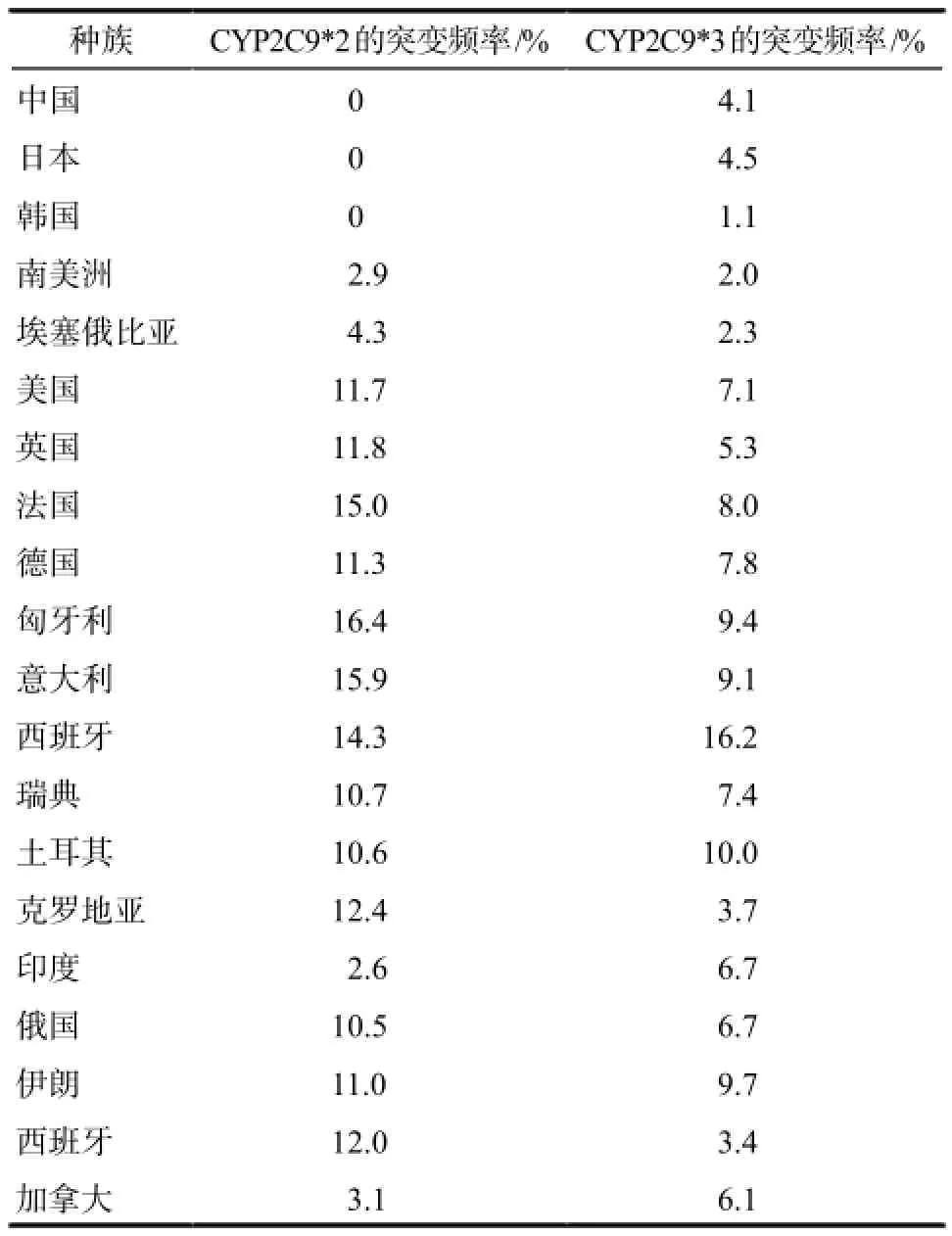
表1 CYP2C9*2和CYP2C9*3等位基因在不同人群中的分布Tab 1 Distribution of CYP2C9*2 and CYP2C9*3 allele in different populations
CYP2C19基因多态性分布具有明显的种族和地域差异。白种人慢代谢基因型(poor metabolizer,PM)发生率为3% ~ 5%,沙特阿拉伯人PM发生率与之很接近,黑人PM发生率介于白种人与东方人之间,而东方人PM发生率为13% ~ 23%[1]。CYP2C19*2慢代谢基因型在非洲人中约占15%,在亚洲人群中约占29% ~ 35%[2]。日本人群CYP2C19*3发生突变的频率高于中国人群[3]。在阿拉伯人中CYP2C19*2杂合子突变的频率为8.2%,CYP2C19*3的突变频率为0%,而在调查的192个人中46%为CYP2C19*17突变型,包括37.5%的突变杂合子和8.1%的突变纯合子[4]。而埃及人中CYP2C19*2突变频率为3.8%[5]。在中国人(汉族、白族、侗族、傣族)中,中国傣族人群PM发生率显著低于其他民族[6]。
3 CYP2C9和CYP2C19基因多态性与个体化治疗
CYP2C9参与人体内多种药物的代谢,临床使用的药物大约16%通过其代谢。包括抗糖尿病药甲苯磺丁脲、格列本脲、格列美脲;抗惊厥药苯妥英;抗凝血药华法林、双香豆素、硝苄香豆素、苯丙香豆素;抗高血压药氯沙坦、厄贝沙坦;利尿药托拉塞米;抗抑郁药阿米替林、氟西汀;抗菌药磺胺甲基异唑;性激素孕酮、睾丸酮;众多非类固醇类抗炎药,如依布洛芬、苯洛芬、氟比洛芬、吡罗昔康、替罗昔康;抗肿瘤药环磷酰胺、异环磷酰胺等[7]。
CYP2C19参与几十种药物代谢,并对其临床应用产生明显影响,包括抗癫痫药:S-美芬妥英、苯巴比妥、丙戊酸;质子泵抑制剂:奥美拉唑、雷贝拉唑;抗抑郁药:丙咪嗪、氯丙咪嗪、阿米替林、西酞普兰;镇静催眠药:地西泮、去甲地西泮;抗疟疾药:氯胍、氯二胍;降糖药:甲苯磺丁脲;抗真菌药:伏立康唑;抗肿瘤药:环磷酰胺、异环磷酰胺等。
个体化治疗是一种基于个体药物遗传学和药物基因组学信息,根据特定人群、特定个体的病情、病因以及遗传基因信息提供针对性治疗和最佳处方用药的新型疗法。CYP2C9和CYP2C19基因是P450家族中两个非常重要的成员,有许多药物的代谢受这两种基因共同影响,在临床应用这些药物时需考虑两种基因的多态性,以预防不良反应的发生。
3.1 CYP2C9和CYP2C19基因多态性对甲苯磺丁脲的影响
甲苯磺丁脲是临床常用的磺脲类降血糖药物,其治疗指数低、安全范围较窄,在人体内甲基羟基化形成羟基甲苯磺丁脲,随后由醇和醛脱氢酶氧化羟基甲苯磺丁脲为羧基甲苯磺丁脲。对CYP2C9*2、CYP2C9*3两种突变体的功能研究表明,这两种突变体cDNA在不同的重组表达体系中表达时,Ile359Leu突变可显著降低甲苯磺丁脲的代谢率[8]。李明等[9]对甲苯磺丁脲在体内的研究表明,CYP2C9*3纯合子携带者的药物清除率显著低于CYP2C9*1纯合子个体携带者。CYP2C9*3纯合子对甲苯磺丁脲的清除率比野生型纯合子低25%,CYP2C9*2/*3杂合子显示中等程度的清除率。一些抑制甲苯磺丁脲在肝内代谢的药物可增强其降血糖作用,如氯霉素、华法林、保泰松等,而糖皮质激素、巴比妥类、氯丙嗪等则可降低其降血糖作用。这些药物几乎都是通过对CYP2C9的作用来影响甲苯磺丁脲代谢。甲苯磺丁脲在体内主要是经CYP2C9酶甲基羟化代谢,但Wester等[10]对甲苯磺丁脲的代谢研究表明,大约14% ~ 22%经CYP2C19羟化代谢,尽管在肝微粒体中CYP2C19的表达量比CYP2C9少,但当遇到CYP2C9弱代谢者时,CYP2C19对甲苯磺丁脲的代谢还是具有重要的作用。
3.2 CYP2C9和CYP2C19基因多态性对苯妥英钠的影响
苯妥英钠是有效的抗癫痫药物,其疗效和副作用存在显著的个体差异,目前研究发现药物代谢酶的基因多态性是导致苯妥英钠个体差异的重要因素。CYP2C9和CYP2C19是苯妥英钠的主要代谢酶,其基因多态性与癫痫病患者苯妥英钠诱导的神经毒性风险密切相关[11]。Hung等[12]运用群体药代动力学的方法,建立了不同的CYP2C9和CYP2C19基因型服用苯妥英钠的推荐剂量。通过对中国汉族癫痫患者细胞色素CYP2C9和CYP2C19基因多态性对苯妥英钠血药浓度影响的研究发现:CYP2C9和CYP2C19基因突变导致苯妥英钠的血药浓度升高[13],强代谢基因型组有95.5%的患者血药浓度小于最低有效浓度,弱代谢基因型组有23.1%达到最小中毒浓度,CYP2C9和CYP2C19基因的分型在临床评估苯妥英钠的毒性时有重要的作用。因此在临床用药中,应根据药物基因组学的原理和方法指导临床用药,弱代谢者给予较小剂量,强代谢者给予较大剂量,从而有效避免不良反应的发生。
3.3 CYP2C9和CYP2C19基因多态性对苯巴比妥的影响
苯巴比妥大部分通过细胞色素P450同工酶的芳香羟化作用形成对羟基-苯巴比妥,此代谢过程中CYP2C9与CYP2C19发挥着重要作用[14]。Mamiya等[15]在将CYP2C19基因多态性引入群体药代动力学中,应用NOMMEN推算出CYP2C19慢代谢型患者苯巴比妥的清除率较快代谢型患者低18.8%。而最近一项在日本人群的研究显示,CYP2C9、CYP2C19基因型对苯巴比妥的清除率并没有影响,而CYP2C9*1/*3基因型患者苯巴比妥的清除率比CYP2C9*1/*1基因型患者低48%[16]。齐明山等[17]通过对宁夏地区回、汉族185例癫痫患者CYP2C19和CYP2C9基因多态性与苯巴比妥血药浓度关系的研究发现:苯巴比妥的血药浓度在CYP2C19和CYP2C9变异基因携带者中增高。对于CYP2C19和CYP2C9突变等位基因携带者应该减少药物剂量,尽可能减少和避免药品不良反应的发生。因此,将影响药物代谢的CYP2C9和CYP2C19同时引入群体药代动力学中进行研究有重要的意义。
3.4 CYP2C9和CYP2C19基因多态性对丙戊酸的影响
丙戊酸是对多种癫痫发作类型均有效的一线抗癫痫药物,其体内药代动力学过程复杂,药物代谢的个体差异大。CYP2C9和CYP2C19是丙戊酸的主要代谢酶,其活性的不同是导致丙戊酸血药浓度个体差异的重要原因。丙戊酸的血药浓度在突变基因携带者中明显增高[18],同时测定CYP2C9和CYP2C19基因型与单纯通过CYP2C9和CYP2C19基因相比,前者更能预测患者服药后的血药浓度变化,二者同时突变会使丙戊酸的代谢能力明显下降[19]。因此,应依据基因型对患者在使用丙戊酸时个体化给药,既可保证药效的发挥,又可减少慢代谢基因型携带者服药后因药物浓度过高而产生毒性的可能性,尤其是对于CYP2C9和CYP2C19同时发生突变的患者。
3.5 CYP2C9和CYP2C19基因多态性对氟西汀的影响
氟西汀是一种强效的选择性5-羟色胺重摄取抑制剂,是临床上用于抑郁症以及强迫观念与行为疾病治疗的首选药物。氟西汀主要由肝脏经细胞色素P450酶氧化代谢。Liu等[20]研究发现:CYP2C9在生理性底物浓度下是催化人肝微粒体中氟西汀N-去甲基代谢的主要CYP酶,高底物浓度时作用不大;而在高底物浓度时(相当于临床治疗剂量下),以CYP2C19的作用为主,且氟西汀N-去甲基酶的活性与CYP2C19基因型显著相关。由于氟西汀的去甲基代谢主要经CYP2C9和CYP2C19催化,因此当具有CYP2C9或CYP2C19酶诱导或酶抑制的药物与氟西汀联合用药时,这些药物可以通过影响氟西汀的氧化代谢而改变氟西汀在人体内的药代动力学及疗效。
3.6 CYP2C9和CYP2C19基因多态性对氯吡格雷的影响
氯吡格雷是前体药物,本身没有活性,需经过肝脏细胞色素酶P450系统代谢成为有活性药物,才能发挥抗血小板作用。现已发现参与氯吡格雷代谢的主要细胞色素酶包括:CYP1A2、CYP2B6、CYP2C9、CYP2C19、CYP3A等,其中CYP1A2、CYP2B6、CYP2C19参与氯吡格雷第一阶段转化,CYP2C9、CYP2C19、CYP2B6、CYP3A参与第二阶段转化。目前对CYP2C19基因多态性的研究较多,CYP2C19酶蛋白在氯吡格雷的代谢活化中起重要作用。在TRITON-TIMI试验中,携带有功能缺失的CYP2C19等位基因且接受氯吡格雷治疗组较无携带者发生心肌梗死、卒中等心血管事件的可能性增加53%,同时也是支架内血栓的危险因素(分别为2.6%、0.8%)[21]。对中国人群的研究表明CYP2C19影响氯吡格雷在体内的代谢[22]。同时,有学者通过测定24例健康男性受试者单剂量空腹口服氯吡格雷药前及药后血小板聚集率,研究CYP2C9、CYP2C19基因型对口服氯吡格雷后药效动力学的影响[23],结果表明在仅存在CYP2C9变异的情况下,Emax和AUC相对于野生型有显著下降趋势,Kim[24]和Brandt[25]等的研究也得到同样的结果。
3.7 CYP2C9和CYP2C19基因多态性对伏立康唑的影响
伏立康唑是一种广谱的三唑类抗真菌药物,主要用于治疗免疫缺陷患者中进行性的、可能威胁生命的感染。伏立康唑通过肝脏细胞色素P450同工酶CYP2C19、CYP2C9和CYP3A4代谢,同时也是这3种酶的抑制剂。CYP2C19是主要的代谢酶,其基因多态性可引起患者在服用伏立康唑后清除率发生改变[26]。在相同剂量下,杂合子快代谢者与慢代谢者的血药浓度较纯合子快代谢者高,半衰期延长,清除率下降,AUC增大。在中国人群中,CYP2C19突变型发生率较高,不良反应的发生率也较大。因此,应根据CYP2C19的遗传变异,制定伏立康唑深部真菌感染的个体化药物治疗方案。
4 展望
综上所述,CYP2C9和CYP2C19是P450家族中两个非常重要的成员,其等位基因的分布频率在不同种族中有较大的差异,药物代谢酶的多态性是药物作用个体差异的分子基础,它可以改变药物的药代动力学,导致药效的增强或降低,或毒副作用的增加。由此引发的药品不良反应和药物相互作用呈现出个体及药物疗效的差异。如果药物的治疗范围窄,药物代谢多态性就会引发严重的临床后果。CYP2C9和CYP2C19基因多态性的研究,将促进临床治疗用药的合理化,同时在某些疾病的发病机理研究和预防治疗中也将发挥作用。因此,研究人类细胞色素P450酶系统氧化代谢多态性的遗传分子机制,不仅具有深远的理论意义,还具有重要的临床实践价值。
[1]严非,夏春华,熊玉卿.CYP2C19基因多态性对药物代谢的影响及其个体化用药[J].中国临床药理学与治疗学,2010,15(8):949-953.
[2]Hulot JS, Hajjar R, Montalescot G. Clopidogrel and CYP2C19 testing: ready for clinical prime time[J]. Clin Chem, 2012, 58(1): 154-157.
[3]Shimizu T, Ochiai H, Asell F, et al. Bioinformatics research on inter-racial difference in drug metabolism I. Analysis on frequencies of mutant alleles and poor metabolizers on CYP2D6 and CYP2C19[J]. Drug Metab Pharmacokinet, 2003, 18(1): 48-70.
[4]Al-Jenoobi FI, Alkharfy KM, Alghamdi AM, et al. CYP2C19 genetic polymorphism in Saudi Arabians[J]. Basic Clin Pharmacol Toxicol, 2013, 112(1): 50-54.
[5]Ellison CA, Abou El-Ella SS, Tawfik M, et al. Allele and genotype frequencies of CYP2B6 and CYP2C19 polymorphisms in Egyptian agricultural workers[J]. J Toxicol Environ Health A, 2012, 75(4): 232-241.
[6]何楠,周宏灏.CYP2C19遗传多态性的研究进展[J].生理科学进展,2003,34(2):171-174.
[7]Schwarz UI. Clinical relevance of genetic polymorphisms in the human CYP2C9 gene[J]. Eur J Clin Invest, 2003, 33(Suppl 2): 23-30.
[8]Arvanitidis K, Rgia G, Iordanidou M, et al. Genetic polymorphisms of drug-metabolizing enzymes CYP2D6, CYP2C9, CYP2C19 and CYP3A5 in the Greek population[J]. Fundam Clin Pharmacol, 2007, 21(4): 419-426.
[9]李明,尹丽敏.浙江沿海汉族人群CYP2C9基因多态性与甲苯磺丁脲代谢活动的关系[J].中国药物与临床,2010,10(2):140-143.
[10]Wester MR, Lasker JM, Johnson EF, et al. CYP2C19 participates in tolbutamide hydroxylation by human liver microsomes[J]. Drug Metab Dispos, 2000, 28(3): 354-359.
[11]Kesavan R, Narayan SK, Adithan C. Influence of CYP2C9 and CYP2C19 genetic polymorphisms on phenytoin-induced neurological toxicity in Indian epileptic patients[J]. Eur J Clin Pharmacol, 2010, 66(7): 689-696.
[12]Hung CC, Lin CJ, Chen CC, et al. Dosage recommendation of phenytion for patients with epilepsy with different CYP2C9/ CYP2C19 polymorphisms[J]. Ther Drug Monit, 2004, 26(5): 534-540.
[13]任夏洋,王旭,徐欣,等.中国汉族癫痫患者CYP2C19和CYP2C9基因多态性对苯妥英钠血药浓度的影响[J].中国临床药理学杂志,2011,27(4):249-251,264.
[14]Hargraves JA, Howald WN, Racha JK, et al. Identification of enzymes responsible for the metabolism of phenobarbital[J]. Int Soc Stud Xenobiot Proc, 1996, 10: 259.
[15]Mamiya K, Hadama A, Yukawa E, et al. CYP2C19 polymorphism effect on phenobarbitone[J]. Eur J Clin Pharmacol, 2000, 55(11): 821-825.
[16]Goto S, Seo T, Murata T, et al. Population estimation of the effect of cytchrome P450 2C9 and 2C19 polymorphisms on phenobarbital clearance in Japanese[J]. Ther Drug Monit, 2007, 29(1): 118-121.
[17]齐明山,顾浩,董通,等.回、汉族癫痫患者CYP2C19和CYP2C9基因多态性与苯巴比妥血药浓度的相关性研究[J].中风与神经疾病杂志,2011,28(9):776-780.
[18]谭喜莹,张宇,王淑云,等.CYP2C9与CYP2C19基因多态性与癫痫患者丙戊酸血药浓度关系研究[J].药学与临床研究,2011,19(2):123-126.
[19]白向荣,姜德春,王育琴,等.中国人群癫痫患者CYP2C9、CYP2C19的基因型对丙戊酸钠清除率影响的研究[J].中国临床药理学与治疗学,2007,12(12):1405-1409.
[20]Liu ZQ, Shu Y, Huang SL, et al. Effect of CYP2C19 genetype and CYP2C9 on fluoxetine N-demethylation in human liver microsomes[J]. Acta Pharmacol Sin, 2001, 22(1): 85-90.
[21]Mega JL, Close SL, Wiviott SD, et al. Cytochrome P-450 polymorphisms and response to clopidogrel[J]. N Engl J Med, 2009, 360(4): 354-362.
[22]Kelly RP, Close SL, Farid NA, et al. Pharmacokinetics and pharmacodynamics following maintenance doses of prasugrel and clopidogrel in Chinese carriers of CYP2C19 variants[J]. Br J Clin Pharmacol, 2012, 73(1): 93-105.
[23]蒋娟娟,田蕾,韩璐璐,等.CYP2C9和CYP2C19基因多态性对健康中国人口服氯吡格雷后药效动力学的影响[J].中国新药杂志,2011,20(13):1217-1221.
[24]Kim KA, Park PW, Hong SJ, et al. The effect of CYP2C19 polymorphism on the pharmacokinetics and pharmacodynamics of clopidogrel: a possible mechanism for clopidogrel resistance[J]. Clin Pharmacol Ther, 2008, 84(2): 236-242.
[25]Brandt JT, Close SL, Iturria SJ, et al. Common polymorphisms of CYP2C19 and CYP2C9 affect the pharmacokinetic and pharmacodynamic response to clopidogrel but not prasugrel[J]. J Thromb Haemost, 2007, 5(12): 2429-2436.
[26]Weiss J, Ten Hoevel MM, Burhenne J, et al. CYP2C19 genotype is a major factor contributing to the highly variable pharmacokinetics of voriconazole[J]. J Clin Pharmacol, 2009, 49(2): 196-204.
The progress of CYP2C9 and CYP2C19 genetic polymorphisms on drug metabolism and individualized drug therapy
CHEN Hui1, CAI Hong-min2, FENG Duan-hao1, ZHAO Guan-ren1(1. Department of Pharmacy, 309th Hospital of PLA, Beijing 100091, China; 2. Pharmacy Center, Beijing Chuiyangliu Hospital, Beijing 100021, China)
CYP2C9 and CYP2C19 enzymes are important drug-metabolizing enzymes involving in the metabolism of a variety of drugs in vivo. CYP2C9 and CYP2C19 genes are highly polymorphic. There are many mutations at the genetic coding and non-coding area. Functional mutations may alter the activity and elimination rate of substance drugs which might lead to drug adverse effects or toxicity. The CYP2C9, CYP2C19 gene mutation frequency and their impact on drug metabolism were reviewed.
CYP2C9; CYP2C19; Genetic polymorphism
R97;Q34
A
1672 – 8157(2014)04 – 0240 – 05
2013-11-09
2014-04-19)
解放军309医院课题项目(2013MS-020)
赵冠人,男,副主任药师,主要从事临床药学工作。E-mail:yanliqun79@163.com
陈珲,女,主管药师,主要从事临床药学工作。E-mail:helena_lucky@126.com
