离子交换分离-石墨炉原子吸收光谱法测定高纯铟中痕量铜
2014-02-26吴文启谢晓雁苏信宇梁晓明卢金荣
吴文启 李 奋 谢晓雁 苏信宇 梁晓明 卢金荣
(1柳州出入境检验检疫局, 广西 柳州 545006; 2 中国检验认证集团 柳州分公司,广西 柳州 545006)
0 前言
铟是稀有金属。通常将含量超过99.999%的铟称为高纯铟,其是重要的半导体材料。高纯铟的纯度影响产品的性能和价格。因此,研究高纯铟中杂质元素的准确测定方法是有意义的。我国行业标准[1]规定In-06牌号高纯铟中铜的限量为0.1 μg/g。测定铟中铜的方法有异丙醚萃取分离-脉冲极谱溶出法[2]、萃淋树脂分离-电感耦合等离子体质谱法(ICP-MS)[3-4]、固体进样-辉光放电质谱法(GD-MS)[5]等,他们各自测定了含量分别为0.2,4,0.029 μg/g的铜;覃祚明[6]、冯先进[7]则采用ICP-MS直接测定高纯铟中的铜,检出限(3s)为0.15 μg/g和0.05 μg/g。由此可见,目前仅质谱类仪器可测定In-06牌号高纯铟中的铜。
先把高纯铟中痕量待测杂质元素分离出来再行测定是降低其检出限的有效办法[8-10]。实验用离子交换法分离铜,而后用石墨炉原子吸收光谱法(GFAAS)进行测定。对分离和测定的影响因素进行了条件实验,建立了适宜的方法;不必使用昂贵的设备、仅用常见的器具和试剂,便捷地实现了高纯铟中铜的分离和测定。本法测定下限为0.001 μg/g,比行业标准方法YS/T 230.1—2011的0.1 μg/g低两个数量级。
1 实验部分
1.1 仪器及工作条件
原子吸收光谱仪(日本岛津,AA-6300)。仪器工作条件为:波长324.8 nm,狭缝宽度0.7 nm,灯电流3 mA,干燥温度140 ℃;斜坡升温时间8 s,保持时间15 s;灰化温度800 ℃;原子化温度2 300 ℃,保持时间2 s(此阶段停气);清除温度2 500 ℃,保持时间2 s;进样量2~50 μL。
采用内径为9.8 mm、上部为筒形漏斗状的层析柱作为离子交换柱。装入树脂层高为160 mm,层体积约为12 cm3;001×7(732)强酸性阳离子交换树脂:磨碎过筛,取过0.13~0.20 mm筛孔者,用6 mol/L 盐酸浸泡48 h,水漂洗至中性,取适量装柱,备用。
1.2 主要试剂
Cu标准储备溶液(1 000 μg/mL,国家钢铁材料测试中心),使用时用盐酸(0.05 mol/L)逐级稀释成0.1 μg/mL的标准工作溶液。
盐酸为优质纯,并经纯化。
实验用水均为二次去离子水。
1.3 实验方法
称取1 g样品(精确至0.000 2 g)于80 mL烧杯中,加入8 mL浓盐酸,低温加热至样品溶解完全,蒸发至近干。用洗瓶以少量水吹洗烧杯壁,再加热至近干。用约5 mL水溶解盐类,取下冷却。将试液过离子交换柱进行离子交换分离,将液体过柱流速调整为1.5~2 mL/min;用少量盐酸(0.05 mol/L)分次滴洗烧杯并将滴洗液过树脂柱。之后,用100 mL盐酸(0.6 mol/L)淋洗液淋洗树脂柱,收集洗出液并转移至铟回收储瓶中;接着用30 mL盐酸(2.0 mol/L)继续淋洗树脂,收集于100 mL烧杯中。将收集液置于电热板上加热,蒸发至约0.2 mL;用水吹洗杯壁,再蒸发至近干;滴加少许盐酸(0.01 mol/L)溶解盐类,用滴管把溶液移入10 mL分刻度具塞试管中。以盐酸(0.01 mol/L)冲洗烧杯,洗液并入试管;最后以盐酸(0.01 mol/L)稀释至适当刻度,混匀,上机测定。用标准曲线法定量。
于一组50 mL容量瓶中分别加入适量的Cu标准工作溶液,用盐酸(0.05 mol/L)稀释至刻度,混匀,制成标准系列工作溶液。
2 结果与讨论
2.1 溶样方法的选择
强酸均可溶解高纯铟。但是,以硝酸或硫酸为淋洗液时铟在阳离子交换树脂上的吸附力大于盐酸,不利于从铟中把铜分离出来。为了减少试样溶解后的蒸发时间同时避免可能多引入污染物,实验选用8 mL盐酸溶解1 g铟试样。
2.2 离子交换条件的选择
2.2.1 上柱液酸度
把铜溶液移至柱上后用盐酸(0.6 mol/L)淋洗,淋洗至150 mL后铜才出柱,因此上柱液中盐酸的浓度只要≤0.6 mol/L都是可行的。实验选取水为上柱液。自然,当pH>4时,溶液中的铟会水解而产生沉淀。当发现有沉淀生成时,要加少量稀盐酸以使之溶解。
2.2.2 淋洗液酸度
配制含铟为1 g,含铜5 μg的溶液过柱,选用盐酸(0.6 mol/L)洗出铟、用盐酸(2.0 mol/L)洗脱铜,结果见图1。
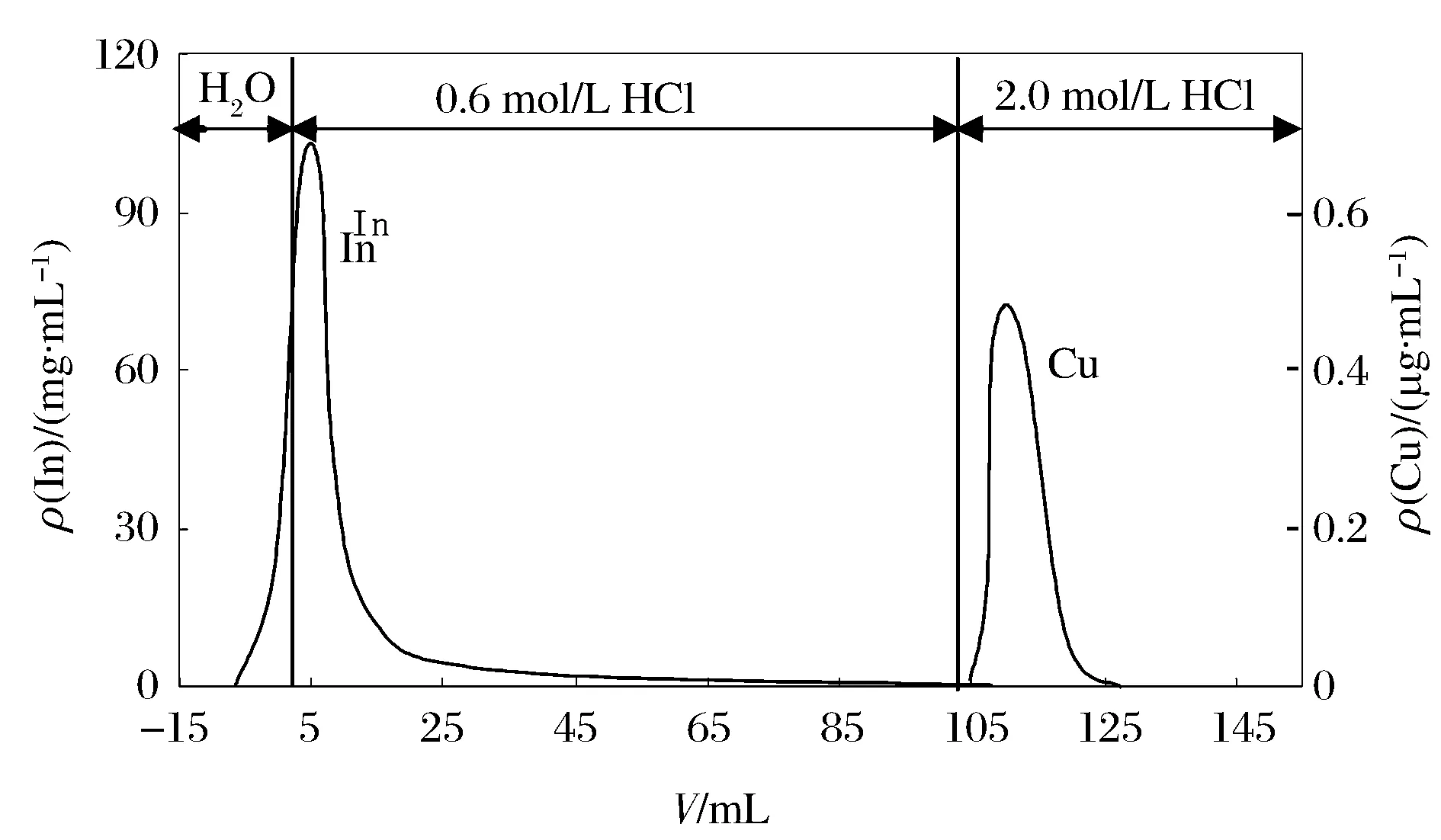
图1 In和Cu的淋洗曲线 Figure 1 Elution curves of In and Cu.
淋洗液的酸度对铟、铜出柱的影响见图2。盐酸浓度为0.7,0.8 mol/L时,铜与铟曲线相交较多,分离程度低。酸度为0.6 mol/L时,铜于150 mL后出柱,与铟可有效分离。实验选用盐酸(0.6 mol/L)洗出铟。实验结果还显示:铟出柱略有拖尾,用100 mL盐酸(0.6 mol/L)淋洗后,在其后面30 mL的洗脱液中仍可检测到铟的存在,洗脱总量为7~10 μg。多用淋洗剂可减少铟的滞留量,但微量的铟不足以影响GFAAS测定铜。
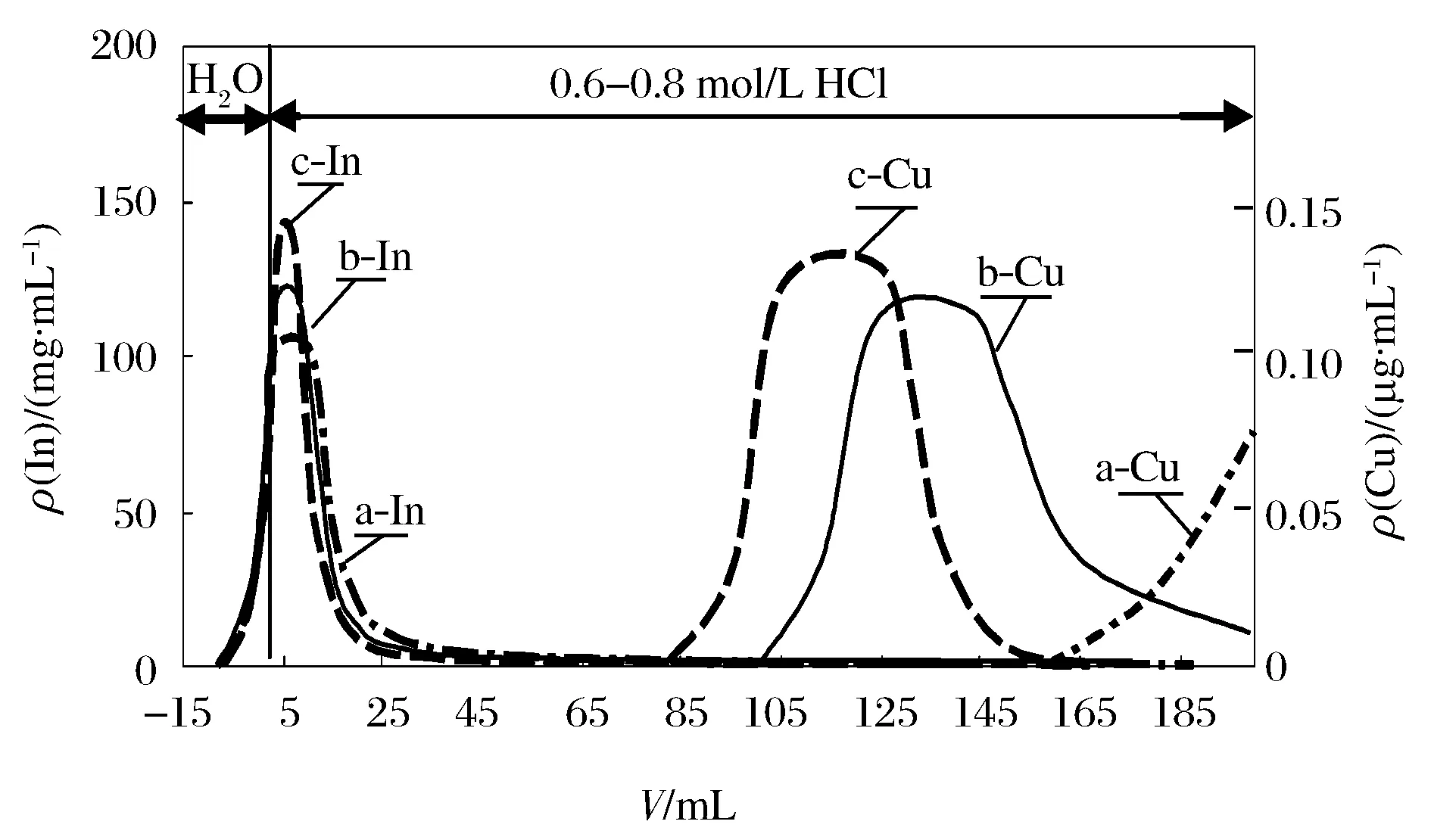
a—CHCl=0.6 mol/L; b—CHCl=0.7 mol/L; c—CHCl=0.8 mol/L 图2 酸度对In和Cu淋洗曲线的影响 Figure 2 Effects of acidity on the elution curve of In and Cu.
在铟洗脱之后,淋洗液酸度大些有利于洗脱铜,但酸度过大,氯化氢气体挥发出来会污染工作环境。实验选用2.0 mol/L盐酸洗脱铜。
2.2.3 样品量和过柱铟浓度的选择
考察了不同样品量对铜与铟分离的影响。实验结果表明,样品量在0.1~5.0 g之间均可有效分离。但过柱时如果铟的浓度太大,过柱流速低,耗时长,不可取。实验选取上柱时铟的浓度为1 g/5mL。综合考虑样品的成本和最后测定溶液中铜的浓度,实验选取样品的量为1 g。
2.2.4 离子交换柱的尺寸和过柱流速
离子交换柱的高度(h)和直径(d)、试液过柱的流速(v)影响分离效果。实验结果表明,当h/d≤14时,铜与铟 的洗出曲线分不开;h/d≥16时,有很好的分离效果。但若h/d过大,则液体过柱的流速过低,比较费时。v=1.5~2.0 mL/min是合适的,v>2.5 mL/min时,铜与铟的分离失败。实验选择h/d=16.3,v选为1.5~2.0 mL/min。
2.3 测定条件选择
GFAAS法测定铜的报道已多见。在本实验条件下,在盐酸介质或硝酸介质中测定结果一致,且不必使用基体改进剂。进样量一般取10~20 μL,但为了降低测定下限,可以将一次进样量提高到50 μL。这时把烘干时间适当延长,以避免升温时试液激烈沸腾而飞溅。
作为GFAAS法的一般操作,测定试液与标准溶液的盐酸浓度要尽量相近。实验结果表明,盐酸浓度在0.01~0.1 mol/L之间对测定结果的影响不超过7%。本实验标准溶液采用盐酸(0.05 mol/L)稀释;蒸发浓缩试液时蒸发至近干以降低酸度,最后用盐酸(0.01 mol/L)溶解盐类并定容。
2.4 线性范围和检出限
在试液进样量为50 μL时,铜浓度在1~4 ng/mL时,铜的浓度与吸光度A呈线性关系:A=0.052 7C+0.043 1,相关系数r=0.999 0;当浓度超过4 ng/mL后,数据离散程度增大,相关系数变小。
进样量定为50 μL时,经全过程处理的空白溶液平行测定11次,计算标准偏差,以3倍标准偏差算得方法的检出限为0.1 ng/mL,以10倍检出限算得方法的测定下限为1 ng/mL。若称样量为1.0 g、定容1.0 mL,计算样品的测定下限为0.001 μg/g,比行业标准方法YS/T 230.1—1994的0.1 μg/g低两个数量级。
2.5 干扰实验
高纯铟行业标准规定了Ag,Al,As,Cd,Cu,Fe,Mg,Ni,Pb,S,Si,Sn,Tl,Zn等14种杂质元素的含量。在样品溶液中加入杂质元素(除S外),过离子交换树脂柱后用GFAAS法进行检测,结果发现,在离子交换过程中,Ag,As,Cd,Si在前100 mL被洗脱;但Al,Fe,Mg,Ni,Pb,Sn,Tl和Zn的淋洗曲线与Cu重叠或相交,即高纯铟样品中可能包含的这些元素全部或部分地进入测定液中;此外,测定液中还含有拖尾的7~10 μg的In。对这些与Cu相混的元素,本文按文献[1]规定的In-05牌号高纯铟杂质限量的2倍,即按1.0 g样品、制备1 mL测定液计算,配制每毫升含10.0 μg In;0.2 μg Sn,Pb,Tl;0.1 μg Al,Fe,Mg,Ni,Zn;2 ng Cu的溶液,而后用GFAAS测定Cu,测定数据与同等浓度的纯Cu标准溶液的测定结果没有区别,即2倍于In-05牌号高纯铟杂质限量的上述元素和含量不超过10.0 μg/mL的铟未对铜的测定产生影响。
3 样品分析
分别称取3个高纯铟样品,按实验方法对高纯铟中的铜进行测定,每个样品平行测定8次,同时做加标回收实验,并采用ICP-MS法做对照实验,实验结果见表1。结果表明,本法的相对标准偏差(RSD,n=8)在1.7%~18.5%,加标回收率为94.8%~115.0%。
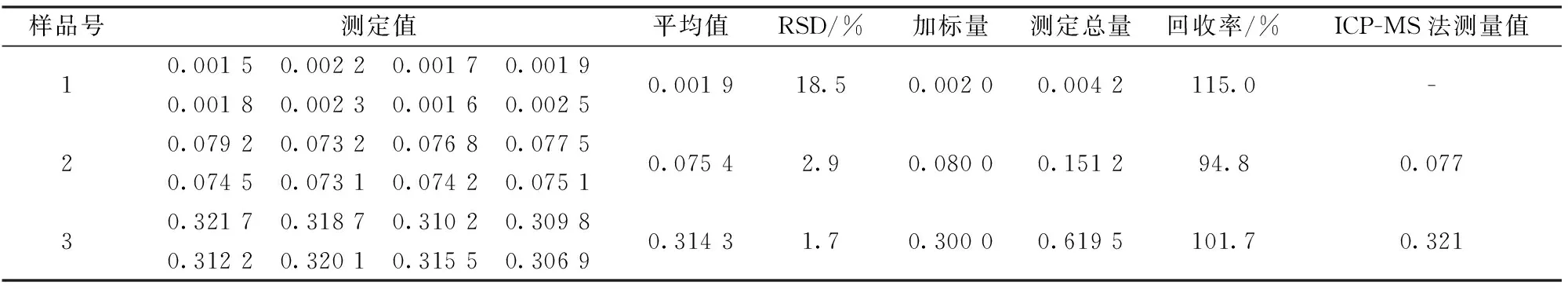
表1 样品中铜的分析结果 Table 1 Analytical results of copper in the high purity indium samples(n=8) /(μg·g-1)
4 结语
分离和测定高纯铟中的铜,分离是关键。离子交换分离法往往给人冗长、繁杂的印象,但实际工作时每人可以同时进行4~6支柱子的分离操作,可保证效率。实验对样品量、离子交换柱尺寸、上柱液和淋洗液的种类及浓度等因素进行了研究,实现了铜和大量铟的有效分离。GFAAS法与ICP-MS或GD-MS法比较,前者价格低、易普及。用GFAAS法测定,所需试液量小,灵敏度较高,试液可以浓缩至1 mL甚至更少,这也有助于降低检出限。离子交换分离-GFAAS法测定铜,集中了两者的长处,适用于高纯铟中痕量铜的测定。
[1] 国家标准委员会.YS/T 264—2012 高纯铟[S].北京:中国标准出版社,2012.
[2] 周漱萍,刘仙庄.脉冲极谱溶出法测定高纯铟中镉和铜[J].新乡师范学院学报,1982(3):25-31.
[3] 韦新红,魏雅娟,陈永欣,等.电感耦合等离子体质谱(ICP-MS)法测定高纯氧化铟中铜含量的不确定度评定[J].中国无机分析化学,2011,1(2):50-53. [4] 刘星星,文劼,熊兴安.铟基体分离及其杂质元素在ICP-MS中的测定[J].湖南有色金属,2002,18(4):43-45.
[5] 刘红,李爱嫦,李继东.辉光放电质谱法测定高纯铟中痕量元素[J].分析实验室,2012,31(5):10-12.
[6] 覃祚明.电感耦合等离子体质谱法在高纯铟杂质元素分析中的应用[D].长沙:中南大学,2009.
[7] 冯先进.ICP-MS法测定铟中砷、铝、铜、镉、镍、铅、铊、锡和锌[J].有色金属,2010,62(4):136-139.
[8] S.Grazhalene, V.Karandashev, L.Zadnepruk,et al. AAS-ETA,ICP-AES and ICP-MS analysis of high purity indium using matrix separation by analytical autoclaves of special design[J]. Fresenius' Journal of Analytical Chemistry,1996,355:297-299.
[9] 吴文启;李奋;谢晓雁,等. 离子交换分离-石墨炉原子吸收光谱法测定高纯铟中的痕量银[J].岩矿测试,2012,31(5):834-837.
[10] 吴文启;李奋;谢晓雁,等. 离子交换分离石墨炉原子吸收光谱法测定高纯铟中痕量砷[J].冶金分析,2011,31(12):11-14.
