响应面法优化鱼骨中硫酸软骨素的醇沉工艺
2014-02-24梁宝东魏海香王田田张晓晶
梁宝东,魏海香,王田田,张晓晶
(济宁学院生命科学与工程系,山东曲阜273155)
响应面法优化鱼骨中硫酸软骨素的醇沉工艺
梁宝东,魏海香,王田田,张晓晶
(济宁学院生命科学与工程系,山东曲阜273155)
在单因素试验基础上,采用响应面法优化鱼骨中硫酸软骨素的醇沉工艺参数。以乙酸钠质量浓度、pH值、乙醇体积分数为考察因素,硫酸软骨素得率为响应值,进行3因素3水平中心组合设计(CCD)试验,获得多元二次回归方程。结果表明,硫酸软骨素的最佳醇沉工艺为乙酸钠质量浓度4.0 g/100 mL、pH值为6.0、乙醇体积分数60%,硫酸软骨素实际提取率为1.910%。
鱼骨;硫酸软骨素;响应面分析法;醇沉
硫酸软骨素(chondroitin sulfate,CS)是从动物软骨组织中提取纯化出的一种酸性黏多糖,主要来源于猪、牛及鲨鱼等生物体,但家畜的软骨产量很低,提取成本高[1]。CS在鱼类软骨中含量很丰富,如鲨鱼骨中含50%~60%,但鲨鱼由于捕捞过度而产量锐减,致使硫酸软骨素生产受到影响。目前全世界每年硫酸软骨素的产量仅为180 t左右,供不应求,已给药品和化妆品的生产带来了影响[2-3]。
我国鱼头鱼骨资源相当丰富,从中提取硫酸软骨素,既能减轻废弃鱼头鱼骨对环境造成的可能污染,又能使硫酸软骨素产量大幅增加;既可缓解市场紧缺问题,又可出口创汇[4]。李川等[5]采用稀碱-酶解工艺对罗非鱼头中的硫酸软骨素进行了提取,纯度达81.28%,证明了方法的可行性。李瑞国[6]对硫酸软骨素的生产工艺进行了实验比较和改进,发现应避免浓碱提取和高温,浸提液中的离子强度较大时有利于提高产品质量。陈红丽等[7]对硫酸软骨素的生产工艺进行了优化,发现碱提取和酶提取是提高得率和纯度的两个关键步骤。目前从鱼骨中提取硫酸软骨素的研究更多地侧重于提取方法方面的研究。本研究以微山湖区产四鼻鲤鱼鱼骨为原料,经过碱法提取和酶解得到浸提液,主要对浸提液中硫酸软骨素的醇沉纯化工艺进行了优化,旨在为鱼骨硫酸软骨素的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
鱼脊骨、鱼头骨:市售。
1.1.2 试剂
复合蛋白酶(3.8×105U/g)、咔唑(分析纯)、四硼酸钠(分析纯):上海士锋生物科技有限公司;氢氧化钠(分析纯):天津市恒兴化学试剂制造有限公司;盐酸(36%)、硫酸(分析纯):莱阳市经济开发区精细化工厂;氯化钠(分析纯):上海广诺化学科技有限公司;三氯乙酸(分析纯):西陇化工股份有限公司;无水乙醇(分析纯)、体积分数为95%乙醇(分析纯):烟台市双双化工有限公司;粒状活性炭:天津市福晨化学试剂厂;无水乙酸钠(分析纯):天津市风船化学试剂有限公司;硫酸软骨素标准品(≥98%):上海明圻化学试剂有限公司。
硼砂-硫酸试剂配制:四硼酸钠0.953 4 g用浓硫酸定容至100 mL。
咔唑试剂配制:咔唑0.125 0 g用乙醇定容至100 mL,4℃低温保存。
1.2 仪器与设备
DHG-9059B智能型电热恒温鼓风干燥箱:上海琅玕实验设备有限公司;723PC可见分光光度计:上海菁华科技仪器有限公司;XB120A型电子天平:上海精密科学仪器有限公司;RJP-350A型快速开盖万能高速粉碎机:浙江荣浩工贸有限公司;SHZ-Ⅲ型循环水真空泵:上海亚荣生化仪器厂;HH-4数显恒温水浴锅、TD6离心机:常州市华普达教学仪器有限公司。
1.3 方法
1.3.1 鱼骨浸提液的制备
将冷冻状态的鱼骨流水解冻,投入80℃恒温蒸煮锅煮1 h,捞起、洗净,去除含蛋白质、脂肪和其他不需要的部分,于电热鼓风干燥箱中80℃烘干,粉碎,得鱼骨骨粉。称取200 g鱼骨粉,与NaOH溶液(1 mol/L)按料液比1∶6(g∶mL)于50℃水浴中恒温浸提6 h,提取过程中间歇搅拌,单层纱布过滤后收集滤液,把滤渣用同样的方法再处理一次,双层纱布过滤,然后把两次的滤液合并,待处理。调整滤液pH值至7.0,加入1%的复合蛋白酶,50℃恒温水解,酶解时不断搅拌,2 h后将酶解液置于90℃水浴锅中灭酶10 min,水冷迅速降至室温。把灭活的酶解液pH值调至6.5,加入活性炭搅拌吸附1 h,静置片刻后过滤。将三氯乙酸直接加入到上述滤液中,三氯乙酸的添加量达10%,边加边搅拌即产生沉淀,3 500 r/min离心10 min得上清液,弃沉淀,得鱼骨浸提液[8-10]。
1.3.2 浸提液醇沉工艺流程[11-13]

1.3.3 鱼骨中硫酸软骨素含量的测定
(1)硫酸-咔唑法[14-15]
鱼骨中硫酸软骨素的含量采用硫酸-咔唑法进行测定。
(2)标准曲线的绘制
精确称量硫酸软骨素(CS)标准品2 mg,加水溶解并定容至50 mL,配制40 μg/mL的CS标准溶液。准确吸取CS标准溶液0、0.20 mL、0.40 mL、0.60 mL、0.80 mL、1.00 mL,分别置于25 mL具塞试管,用蒸馏水定至1 mL混匀,得一系列硫酸软骨素标准溶液,在冰水浴条件下缓缓加入5 mL硼砂-硫酸试剂,注意避免出现沸腾。90℃水浴加热20 min,振荡混匀,冷水浴中迅速冷却后,分别加咔唑试剂0.2 mL摇匀,置于90℃水浴加热20 min,中间振荡混匀,冷却至室温后于波长530 nm处测定其吸光度值。
(3)样品中硫酸软骨素含量测定
准确称取样品3 mg,加15 mL超纯水溶解并稀释,做3个重复,以超纯水作为参比,按上述标准曲线的测定方法分别测定其吸光度值,样品中硫酸软骨素提取率计算公式如下:

2 结果与分析
2.1 硫酸软骨素标准曲线制作
以硫酸软骨素(CS)质量浓度(x,μg/mL)为横坐标,吸光度值(y)为纵坐标,得到标准曲线见图1。标准曲线线性回归方程为y=0.009 0x+0.005 7,相关系数R2为0.999 1,表明二者线性关系良好。
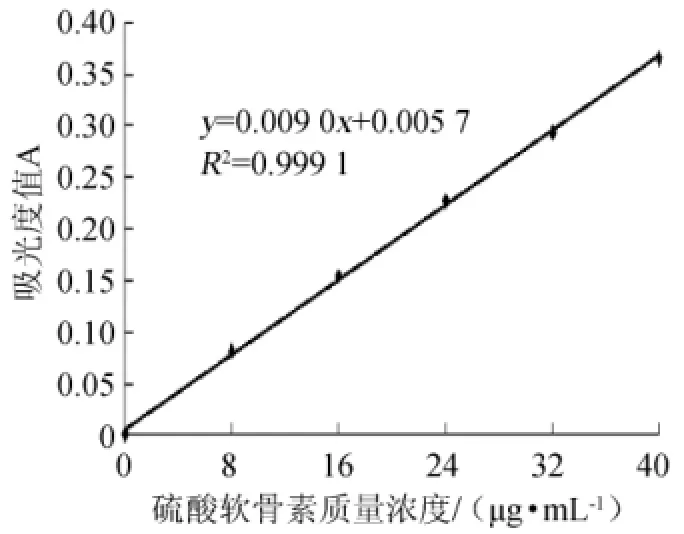
图1 硫酸软骨素标准曲线Fig.1 Standard curve of chondroitin sulfate
2.2 乙酸钠质量浓度对硫酸软骨素醇沉效果的影响
在5个三角瓶中分别加入100 mL鱼骨浸提液,分别加入乙酸钠质量浓度为3.5 g/100 mL、4.0 g/100 mL、4.5 g/100 mL、5.0 g/100 mL、5.5 g/100 mL,搅拌溶解后调节溶液pH值为6.0,冷却后加入一定无水乙醇使体系中乙醇体积分数为65%,4℃下静置12 h后于5 000 r/min离心20 min,收集沉淀,考察乙酸钠质量浓度对硫酸软骨素醇沉效果的影响,结果如图2所示。

图2 乙酸钠质量浓度对硫酸软骨素提取率的影响Fig.2 Effect of sodium acetate concentration on extraction yield of chondroitin sulfate
由图2可以看出,随着乙酸钠质量浓度的增大,硫酸软骨素提取率逐渐提高,在乙酸钠质量浓度为4.5 g/100 mL时达到最大值。当乙酸钠质量浓度>4.5 g/100 mL时,硫酸软骨素的提取率出现下降趋势,硫酸软骨素提取率由2.03%下降到1.23%。这是因为当盐离子浓度过大时导致一些杂质(某些蛋白质和有机盐)溶出率增大继而降低就了硫酸软骨素的析出,使硫酸软骨素的提取率降低。因此,乙酸钠最佳质量浓度为4.5 g/100 mL。
2.3 pH对硫酸软骨素醇沉效果的影响
在5个三角瓶中分别加入100 mL鱼骨浸提液,在提取液中加入无水乙酸钠,搅拌溶解使体系的乙酸钠质量浓度为4.5 g/100 mL,分别调节提取液pH为5.5、6.0、6.5、7.0、7.5,冷却后加入无水乙醇使体系中乙醇体积分数为65%,4℃下静置12 h,5 000 r/min离心20 min,收集沉淀,考察pH值对硫酸软骨素醇沉效果的影响,结果如图3所示。

图3 pH对硫酸软骨素提取率的影响Fig.3 Effect of pH on extraction yield of chondroitin sulfate
由图3可以看出,随着pH的增大,硫酸软骨素提取率逐渐提高。在pH约为6.0时达到最大值,当pH>6.0时硫酸软骨素的提取率开始降低,由1.87%降到1.49%。这是因为硫酸软骨素属于两性化合物,pH的变化会影响其所带电荷的性质和数量,进而影响其在纯化过程中的溶解度,当静电荷数减少时,分子间吸引力增加,相互凝聚产生沉淀,使硫酸软骨素的提取率降低。因此,最佳pH值为6.0。
2.4 乙醇体积分数对硫酸软骨素醇沉效果的影响
在5个三角瓶中分别加入100 mL鱼骨浸提液,在提取液中加入无水乙酸钠,搅拌溶解使体系的乙酸钠质量浓度为4.5 g/100 mL,调节提取液pH值为6.0并冷却后加入无水乙醇使体系中乙醇体积分数为55%、60%、65%、70%、75%,4℃静置12 h,5 000 r/min离心20 min,收集沉淀,考察乙醇体积分数对硫酸软骨素醇沉效果的影响,结果如图4所示。
由图4可以看出,随着乙醇体积分数的逐渐增大,硫酸软骨素的提取率逐渐提高,在乙醇体积分数为65%时提取率达到最大值(1.98%),在55%~65%时变化较明显,当乙醇体积分数>65%时,提取率开始降低,乙醇体积分数为75%时,提取率为1.3%。这是由于乙醇体积分数的升高,提高了某些蛋白质的溶解度,使硫酸软骨素也随之溶于乙醇溶液而没有沉降下来。因此,最佳乙醇体积分数为65%。

图4 乙醇体积分数对硫酸软骨素提取率的影响Fig.4 Effect of ethanol content on extraction yield of chondroitin sulfate
2.5 鱼骨中硫酸软骨素醇沉条件的响应面分析与优化
根据Box-Benhnken中心设计原理,结合单因素试验结果,以无水乙酸钠质量浓度(A)、pH值(B)、和乙醇体积分数(C)三因素为自变量,以硫酸软骨素提取率(Y)为响应值,设计3因素3水平试验,因素和水平见表1,结果见表2。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface methodology
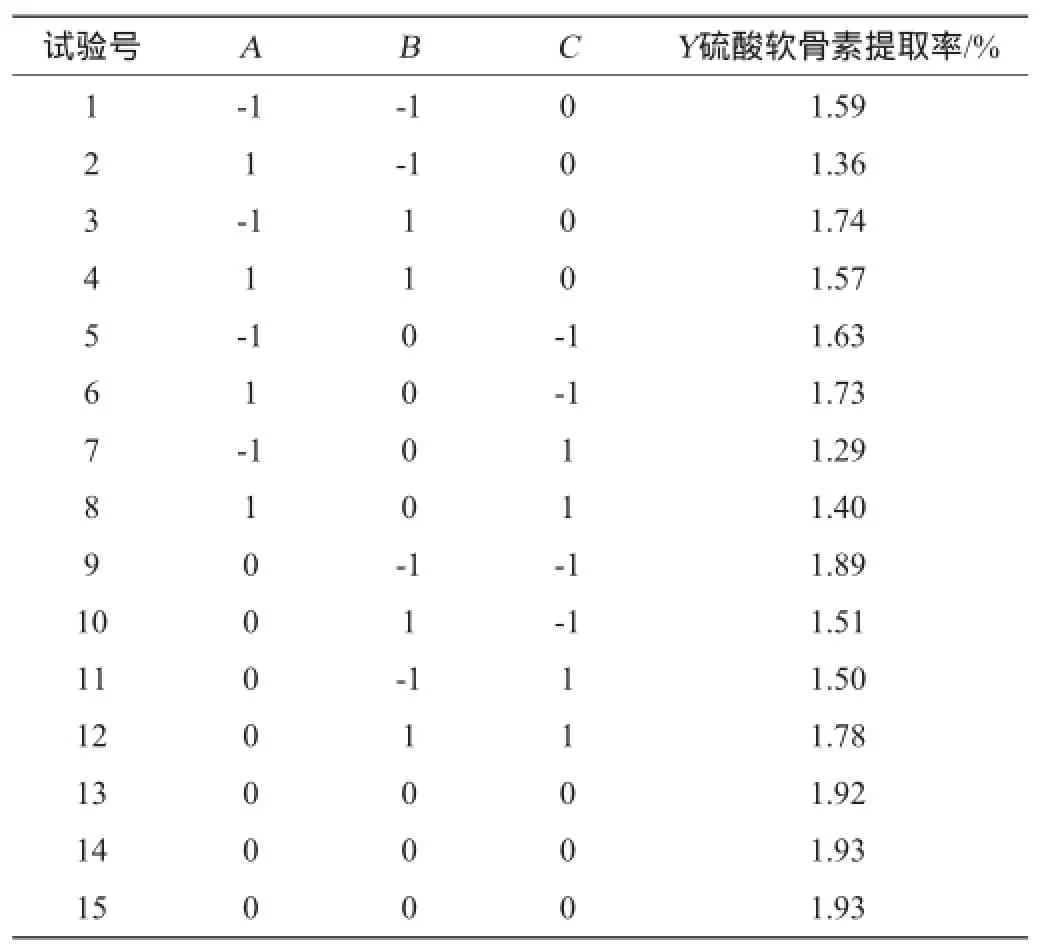
表2 响应面试验设计及结果Table 2 Design and results of response surface methodology
2.6 响应面方差分析
用Design-Expert程序对表2试验数据进行方差分析,结果见表3,并得出回归方程如下:
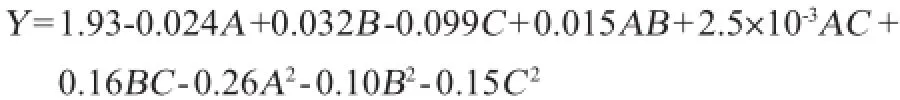
模型的校正决定系数R2Adj为0.929 0,变异系数(coefficient of variation,CV)为5.08%,说明该模型只有7.10%的变异不能由该模型解释,因此,该模型的拟合性较好。模型的F值为13.39,P<0.000 1,表明该模型受外界干扰的几率只有0.01%,是极其显著的,模型拟合程度较好,自变量与响应值之间的线性关系显著,可用于硫酸软骨素纯化工艺的预测和分析。
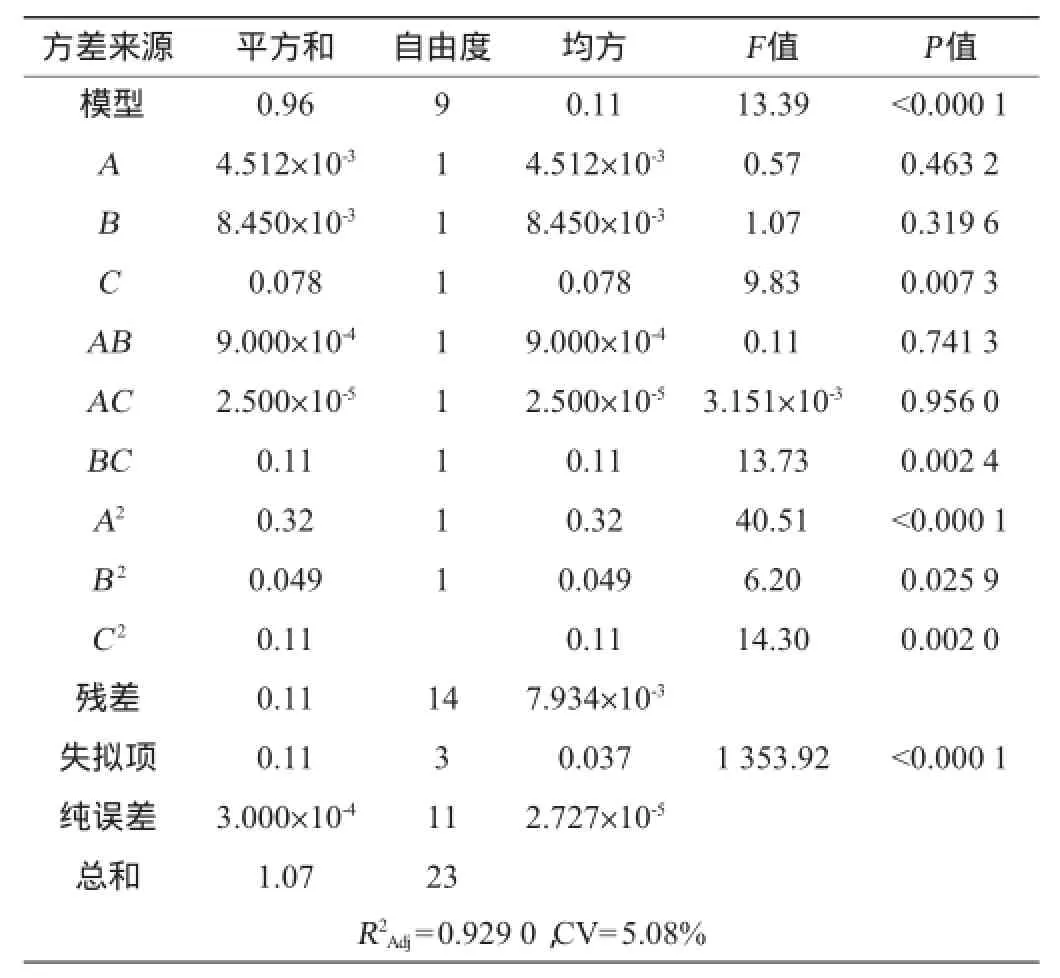
表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3得出,C、交互项BC、B2和C2对硫酸软骨素提取率有显著影响;A2对硫酸软骨素得率影响高度显著,而A、B、AB和AC对硫酸软骨素得率的影响都不显著。在所选的各因素范围内,对硫酸软骨素纯化的影响排序为pH值(C)>乙醇体积分数(B)>乙酸钠质量浓度(A)。
2.7 响应面交互作用分析与优化
通过Design-Expert软件绘制响应面曲线图与等高线图进行分析可进一步研究相关变量之间的交互作用以及最优点,结果见图5。
由图5A可以看出,pH值为6.0时乙醇体积分数对硫酸软骨素的纯化影响较为显著,硫酸软骨素的提取率随乙醇体积分数的升高先升高再降低,这可能是由于乙醇体积分数的升高,提高了某些蛋白质的溶解度,使硫酸软骨素也随之溶于乙醇溶液而又沉降下来[8]。在试验水平范围内,乙酸钠质量浓度和乙醇体积分数分别在4.0~5.0 g/100 mL和60%~70%范围内时,硫酸软骨素提取率可以达到最大值。
由图5B可以看出,乙醇体积分数为60%时,pH值对硫酸软骨素的纯化影响较为显著,硫酸软骨素的提取率随pH的升高先升高再降低。在试验水平范围内,乙酸钠质量浓度和pH分别在4.0~5.0 g/100 mL和6.0~7.0范围内时,硫酸软骨素提取率可以达到最大值。
由图5C可以看出,乙酸钠质量浓度为4.5 g/100 mL时,硫酸软骨素提取率随乙醇体积分数和pH值的升高先升高再降低。在试验水平范围内,乙醇体积分数和pH分别在60%~70%和6.0~7.0范围内时,硫酸软骨素提取率可以达到最大值。
2.8 验证试验
根据Design-Expert软件分析得出3个影响因素的最佳组合为:乙酸钠质量浓度4.5 g/100 mL,pH值为6.0,乙醇体积分数60%,该条件下硫酸软骨素纯化的提取率预测值为1.925%。为检验其可靠性,在该条件下重复试验3次,硫酸软骨素纯化的提取率为1.910%,实测值与理论值基本吻合,说明响应面分析法得到的硫酸软骨素纯化工艺条件真实可靠,具有一定实用价值。
3 结论
本研究采用了从鱼骨中提取硫酸软骨素的醇沉工艺,采用单因素和响应面分析相结合的方法,分别考察了乙酸钠质量浓度、乙醇体积分数和pH等因素对硫酸软骨素醇沉工艺的影响,得到硫酸软骨素最佳醇沉工艺:乙酸钠质量浓度4.5 g/100 mL,pH值为6.0,乙醇体积分数60%,各因素的主效应关系为:pH(C)>乙醇体积分数(B)>乙酸钠质量浓度(A)。此条件下硫酸软骨素的提取率为1.910%。
[1]张雯.硫酸软骨素的提取和纯化[D].镇江:江苏大学硕士论文,2009.
[2]方旭波,陈小娥.鱿鱼硫酸软骨素糖蛋白的分离纯化和鉴定[J].中国食品学报,2009,9(4):103-108.
[3]陈丹青,李燕.黄鳝骨硫酸软骨素提取纯化的初步研究[J].天然产物研究与开发,2008,20(6):1075-1079.
[4]成长玉,段振华.响应面法优化罗非鱼下脚料硫酸软骨素提取工艺的研究[J].食品科技,2011,36(3):213-217.
[5]李川,陆振华,龙映均,等.罗非鱼头中硫酸软骨素提取的工艺优化[J].食品科学,2009,30(20):234-237.
[6]李瑞国.硫酸软骨素不同生产工艺的考察[J].中国医药工业杂志,2003,34(5):221-222.
[7]陈红丽,李玉,唐亮.硫酸软骨素生产工艺的优化[J].河南化工,2006,23(3):15-17.
[8]陈召国,杨文革.响应面法优化猪硫酸软骨素的提取工艺[J].食品科技,2011,36(7):187-196.
[9]郑江.鲟鱼硫酸软骨素的纯化及其特征[J].水产学报,2008,32(3):478-483.
[10]KUBO M,ANDO K,MIMURA T,et al.Chondroitin sulfate for the treatment of hip and knee osteoarthritis:current status and future trends [J].Life Sci,2009,10(9):433-438.
[11]SCHIRALDI C I,CARCARINO I L.Purification of chondroitin precursor from Escherichia coli K4 fermentation broth using membrane processing[J].Biotechnol J,2011,6(4):410-419.
[12]李利晓,夏延斌.正交实验法优化牛鼻软骨中硫酸软骨素的纯沉工艺[J].食品工业科技,2012,33(16):261-264.
[13]王亚儿.乌贼硫酸软骨素的纯化及其鉴别[J].中国食品学报,2013,13(12):197-201.
[14]张莉.硫酸软骨素含量测定方法的研究进展[J].天津药学,2013,25(2):44-46.
[15]傅应华.咔唑法测定鲨鱼硫酸软骨素含量的方法学研究[J].中国生化药物杂志,2007,28(1):54-56.
Optimization of alcohol precipitation process of chondroitin sulfate from fishbone by response surface methodology
LIANG Baodong,WEI Haixiang,WANG Tiantian,ZHANG Xiaojing
(Department of Life Science and Engineering,Jining University,Qufu 273155,China)
On the basis of single factor experiment,response surface methodology was used to optimize alcohol precipitation process of chondroitin sulfate from fishbone.Using sodium acetate concentration,pH value and ethanol concentration as investigation factors and chondroitin sulfate extraction ratio as response value,the optimal purification conditions were explored through a three-factor,three-level central composite experimental design and the multiple quadratic regression equation was acquired.Results showed that the optimum alcohol precipitation process of chondroitin sulfate from fishbone was as follows:sodium acetate concentration 4.0 g/100 ml,pH 6.0,ethanol concentration 60%.The chondroitin sulfate extraction ratio was 1.910%.
fishbone;chondroitin sulfate;response surface methodology;alcohol precipitation
TS254.9
A
0254-5071(2014)10-0104-05
10.11882/j.issn.0254-5071.2014.10.025
2014-08-27
济宁学院大学生研究性学习与创新性实验计划项目(CXL305)
梁宝东(1979-),男,讲师,硕士,研究方向为微生物发酵及生物活性物质。
