产酸性甘露聚糖酶菌株的筛选、鉴定及酶活性研究
2014-02-23张居作李志波徐君飞
张居作,李志波,徐君飞*
(1.怀化学院生命科学系民族药用植物资源研究与利用湖南省重点实验室,湖南怀化418008;2.湖南农业大学动物医学院,湖南长沙410128)
产酸性甘露聚糖酶菌株的筛选、鉴定及酶活性研究
张居作1,2,李志波1,徐君飞1*
(1.怀化学院生命科学系民族药用植物资源研究与利用湖南省重点实验室,湖南怀化418008;2.湖南农业大学动物医学院,湖南长沙410128)
采用酸性魔芋精粉平板,从土壤中分离到两株产酸性甘露聚糖酶菌株,命名为LZ11、LZ12;分别对菌株LZ11、LZ12在生长过程中分泌酸性甘露聚糖酶的活力进行跟踪研究后发现,这两株菌株的对数生长期皆为2~12 h,发酵8 h后,酶活力呈明显上升趋势,14 h达到峰值,分别为23.15 U,19.09 U;选择酶活力稍高的菌株LZ11进行鉴定,根据生理生化试验结果,初步鉴定为芽孢杆菌属(Bacillussp.)。
甘露聚糖酶;筛选;鉴定;酶活性
甘露聚糖是以β-1,4-D-吡喃甘露糖苷键连结而成的线状多糖,是构成植物半纤维素的必要成分之一[1]。β-1,4-D-甘露聚糖酶(β-1,4-D-mannase,EC 3.2.1.78)是一类作用于β-1,4-D-甘露糖苷键的内切水解酶,广泛应用在保健食品、医药、饲料等行业[2-3]。
微生物β-甘露聚糖酶的研究主要集中在产碱性和中性甘露聚糖酶菌种的筛选、诱变,酶的诱导、提纯,酶水解底物方式,酶基因克隆表达等方面[4],而作为保健食品开发的甘露聚糖酶制剂需要符合人体胃肠道的环境条件,因此酸性β-甘露聚糖酶制剂的开发具有独到优势。本研究采用酸性魔芋粉平板,从土壤中筛选出大量产酸性β-甘露聚糖酶菌株,通过比较,得到较具优势的两株菌株LZ11、LZ12,对其产酶活性进行初步研究,为进一步研究和工业化生产提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
魔芋粉、蛋白胨、酵母膏:北京奥博星生物技术责任有限公司;甘露糖标准品:北京鼎国生物技术有限责任公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):上海化学试剂公司。
1.1.2 培养基(按质量分数计)
(1)筛选培养基:魔芋粉0.8%,琼脂粉2.0%,蛋白胨0.5%,酵母膏0.5%,NaCl0.5%,台盼蓝0.05%,pH5.0,121℃灭菌20 min。
(2)种子培养基[5]:魔芋粉0.5%,蛋白胨0.5%,酵母膏0.5%,NaCl 0.5%,pH 5.0,121℃灭菌20 min。
(3)发酵培养基:魔芋粉1.0%,蛋白胨0.5%,酵母膏0.5%,NaCl 0.5%,pH 5.0,121℃灭菌20 min。
(4)菌种保存培养基:琼脂粉2.0%,蛋白胨0.5%,牛肉膏或酵母膏0.5%,NaCl 0.5,自然pH,121℃灭菌20 min。
(5)甲基红试验培养基:蛋白胨0.5%,葡萄糖0.5%,NaCl 0.5%,pH 7.0,每管分装4~5 mL,121℃灭菌20 min。
(6)营养明胶培养基:蛋白胨0.5%,明胶10.0%,pH 7.2,分装试管,培养基高度约4.5 cm,121℃灭菌20 min。
1.3 实验方法
1.3.1 实验材料的处理
称取土壤4.0 g,加入装有40 mL无菌水的三角瓶中,振荡30 min,作为备用实验菌液。
1.3.2 β-甘露聚糖酶产生菌的筛选
将备用实验菌液进行10倍梯度稀释,分别涂布于筛选培养基,30℃,培养48 h,寻找在平板上生长良好且有明显水解圈的菌株作为初筛所得菌株。分别将初筛得到的菌株接种于种子培养基,30℃、150 r/min振荡培养8 h后,按2%的接种量转接入发酵培养基,30℃、150 r/min振荡培养12 h后,各吸取10 μL点种于筛选培养基,30℃倒置培养48 h,观察各菌株在筛选培养基上的水解圈情况并进行测量,挑选水解圈直径与菌落直径比值较大的菌落进行连续分纯与继代培养,斜面保藏,备用。
1.3.3 甘露糖标准曲线的制作[5-6]
取六支具塞比色试管,按表1分别加入1 mg/mL标准甘露糖溶液、蒸馏水和DNS试剂,于沸水浴准确反应2 min,取出,用流水迅速冷却,加蒸馏水定容至10 mL,以0管作空白对照,测定各管的OD540nm值。以甘露糖质量浓度(mg/mL)为横坐标,OD540nm为纵坐标绘制标准曲线,计算回归方程和相关系数。

表1 甘露糖标准曲线的绘制Table 1 Standard curve drawing of mannose
1.3.4 LZ11、LZ12生长曲线的测定
将复筛得到的优势菌株LZ11、LZ12接种于种子培养基,30℃、150 r/min振荡培养8 h后,按2%的接种量转接入发酵培养基,30℃、150 r/min振荡培养,从0 h开始测定其OD660nm,一直到平缓期,绘制菌株LZ11、LZ12的生长曲线。设置三个平行。
1.3.5 LZ11、LZ12分泌酸性β-甘露聚糖酶活力变化曲线测定
(1)粗酶液的制备[7-8]
将LZ11、LZ12接种于种子培养基,30℃、150r/min振荡培养8h,按2%的接种量转接入发酵培养基,30℃、150r/min振荡培养,从0 h开始,每隔2 h从发酵培养基中吸取10 mL发酵液,4000r/min、4℃离心10min,取上清液作为粗酶液。
(2)酸性β-甘露聚糖酶活力测定及酶活力变化曲线的绘制[9-10]
取2.0 mL预热至50℃,以pH 5.8,0.05 mol/L柠檬酸-0.05 mol/L磷酸氢二钠缓冲液配制的2.0 g/L魔芋胶底物,添加1 mL适当稀释的粗酶液,50℃下准确反应5 min,同时取1mL酶液于另一管中煮沸灭活处理,冷却后加入2 mL底物,作为对照。反应完成后分别向各管加入2 mL DNS终止反应,其余步骤同标准曲线操作方法,测OD540nm,从标准曲线上查得相应的甘露糖的含量,计算得出β-甘露聚糖酶活力,绘制酶活力变化曲线。设置三个平行。
酶活力单位定义为:以2%魔芋胶为底物,每小时释放1 mg相当于D-甘露糖的还原糖所需的酶量为一个酶活单位(U)。
1.3.6 菌株LZ11的鉴定
(1)菌落形态观察
将菌株LZ11接种于种子培养基,30℃、150 r/min振荡培养8 h后,进行10倍梯度稀释,分别取10-3稀释度的菌液在筛选培养基上进行划线分离,做2个平行;10-4、10-5和10-6三个稀释度的菌悬液分别涂布于筛选培养基,每个稀释度做2个平行,30℃倒置培养48 h,观察菌株在筛选平板上的菌落形态。
(2)芽胞的检测[11]
用孔雀绿染色法检测细菌是否产生芽胞。
(3)生理生化实验[11]
接触酶实验,耐盐性实验,V-P实验,利用D-葡萄糖、L-阿拉伯糖、D-木糖、D-甘露醇产酸实验,利用葡萄糖产气实验,明胶液化实验,淀粉水解实验,甲基红实验、吲哚实验、耐热性实验等。
2 结果与分析
2.1 酸性β-甘露聚糖酶产生菌的筛选
将菌悬液涂布于筛选培养基,能分解魔芋粉产生水解圈的菌株较多,分离能产生水解圈的菌株活化液,点种于筛选培养基,形成的菌落及水解圈情况如图1所示。
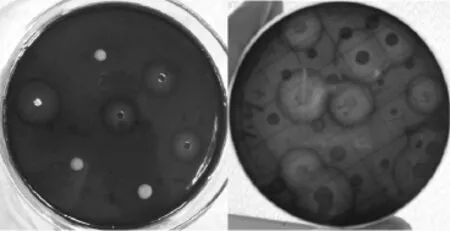
图1 筛选培养基上的菌落和水解圈Fig.1 Colonies and hydrolysis circle on the screening medium
由图1可以看出,经初筛后的菌株活化液在筛选培养基上形成明显的水解圈,经多次纯化后,反复比较各菌落直径大小和水解圈直径大小,选择2株菌落形态有明显区别,且水解圈与菌落直径之比较大的菌株1、2作为初筛所得菌株,命名为LZ11、LZ12。
将LZ11、LZ12同时点种于筛选培养基,30℃倒置培养48 h后,测量LZ11菌落直径的平均值为0.35 cm,水解圈直径的平均值为1.60cm,计算得水解圈直径/菌落直径=4.57;LZ12菌落直径的平均值为0.40 cm,水解圈直径的平均值为1.36 cm,计算得水解圈直径/菌落直径=3.40。结果表明,在本实验研究条件下,LZ11分泌甘露聚糖酶的能力可能比菌株LZ12高。
2.2 甘露糖标准曲线
测得不同浓度甘露糖标准溶液在540 nm波长下的OD540nm值,以甘露糖的质量浓度(x)为横坐标,以对应的OD540nm值(y)为纵坐标,绘制出甘露糖标准曲线如图2所示。

图2 甘露糖标准曲线Fig.2 Standard curve of mannose
由图2可知,标准曲线线性回归方程为y=0.571 6x-0.006 7,相关系数R2为0.999 3,表明二者相关性较好。
2.3 LZ11、LZ12的生长曲线
每隔2 h测定LZ11、LZ12发酵液在660 nm波长下的光密度值,以发酵时间为横坐标,OD660nm为纵坐标,绘制LZ11、LZ12的生长曲线如图3所示。

图3 LZ11、LZ12的生长曲线Fig.3 Growth curve of strain LZ11 and LZ12
由图3可知,在30℃发酵条件下,菌株LZ11、LZ12都在发酵2 h开始呈对数增长,而在13 h左右进入稳定期。这为对该菌的进一步研究提供了指导,可以选择以对数期至稳定期的发酵液作为β-甘露聚糖酶活力测定的目标物。
2.4 LZ11、LZ12的活力变化曲线
随着发酵培养时间的延长,菌株LZ11、LZ12的发酵液中分泌的酸性β-甘露聚糖酶活力结果如图4所示。
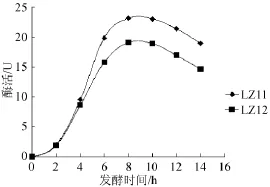
图4 菌株LZ11、LZ12分泌的β-甘露聚糖酶活力变化曲线Fig.4 Change curve of β-mannase activity secreted by strain LZ11 and LZ12
由图4可知,菌株LZ11、LZ12在发酵8 h时达到酶活高峰,分别为23.15 U、19.09 U。相对于许多报道中有关β-甘露聚糖酶酶活大小,其值显得相对偏小,这可能与实验限定的酸性等条件有关。随后缓慢下降,这可能是因为随着培养时间的延长,甘露聚糖酶出现了自溶的现象,导致酶活力下降。对活力稍高菌株LZ11进行进一步鉴定。
2.5 LZ11菌种鉴定
2.5.1 菌落形态观察
菌株LZ11在筛选培养基上培养24h后,菌落形态如图5所示。
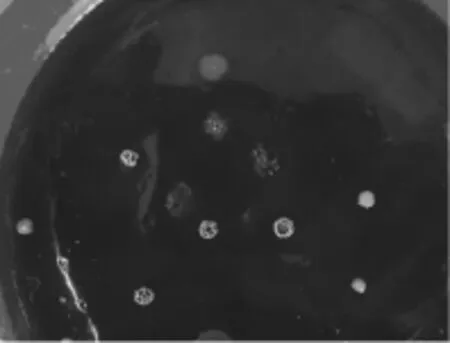
图5 LZ11菌落形态Fig.5 Colonial morphology of LZ11
由图5可知,LZ11的菌落形态为圆形,表面干燥,菌落周围不整齐中间形成皱起,无光泽,灰白色,不透明。
2.5.2 LZ11芽孢的检测
对菌株LZ11进行革兰氏染色和孔雀绿芽胞染色,观察LZ11的染色结果如图6所示。
由图6可知,LZ11为革兰氏阳性菌,产芽胞,参考细菌鉴定手册[11],该菌可以按照产芽孢细菌的鉴定方法进行生理生化实验。

图6 LZ11革兰氏染色和芽胞染色结果Fig.6 Gram stain and spore stain results of strain LZ11
2.5.3 生理生化实验
LZ11生理生化实验结果见表2。

表2 生理生化实验结果Table 2 Results of physiology and biochemistry experiment
综合表2结果,参考细菌鉴定手册,可初步判断LZ11属于芽胞杆菌属(Bacillussp.)。
3 结论
本实验选择从土壤中筛选出能够在酸性条件下分解甘露聚糖的微生物,并进行对其鉴定研究,以期能够获得在酸性环境中用于实际生产和应用的菌种。采用特异底物水解圈筛选,获得两种能够在pH为5~6条件下水解魔芋胶的菌种,通过初步鉴定,其中一株酶活力较大的菌种属于芽胞杆菌属(Bacillussp.)。再对其酶活的测定后发现其酶活分别为23.15 U,19.09 U;与其他研究报道存在较大差距。但本实验没有对菌种发酵条件进行优化,即不是在菌种发酵的最佳条件下进行其酶活测定,同时,本实验研究的是酸性β-甘露聚糖酶,不同于细菌比较适宜的中性或碱性环境,这可能是导致差距存在的两个主要原因。另外,所选取的材料以及测酶活时底物的不同也可能是造成差距存在的重要因素。
当今世界能源日渐短缺,加上半纤维素分解后产生的低分子物质具有许多生理功能,国内外对半纤维素的开发利用十分热门[12-14],但是,在努力提高半纤维素酶生产量的同时,怎样将实验室的研究成果更好地应用于工业化生产,转变为实际效益,还有待进一步深入研究。
[1]乔欣君,邹晓庭.β-甘露聚糖酶的营养功能及在动物生产中的应用[J].饲料研究,2005(2):53-55.
[2]王兆淼.β-甘露聚糖酶的研究及应用进展[J].白城师范学院学报,2010,24(6):64-66.
[3]廖贵芹.β-甘露聚糖酶的研究及应用现状[J].武汉生物工程学院学报,2008,4(4):22-29.
[4]徐扬,刘起丽,聂国兴,等.β-甘露聚糖酶的研究进展[J].河南农业科学,2011,40(4):34-37.
[5]张芹,程时军,张伟.甘露聚糖酶的作用机理及在动物生产中的应用[C]//第六届饲料安全与生物技术专业委员会大会暨第三届全国酶制剂在饲料工业中应用学术与技术研讨会论文集,2009.
[6]胡杨,周海燕,董蕾,等.甘露糖酶基因Man23在芽孢杆菌WB600中的表达[J].湖南农业大学学报,2007,33(5):539-541.
[7]李雅楠,孟昆,杨培龙,等.芽孢杆菌β-甘露聚糖酶基因部分序列的克隆及相似性分析[J].微生物学通报,2007,34(1):43-47.
[8]马骏双,姚婷婷,石贵阳,等.嗜热芽孢杆菌2004产β-甘露聚糖酶产酶条件优化和酶学性质[J].食品与生物技术学报,2006,25(3):25-32.
[9]路志群,马延和,王正祥.碱性β-甘露聚糖酶基因异源表达的研究[J].微生物学杂志,2006,26(3):9-11.
[10]李剑芳,张静娟,邬敏辰,等.酸性β-甘露聚糖酶固态发酵工艺与粗酶性质[J].食品科学,2006,27(5):143-147.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12]北京博仕奥生物技术有限公司.新型酶制剂β-甘露聚糖酶研究进展[J].广东饲料,2007,16(6):21-23.
[13]北京联合盛邦生物技术有限公司.β-甘露聚糖酶的制备及其在饲料工业中的应用进展[J].中国动物保健,2010(1):83-84.
[14]刘桂智,朱英波,杜金有,等.壳聚糖在农业上的应用研究进展[J].中国农学通报,2007,23(8):377-381.
Screening and identification of acidic mannase-producing strain and its enzymatic activity
ZHANG Juzuo1,2,LI Zhibo1,XU Junfei1*
(1.Key Laboratory of Hunan Province for Study and Utilization of Ethnic Medicinal Plant Resources,Department of Life Science, Huaihua University,Huaihua 418008,China;2.Faculty of Veterinary,Hunan Agricultural University,Changsha 410128,China)
Two acidic mannase-producing strains were isolated from soil by acidic konjac powder plate,and were named LZ11 and LZ12.The mannase activities secreted by strain LZ11 and LZ12 were tracked and their growth curve showed that the logarithmic phase was both at 2-12 h.After 8 h fermentation,the enzyme activity obviously increased,and the peak was at the 14 h.At that time,the enzyme activities of strain LZ11 and LZ12 were 23.15 U and 19.09 U,respectively.The strain LZ11 with higher enzyme activity was selected and identified asBacillussp.according to the physiological and biochemical test results.
mannase;screening;identification;enzymatic activity
S154.3
A
0254-5071(2014)11-0063-04
10.11882/j.issn.0254-5071.2014.11.014
2014-09-02
湖南省科技厅项目(2013NK4109);湖南省重点学科建设项目资助(2011-42);民族药用植物活性成分高效利用湖南省高校创新团队经费资助(2010-53)
张居作(1981-),男,讲师,硕士,研究方向为生物学。
*通讯作者:徐君飞(1981-),女,讲师,博士,研究方向为食品生物技术。
