西洋参多糖的超滤分离及其免疫增强活性研究
2014-02-21杨修仕周闲容王丽君于晓娜石振兴任贵兴
杨修仕,周闲容,王丽君,于晓娜,4,石振兴,任贵兴,*,董 川
(1.山西大学环境科学与工程研究中心,山西太原030006;2.中国农业科学院作物科学研究所,北京100081; 3.中国农业科学院农产品加工研究所,北京100193;4.齐鲁工业大学食品与生物工程学院,山东济南250353)
西洋参(Panax quinquefolius L.),又名花旗参或广东人参,为五加科人参属植物。西洋参原产于美国北部到加拿大南部一带,在我国黑龙江、吉林、辽宁、陕西等地已有较大量栽培[1]。西洋参富含皂苷、多糖等生物活性物质,具备多种生理功效。西洋参根中含有约6%~10%的多糖,其具有增强免疫、抗流感、抗肿瘤等生理作用[2-5]。多糖的生理活性取决于其分子量大小、单糖组成、糖苷键等分子结构特征[6-8]。超滤作为一种新型的膜分离技术,具有设备简单、选择性高、能耗低等优点,已广泛应用于多糖、蛋白等热敏性物质的分离与纯化[9-11]。但应用超滤膜分离技术对西洋参多糖进行分离纯化的研究鲜见报道。本研究采用超滤技术,对西洋参根水提物进行分离,通过考察不同分子量段西洋参多糖的免疫增强活性,选择纯化具有免疫活性的西洋参多糖组分,以期为开发西洋参多糖保健食品提供理论基础。
1 材料与方法
1.1 材料与仪器
西洋参干燥根 黑龙江东渡参业有限公司,4年生;无水乙醇、苯酚、硫酸、吡啶、三氟乙酸 国药集团化学试剂北京有限公司,分析纯;甲醇 Merck公司,色谱纯;六甲基二硅氮烷、三甲基氯硅烷 Fluka公司;单糖对照品、DMEM培养基、RPMI1640培养基、脂多糖(LPS)、磷酸盐缓冲液(PBS)、Griess试剂 Sigma-A ldrich公司;青霉素、链霉素、胎牛血清 GE Healthcare Bio-Sciences公司;小鼠单核巨噬细胞白血病细胞(RAW 264.7) 中国科学院典型培养物保藏委员会细胞库;肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)及白介素-10(IL-10)试剂盒 南京建成生物工程研究所。
WK-400A小型高速粉碎机 山东青州市精诚医药装备制造有限公司;Amicon Stirred Cell Ultrafitration 8400超滤系统 德国Merck Millipore公司;VirTis冷冻干燥机 美国 SP Scientific公司; Agilent 6890气相色谱 美国Agilent公司;CB-53二氧化碳培养箱 德国 BINDER公司;Multiskan Spectrum酶标仪 美国Thermo Scientific公司。
1.2 实验方法
1.2.1 西洋参多糖的提取 西洋参多糖的提取参照任烨等[1]和于荣敏等[12]的方法,并做适当修改。采用高速粉碎机对西洋参干燥根进行破碎,并过60目筛。称取适量西洋参粉末于锥形瓶中,加入14倍量75%的乙醇,置于45℃水浴锅中,搅拌提取5h,以除去西洋参中的皂苷、脂类、色素等醇溶性成分。过滤,滤渣重复提取一次,收集滤渣,60℃烘干至恒重。称取适量烘干滤渣于锥形瓶中,加入14倍量的蒸馏水煮沸4h,于3800 r/m in离心10m in,分离上清和沉淀。沉淀重复提取1次,合并2次提取液,备用。
1.2.2 不同分子量段西洋参多糖的制备 西洋参多糖的超滤分离参照Lemmon等[13]和姚瑞祺等[14]的方法,并做适当修改。依次用5、1.2、0.45μm微滤膜除去西洋参多糖提取液中的固形物以降低对超滤膜的污染。控制超滤压力为0.08MPa,分别用分子截流量为100、30、10ku的超滤膜,将粗提物按分子量大小分为>100ku(AGP1)、30~100ku(AGP2)、10~30ku(AGP3)和<10ku(AGP4)四部分,冷冻干燥,称重,计算得率。各分子量段多糖所占的百分比按下式计算:

式中:W1为各分子量段多糖的质量;W0为四部分多糖的质量之和。
1.2.3 总糖含量测定 采用苯酚-硫酸法测定AGP1~AGP4中的总糖含量[15]。
1.2.4 单糖组成分析 单糖组成分析参照Yu等[16]和Guentas等[17]的方法,并做适当修改。称取AGP1~AGP4样品10mg,加入适量2mol/L的三氟乙酸,于120℃水解4h,冷却至室温,氮气吹干。依次加入1m L吡啶、0.4m L六甲基二硅氮烷、0.2m L三甲基氯硅烷,充分混匀,室温下反应5m in,并于1000 r/m in离心10min。取上清液进行气相分析。气相条件为: HP-5 MS毛细管柱(0.25mm×30m×0.25μm);不分流模式;后进样口温度,250℃;氢火焰离子化检测器温度,260℃;升温程序为100~150℃(5℃/m in),保持5m in,150~240℃(5°C/m in),保持3m in;载气为氮气,流速40.0m L/min;空气流速400m L/m in,氢气流速40m L/m in。
1.2.5 NO生成的测定 通过测定体外培养的巨噬细胞上清液中亚硝酸盐含量来表征其NO生成[18]。在无菌条件下将AGP1~AGP4用PBS溶解备用。将处于对数生长期的巨噬细胞调整密度为7.5×105个/m L,分为空白组(只含培养基)、实验组(1、10、50、100、300μg/m L的AGP1~AGP4)和阳性对照组(1μg/m L的LPS),于5%CO2浓度、37℃条件下培养24h。分别取各组上清液 50μL,加入 Griess试剂50μL,室温下反应15m in,于540nm测定吸光度。以NaNO2为对照品,绘制标准曲线,得到回归方程为: y=0.007x+0.002,R2=0.9990。计算上清液中的亚硝酸盐含量。
1.2.6 细胞因子生成的测定 将处于对数生长期的巨噬细胞调整密度为7.5×105个/m L,分为空白组(只含培养基)、实验组(1、50、150μg/m L的AGP1~AGP4)和阳性对照组(1μg/m L的LPS),于5%CO2浓度、37℃条件下培养24h。收集各组上清液,按照试剂盒标注方法,对TNF-α、IL-6及IL-10进行测定。于450nm和570nm双波长下测定吸光度值,绘制标准曲线,得到TNF-α、IL-6及IL-10的回归方程分别为:y=0.001x-0.018,R2=0.9953;y=0.001x+0.091,R2=0.9943;y=0.001x+0.029,R2=0.9925。计算上清液中的细胞因子的含量。
1.2.7 统计学分析 采用Microsoft Excel 2007进行数据整理,SPSS 19.0进行方差分析,数值以均值±标准差的形式表示。
2 结果与分析
2.1 不同分子量段西洋参多糖得率及其总糖含量和单糖组成
不同分子量段西洋参多糖的得率及单糖组成结果见表1。由表1可知,西洋参粗多糖的总得率(AGP1~AGP4之和)较低,为5.17%,一方面可能与提取工艺有关,另一方面,种植条件也可能造成西洋参原料含有的多糖本来就较少。四段多糖中,分子量>100ku的部分(AGP1)所占比例最高,约为46.61%,分子量为30~100ku的部分(AGP2)所占比例最低,约为 3.30%,分子量为 10~30ku的部分(AGP3)和分子量<10ku的部分(AGP4)所占比例分别为12.11%和37.98%。各分子量段多糖的总糖含量存在一定差异,AGP1的总糖含量最高,为56.55%,AGP4的总糖含量最低,为42.87%。四段多糖分别由6~8种单糖组成,均含有阿拉伯糖、鼠李糖、甘露糖、半乳糖、葡萄糖、葡萄糖醛酸。但不同分子量段多糖的单糖比例各不相同,其中,AGP1含有较多的甘露糖,AGP2含有较多的半乳糖和葡萄糖,AGP3含有较多的半乳糖醛酸和葡萄糖醛酸,AGP4含有较多的葡萄糖和葡萄糖醛酸。
2.2 西洋参多糖对巨噬细胞NO生成的影响
NO作为一种多功能的内源性生物信息分子,其在免疫系统的多种生理过程中均发挥着重要作用,是巨噬细胞发生免疫激活反应的重要因子[19]。不同分子量段西洋参多糖体外刺激巨噬细胞NO生成的实验结果见图1。由图1可知,与空白对照组相比,AGP1与AGP2具有良好的刺激巨噬细胞NO生成的活性,AGP3与AGP4的活性不明显。在1~50μg/m L浓度范围内,AGP1的活性随着浓度的增加而迅速增强,浓度达到50μg/m L后,活性增加的速度减缓。AGP2的活性在1~50μg/m L浓度范围内也呈现迅速增强,且在50μg/m L时达到最强,随后略有降低。在10μg/m L的浓度下,AGP2的活性显著高于 AGP1 (p<0.05),但在其他浓度下,两者的活性不存在显著差异(p>0.05)。当AGP1和AGP2的浓度分别达到50μg/m L和10μg/m L以上时,二者对巨噬细胞NO生成的促进作用与阳性对照之间无显著差异。

表1 不同分子量段西洋参多糖的得率及其总糖含量和单糖组成Table1 Yield,total sugar content and monosaccharide composition of American ginseng polysaccharides in differentmolecular weight range
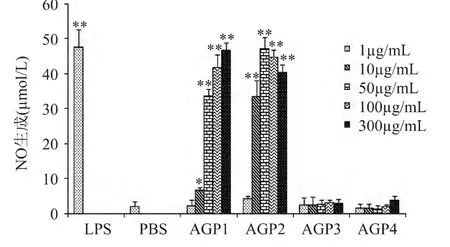
图1 不同分子量段西洋参多糖对巨噬细胞NO生成的影响Fig.1 Effect of American ginseng polysaccharide in differentmolecular weight range on NO production ofmacrophages
2.3 西洋参多糖对巨噬细胞TNF-α生成的影响
巨噬细胞被激活后,迅速表达各种细胞因子,介导宿主细胞的免疫反应,进而增强机体免疫能力。由图2可知,与空白对照相比,AGP1与AGP2可促进巨噬细胞TNF-α的生成,AGP3与AGP4的促进作用不明显。在1~150μg/m L浓度范围内,AGP1与AGP2的活性均随浓度增加而增强,且二者在相同浓度下的活性不存在显著差异。但AGP2在相同浓度下刺激巨噬细胞产生的 TNF-α的浓度值均略高于AGP1。当AGP1和AGP2的浓度达到150μg/m L时,二者对巨噬细胞TNF-α生成的促进作用与阳性对照之间无显著差异。不同分子量段西洋参多糖促进巨噬细胞TNF-α生成的实验结果与2.2中促进NO生成的结果较为一致。
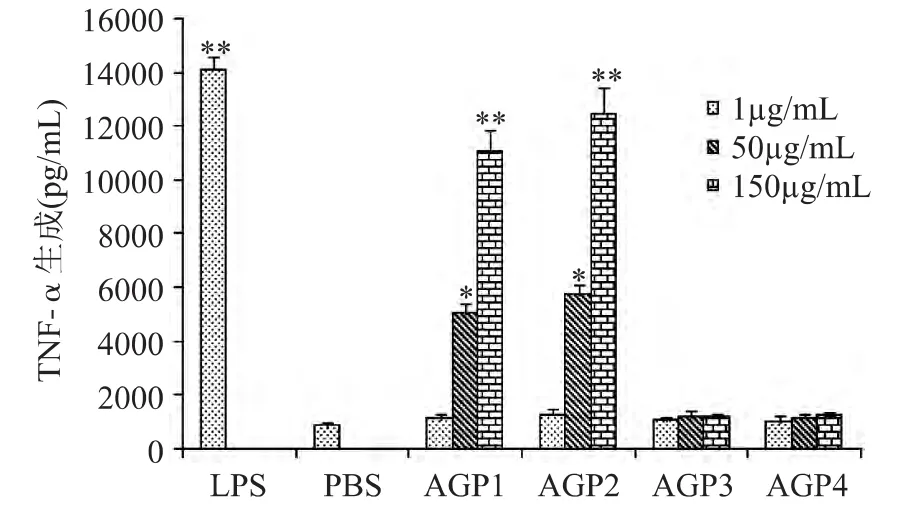
图2 不同分子量段西洋参多糖对巨噬细胞TNF-α生成的影响Fig.2 Effect of American ginseng polysaccharide in differentmolecular weight range on TNF-αproduction ofmacrophages
2.4 西洋参多糖对巨噬细胞IL-6生成的影响
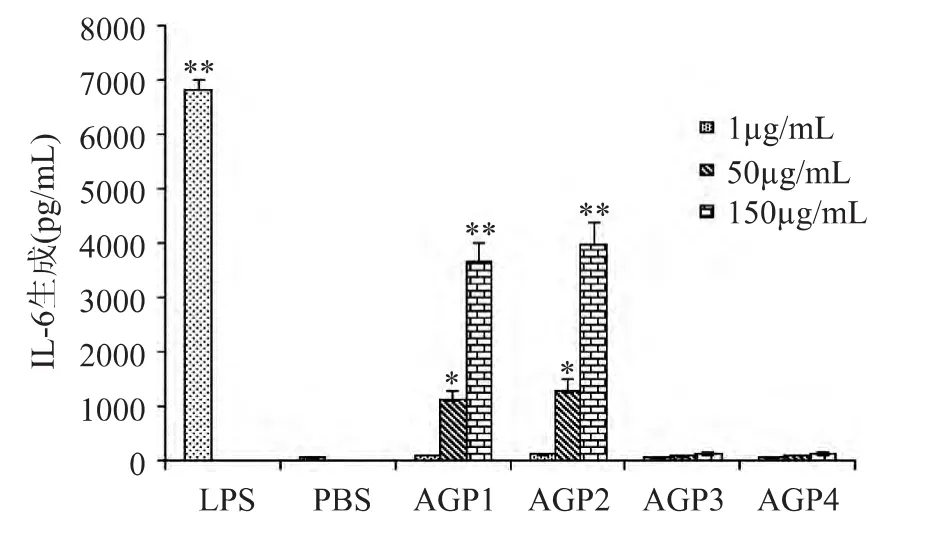
图3 不同分子量段西洋参多糖对巨噬细胞IL-6生成的影响Fig.3 Effect of American ginseng polysaccharide in differentmolecular weight range on IL-6 production ofmacrophages
西洋参多糖体外刺激巨噬细胞IL-6生成的实验结果见图3。由图3可知,与空白对照组相比,AGP1与AGP2可促进巨噬细胞IL-6的生成,AGP3与AGP4几乎无促进作用。在1~150μg/m L浓度范围内,AGP1与AGP2的活性均随浓度增加而增强,同时,二者的活性在相同浓度下均不存在显著差异。但AGP2在相同浓度下刺激巨噬细胞产生的IL-6的浓度值均略高于AGP1。当AGP1和AGP2的浓度达到150μg/m L时,二者对巨噬细胞IL-6生成的促进作用与阳性对照之间无显著性差异。不同分子量段西洋参多糖促进巨噬细胞IL-6生成的结果与2.3中促进TNF-α生成的结果一致。
2.5 西洋参多糖对巨噬细胞IL-10生成的影响
西洋参多糖体外刺激巨噬细胞IL-10生成的实验结果见图4。由图4可知,与空白对照组相比,AGP1与AGP2可促进巨噬细胞IL-10的生成,而AGP3与AGP4几乎无促进作用。在1~150μg/m L浓度范围内,AGP1与AGP2的活性均随浓度增加而增强。但从IL-10生成值来看,AGP2在相同浓度下刺激巨噬细胞产生的IL-10的浓度值均略高于AGP1。当AGP1和AGP2的浓度达到150μg/m L时,二者对巨噬细胞IL-10生成的促进作用与阳性对照之间无显著性差异。不同分子量段西洋参多糖促进巨噬细胞IL-10生成的结果与其促进TNF-α及IL-6生成的结果一致。
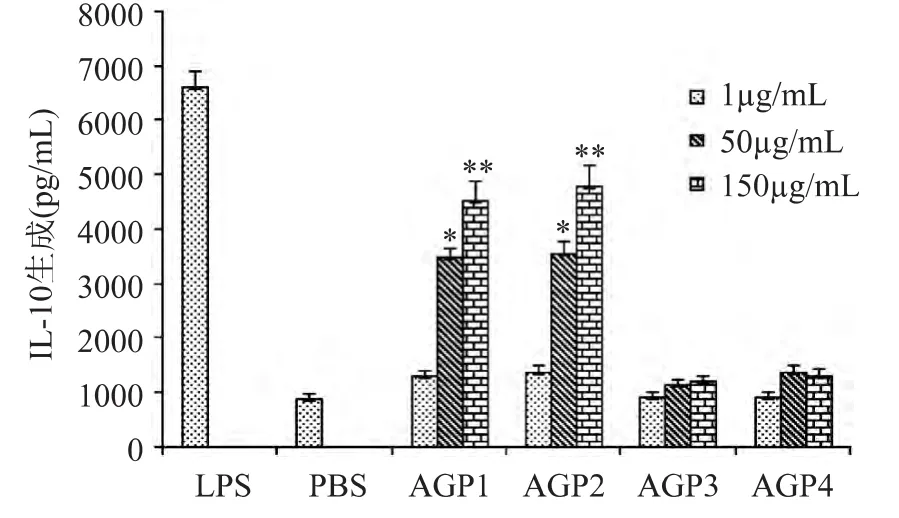
图4 不同分子量段西洋参多糖对巨噬细胞IL-10生成的影响Fig.4 Effect of American ginseng polysaccharide in differentmolecular weight range on IL-10 production ofmacrophages
3 讨论
机体免疫力的降低容易导致多种疾病的发生。如何提高机体免疫力是科学界的一个研究热点。近年来,国内外学者对西洋参多糖的免疫活性进行了研究,证实了西洋参多糖可促进巨噬细胞多种细胞因子的表达,具有免疫增强作用[2-3,5]。但相关研究多以西洋参中的全部分子量范围的多糖为研究对象,缺乏对不同分子量段范围多糖的免疫活性研究。
膜分离技术近年来已广泛应用于多糖、蛋白等大分子的分离纯化。本研究采用超滤法分离得到四种不同分子量段的西洋参多糖,四者的单糖组成存在一定差异。朱丽娜等[9]采用超滤法从蛹虫草分离得到的免疫活性最强多糖组分的单糖组成为鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖,且甘露糖约占57.6%。本研究中,AGP1也含有此6种单糖组分,其甘露糖含量较高,且表现出了较强的免疫活性。因此,我们推测,含有类似单糖组成,且甘露糖含量较高的多糖可能具有较强的免疫活性。
除单糖组成外,多糖的免疫调节活性与其分子量也密切相关。本研究中得到的西洋参多糖分子量不同,其免疫活性也应存在差异。通过测定巨噬细胞NO及细胞因子生成,我们发现不同分子量段西洋参多糖的免疫活性确实存在较大差异。分子量大于100ku(AGP1)以及分子量在30~100ku(AGP2)的西洋参多糖均表现出刺激巨噬细胞NO、TNF-α、IL-6及IL-10生成的活性。但分子量小于30ku的西洋参多糖(AGP3与AGP4)均未表现出免疫增强活性。朱丽娜等[9]和杨阳等[10]的研究表明,分子量大于100ku的多糖具有较好的免疫调节活性。本研究也表明,分子量大于100ku的的多糖具有免疫增强活性,且其所占比例达46.61%。同时,我们还发现分子量在30~100ku的西洋参多糖具有更强的促进巨噬细胞生成NO和细胞因子的活性。
本研究采用超滤技术得到具有免疫活性的不同多糖组分,并未针对提取液进行除淀粉和除蛋白等工艺处理,因此得到的多糖组分中可能含有部分淀粉和蛋白。淀粉通常不具有显著的免疫增强作用,而多糖组分中的蛋白是否具有免疫增强活性还有待进一步研究。但在开发保健食品时,若此部分蛋白有免疫增强活性,则无需将其从组分中分离。
4 结论
采用超滤分离得到四个不同分子量段的西洋参多糖组分,总糖含量及单糖组成分析表明四者总糖含量及单糖组分均存在一定差异。免疫增强活性研究表明,分子量大于30ku的西洋参多糖的具有较强的刺激巨噬细胞NO、TNF-α、IL-6及IL-10生成的活性。本研究采用超滤技术选择纯化具有免疫活性的西洋参多糖组分,相关结果可为西洋参多糖增强免疫类保健食品的开发提供理论支撑。
[1]任烨,李厚聪,刘永恒,等.加拿大原产地西洋参多糖提取工艺优化研究[J].西南民族大学学报:自然科学版,2011,37 (6):940-945.
[2]Wang M,Guilbert LJ,Li J,et al.A proprietary extract from North American ginseng(Panax quinquefolium)enhances IL-2 and IFN-g productions inmurine spleen cells induced by Con-A[J].Int Immunopharmacol,2004,4(2):311-315.
[3]于永超,张佳丽,林兵,等.西洋参多糖对钴-60辐照小鼠的免疫调节作用[J].现代预防医学,2012,39(11):2685-2687.
[4]Mcelhaney JE,Simor AE,Mcneil S,et al.Efficacy and safety of CVT-E002,a proprietary extract of Panax quinquefolius in the prevention of respiratory infections in influenza-vaccinated community-dwelling adults:a multicenter,randomized,double-Blind,and placebo-controlled trial[J].Influenza Res Treat,2011,2011:1-8.
[5]朴云峰,明月,李靖涛.西洋参多糖I、II、III对肝癌细胞DNA合成抑制作用的研究[J].临床肝胆病杂志,1999,5(4): 213-214.
[6]刘宗林.西洋参茎叶水溶性多糖结构分析及其生理活性的研究[J].食品工业科技,2001,22(2):20-21.
[7]杨晓杰,陈静,程加春,等.蒲公英多糖的超滤分离及其清除自由基的作用研究[J].时珍国医国药,2009,20(11): 2692-2694.
[8]卢茳虹,林宗毅,崔春,等.柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J].食品工业科技,2012,33(23): 93-96.
[9]朱丽娜,周帅,刘艳芳,等.不同分子量段蛹虫草多糖的超滤分离及其对巨噬细胞释放NO的影响[J].食用菌学报,2011,18(4):47-50.
[10]杨阳,刘承初,贾薇,等.灰树花多糖的超滤分离及免疫活性研究[J].食品科学,2008,29(9):277-280.
[11]姜帆,韩建春,陈成,等.超滤法分级纯化五味子多糖及其影响因素的研究[J].食品工业科技,2012,33(20): 276-279.
[12]于荣敏,陈敏青,杨威.转基因西洋参冠瘿组织中多糖组分提取条件的优化考察[J].时珍国医国药,2007,18(8): 1806-1808.
[13]Lemmon HR,Sham J,Chau LA,et al.High molecular weight polysaccharides are key immunomodulators in North American ginseng extracts:Characterization of the ginseng genetic signature in primary human immune cells[J].JEthnopharmacol,2012,142 (1):1-13.
[14]姚瑞祺,刘海英,牛鹏飞,等.不同分子量枸杞多糖的超滤法分离及抗氧化活性研究[J].食品工业科技,2008,29(5): 89-91.
[15]张维杰.糖复合物生化研究技术[M].第二版.杭州:浙江大学出版社,1999:11-12.
[16]Yu R,Wang L,Zhang H,et al.Isolation,purification and identification of polysaccharides from cultured Cordycepsmilitaris[J].Fitoterapia,2004,75(7-8):662-666.
[17]Guentas L,Pheulpin P,Michaud P,et al.Structure of a polysaccharide from a Rhizobium species containing 2-deoxybeta-D-arabino-hexuronic acid[J].Carbohydr Res,2001,332 (2):167-173.
[18]Byeon SE,Lee J,Kim JH,et al.Molecular mechanism of macrophage activation by red ginseng acidic polysaccharide from Korean red ginseng[J].Mediators Inflamm,2012,2012:1-7.
[19]Banskota AH,Stefanova R,Sperker S,et al.Five new galactolipids from the freshwater microalga Porphyridium aerugineum and their nitric oxide inhibitory activity[J].JApplied Phycol,2012,25(4):951-960.
