枣叶黄酮体外及皮肤荧光斑马鱼体内抗氧化活性研究
2014-02-21李全国楚杰陈锡强王君高吴晓敏刘可春
李全国,楚杰,陈锡强,王君高,吴晓敏,刘可春
(1 齐鲁工业大学食品与生物工程学院,济南 250353;山东省科学院生物研究所,济南 250014)
乐陵以盛产金丝小枣而著名,有着“金丝小枣之乡”、“百里枣乡”等美誉。近年来,乐陵市实施了红枣富民战略,使得枣树的种植面积大幅度的增长,现在全市拥有的枣树已经达到2000多万株,年产干枣突破1亿公斤,是全国红枣产量的十分之一[1-2]。如此巨大的种植规模,对于枣叶的充分利用具有极大的意义。枣叶在宁心安神,提高睡眠质量等方面具有很好的功效,具有“东方睡叶”的美称[3]。因此,枣叶是一种极具价值的天然保健饮品和药用资源。
枣叶中含有大量的生物活性物质,其中黄酮类化合物是主要成分之一,黄酮类化合物具有抗氧化和清除自由基的能力,另外黄酮还具有抗炎、抗衰老、抗肿瘤[4-5]以及改善血液循环,降低胆固醇[6]等多种生物活性,而且由于是直接从可食用的植物中提取,大大的提高了黄酮本身的安全性,因而引起了人们对黄酮研究的极大关注。斑马鱼是淡水水族箱观赏鱼,由于其基因与人类基因有着 87%的相似,因此被广泛地应用于生命科学研究。皮肤荧光斑马鱼是将荧光蛋白标记在角质细胞上,在荧光显微镜下观察计数角质细胞,然后加入甲硝唑来使得角质细胞凋亡,然后再加入抗氧化物质,使有一部分角质细胞的荧光得以表达,从而来测定药物的抗氧化能力。人体内自由基是与生俱来的,适量的自由基可以帮助维持生命的活力[7],也可以帮助排除毒素,但是过多的自由基会对人体产生危害,例如破坏细胞膜,使血清抗蛋白酶失去活性,从而产生炎症以及损伤基因导致肿瘤等[8]。因此研究具有清除自由基作用的黄酮类物质具有重要意义。本文通过体外及体内实验考察乐陵枣叶总黄酮类物质的抗氧化能力,同时以VC作为对照,为枣叶的综合利用提供参考依据。
1 材料与方法
1.1 材料与仪器
芦丁对照品 南京泽朗医药科技有限公司;DPPH 梯希爱(上海)化成发展有限公司;麻醉剂Tric-ainc MS222,Sigma公司;水为双蒸水;斑马鱼培养水配方[9]为5mmol/L NaCl,0.17 mmol/L KCL,0.14 mmol/L CaCl2,0.16 mmol/L MgSO4;黄酮溶液40mg/m L,Vc40 mg/m L,甲硝唑溶液2.5mol/L(DMSO溶解);Vc、DMSO、亚硝酸钠、硝酸铝、硫酸亚铁、水杨酸、双氧水、氢氧化钠、无水乙醇等试剂均为分析纯。转基因皮肤荧光斑马鱼 cy17(krt4-NTR:GFP) 山东省科学院生物研究所繁殖。
RE-6000 旋转蒸发仪 上海亚荣生化仪器厂;UV-2100型紫外可见分光光度计 上海合利仪器有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;电热恒温水浴锅 上海贺德实验设备有限公司;Olympus SZX-16 型荧光显微镜日本Olympus 公司;恒温培养箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 乐陵枣叶总黄酮提取及含量测定
1.2.1.1 乐陵枣叶总黄酮提取 准确称取已粉碎过20目筛的枣叶于蒸馏瓶中,加入浓度为50%的乙醇,1:10的料液比,70℃下回流1h,离心,取上清液,浓缩,过大孔树脂柱,旋转浓缩,真空干燥得总黄酮[10]。
1.2.1.2 乐陵枣叶总黄酮的含量测定 准确吸取枣叶总黄酮浓缩液 1mL稀释 10倍,按照文献[10]中的方法在 510nm处测定吸光度,代入标准曲线计算出枣叶中总黄酮的浓度,再按照以下公式计算出枣叶中总黄酮的含量。

1.2.2 乐陵枣叶总黄酮体外抗氧化活性实验 采用 DPPH法、水杨酸法和邻苯三酚自氧化法来进行抗氧化试验,测定了总黄酮的的总还原力,同时以Vc为阳性对照。
1.2.2.1 DPPH·的清除试验 实验前配制质量浓度为0.2、0.4、0.6、0.8、1.0mg/m L的枣叶黄酮和Vc溶液。同时用无水乙醇配制0.1mmol/L的DPPH溶液,置于棕色瓶中备用。用移液枪准确吸取不同浓度的黄酮溶液1mL置于试管中,同时加入3m L 刚配制的DPPH乙醇溶液,混合均匀,于暗处反应30min,在517nm波长处测定吸光度。同时用等浓度的Vc溶液作为阳性对照。DPPH自由基的清除率计算公式,
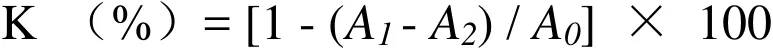
其中,A1为样品溶液的吸光度,A2为未添加DPPH的吸光度,A0为未添加样品溶液的吸光度。
1.2.2.2 清除羟基自由基能力的测定 配制黄酮质量浓度为 0.2、0.4、0.6、0.8、1.0mg/m L以及2mmol/L 的二氯化铁、2mmol/L 的过氧化氢溶液和6mmol/L 的水杨酸乙醇溶液。在试管中加入2m L的黄酮样品溶液、2mmol/L的二氯化铁、2m L 2mmol/L 的过氧化氢溶液和 2m L 6mmol/L 的水杨酸,混合均匀,再添加10m L蒸馏水,混合后于37℃的水浴锅中反应30min。在510nm波长处测定其吸光值。同时以Vc以相同的浓度做阳性对照进行测定。羟基自由基清除率计算公式,
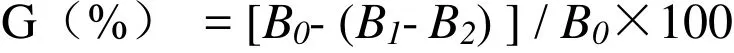
其中,B0为空白对照溶液的吸光度,B1为样品溶液的吸光度,B2为未添加过氧化氢溶液的吸光度。
1.2.2.3 清除超氧阴离子自由基能力的测定 实验前配制质量浓度为0.2、0.4、0.6、0.8、1.0mg/m L的黄酮溶液及0.05mol/L Tris-HCl(pH8.2)的缓冲液、0.025mol/L邻苯三酚溶液、8mmol/L的盐酸溶液。取试管,加入4.5m L 0.05mol/L Tris-HCl (pH8.2)的缓冲液置于25℃的水浴锅中预热20min,再加入1mL不同浓度的样品溶液和0.4m L 0.025mol/L 的邻苯三酚溶液,混匀。将混匀的溶液放置于25℃水浴中反应4min,迅速加入1.0m L 8mmol/L的盐酸溶液终止反应。在320nm处测定其吸光度,同时以Vc做为阳性对照。超氧阴离子自由基清除率计算公式:
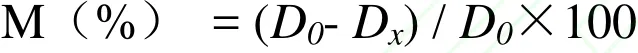
其中,D0为空白对照溶液的吸光度;Dx为加入样品溶液的吸光度。
1.2.2.4 还原能力的测定 用移液枪准确取2.5m L不同质量浓度的黄酮溶液加入到试管中,然后加入2.5mL 0.2mol/L pH6.6 的H3PO4缓冲液,再添加2.5mL 1%的K3Fe(CN)6溶液后混匀。置于50℃的水浴锅中反应20min后,再加入2.5m L10%的C2HCl3O2溶液,混匀后在离心机中以3000 r/m in的转速离心10m in,取离心后的上清液5m L加入已添加0.5m L 0.1%的FeCl3溶液和4m L蒸馏水的试管中,混匀。10min后于700nm处测定其吸光度。同时以Vc做为对照。
1.2.3 斑马鱼体内抗氧化活性的研究
1.2.3.1 斑马鱼抗氧化原理 皮肤荧光斑马鱼是将荧光蛋白标记在角质细胞上,对角质细胞进行计数,如果一个细胞内的自由基导致了细胞损伤,就会使得线粒体膜穿孔,这些小孔允许细胞色素C到达细胞质中,使得细胞色素C与Apaf-1结合形成聚合体,这些聚合体需要ATP提供能量, 进而使得caspase-9裂解为caspase-3和caspase-7,这些裂解的caspase能够激活蛋白水解酶,使得蛋白水解,DNA降解。通过加入抗氧化药物来清除细胞内的自由基,从而减少细胞凋亡。转基因斑马鱼在荧光显微镜下,皮肤上显示许多绿色的荧光亮斑点,加入甲硝唑后,荧光斑点会消失,再加入抗氧化药物荧光斑点会恢复。利用这样的特性进行抗氧化实验,统计荧光斑点可以测定药物的相对抗氧化能力。
1.2.3.2 斑马鱼胚胎的准备 斑马鱼的养殖方法参照 Westerfield[11]的方法,选择成熟的斑马鱼,按照雌鱼与雄鱼1:1或者1:2的比例置入繁殖缸内,次日清晨取出受精卵,加入亚甲基蓝溶液,放入28℃培养箱中孵化,备用。
1.2.3.3 实验分组与给药 将孵化24h的斑马鱼胚胎取出,放置于1mg/m L的链霉蛋白酶溶液中约10min左右,脱去斑马鱼胚胎外层的卵膜。将脱去卵膜的斑马鱼胚胎随机分成溶剂对照组、甲硝唑组、黄酮组(20、50、100μL)、Vc组(20、50、100μL),每组胚胎6个,同时设置一个副孔,加入24孔板中,每组实验进行三次。
根据实验分组,在每个孔中加入 2m L培养水,溶剂对照组再加入 8µL的DMSO,甲硝唑组加入8µL 2.5mol/L的甲硝唑溶液,黄酮组和Vc组在加入与甲硝唑相同的甲硝唑溶液之后,同时按照各自的浓度加入不同量的40mg/m L的黄酮和Vc溶液。
将给药后的24孔板置于28℃的恒温培养箱中进行培养,24h之后取出,在荧光显微镜下观察斑马鱼的生长状况以及皮肤荧光的强弱,同时为防止拍照过程中斑马鱼不断的游动,在每个24孔板中加入适量的三卡因溶液对斑马鱼进行麻醉。利用imagepro-plus软件统计各组的荧光点数量,再利用SPSS软件对数据进行统计分析。
相对抗氧化能力(%)=(给药组荧光角质细胞数量-甲硝唑组荧光角质细胞数量)/(溶剂对照组角质细胞数量-甲硝唑组荧光角质细胞数量)×100
2 结果与讨论
2.1 总黄酮含量测定
吸取总黄酮浓缩液1m L参照1.2.3中的方法,计算出枣叶中总黄酮的含量为6.0372mg/g。
2.2 DPPH·的清除试验
DPPH具有孤对电子,在517nm处有较强的吸收,当加入自由基清除剂时,孤电子配对形成电子对,导致吸收降低。因此可以用分光光度计进行定量的测定[12]。总黄酮对DPPH自由基的清除作用如图1
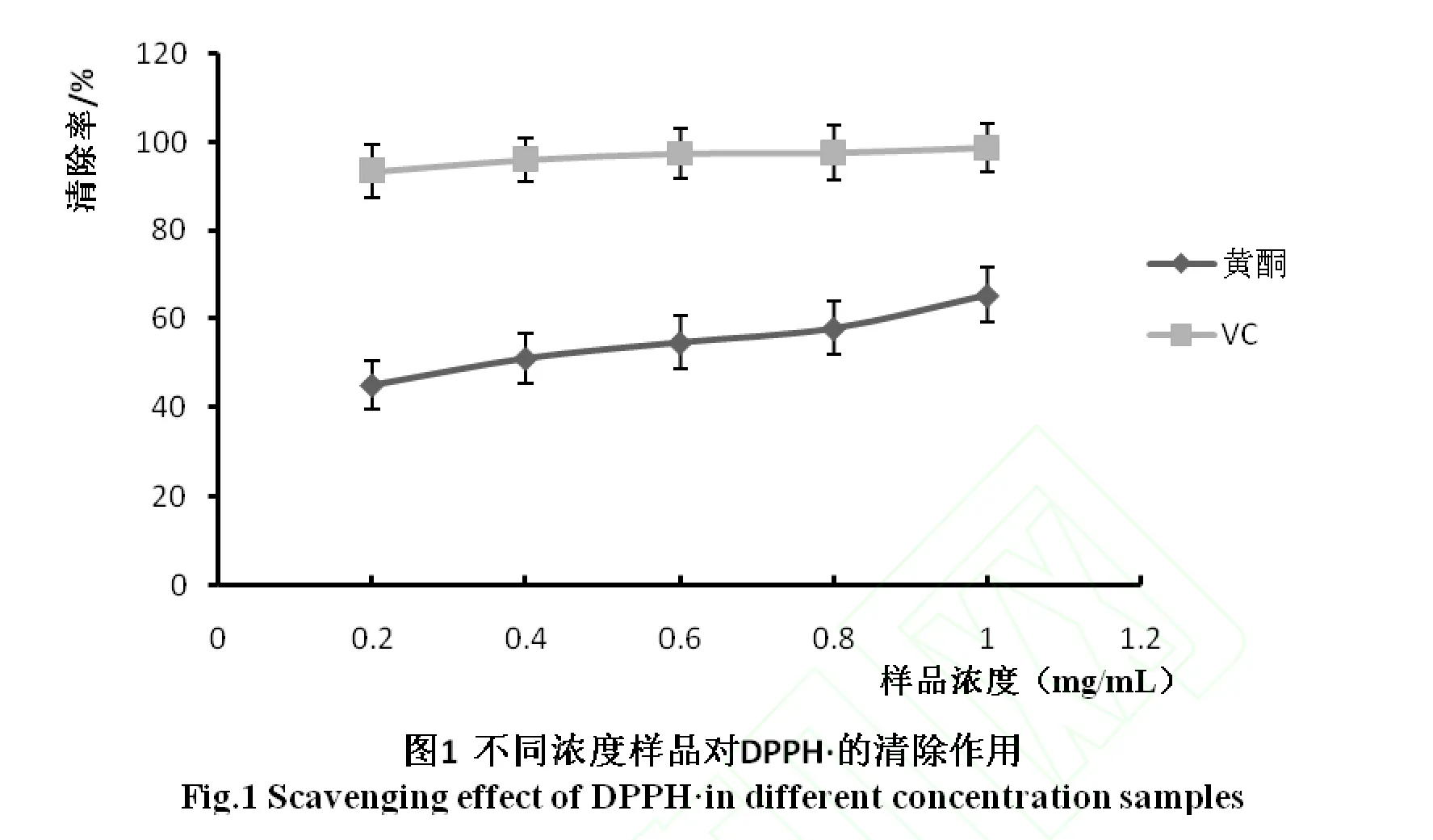
如图1所示,总黄酮对DPPH自由基的清除作用随着样品浓度的增加而增大。样品浓度从 0.2mg/m L到 1mg/m L,对 DPPH自由基的清除率从 45.2%增大到65.4%,而在相同的质量浓度变化范围下,Vc对DPPH自由基的清除从93.4%增大到98.7%,因此与同等质量浓度的Vc相比,样品的清除率低于Vc的清除率。与周劝娥等报道[13]的结果基本一致。
2.3 清除羟基自由基能力的测定
羟基自由基是一种重要的活性氧,具有极强的得电子能力,能够引起基因的氧化损伤,是目前认为毒性最强的自由基[14]。通过水杨酸比色法测定枣叶总黄酮对羟基自由基的清除能力,实验结果如图2所示。
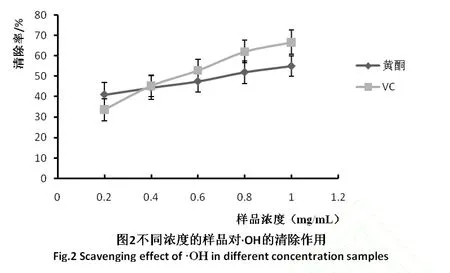
由图2可以看出随着样品浓度的不断增大,样品对羟基自由基的清除能力呈现不断增大的趋势,说明对羟基自由基的清除能力与样品的浓度呈现较好的量效关系。由图2可知,当样品的浓度由0.2mg/m L增加到1.0mg/m L时,其对羟基自由基的清除率也由 40%增大到了 55%。说明提取物对羟基自由基有着较好的清除作用。这与阎娥等报道[15]的实验结果趋势相同。
2.4 清除超氧阴离子自由基能力的测定
超氧阴离子自由基是代谢过程中第一个生成氧的自由基,具有非常强的氧化能力,又能够转化为其它氧自由基。因此,超氧阴离子自由基是其它氧自由基的部分源头,清除超氧阴离子自由基能够显著的减少氧自由基的生成。通过邻苯三酚自氧化法[16]产生超氧阴离子自由基来测定样品的清除作用,实验结果如图3所示。
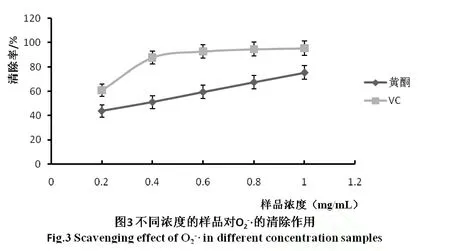
由图3可以看出,样品浓度与对超氧阴离子自由基的清除率有着良好的线性关系。当样品的浓度由0.2mg/m L增加到1.0mg/m L时,其对超氧阴离子自由基的清除率由 43%增加到 76%。说明提取物对超氧阴离子的清除作用随着提取物浓度的而升高,其对超氧阴离子自由基具有较好的清除作用。样品浓度为0.2mg/m L时,样品对超氧阴离子自由基的清除作用就达到了 43.7%,与对照品Vc相比较而言,在相同的质量浓度下,清除作用还是稍微弱一些。
2.5 还原力实验
某种物质还原力的大小能够在一定程度上反映这种物质清除自由基能力的强弱,研究表明,物质的还原力越大,其抗氧化能力越强。通过显色反应测量某种物质将Fe3+还原成Fe2+的能力,在700nm处测定其吸光度,吸光度值越大,说明其还原能力越大[17]。样品的还原力实验结果如图4所示。
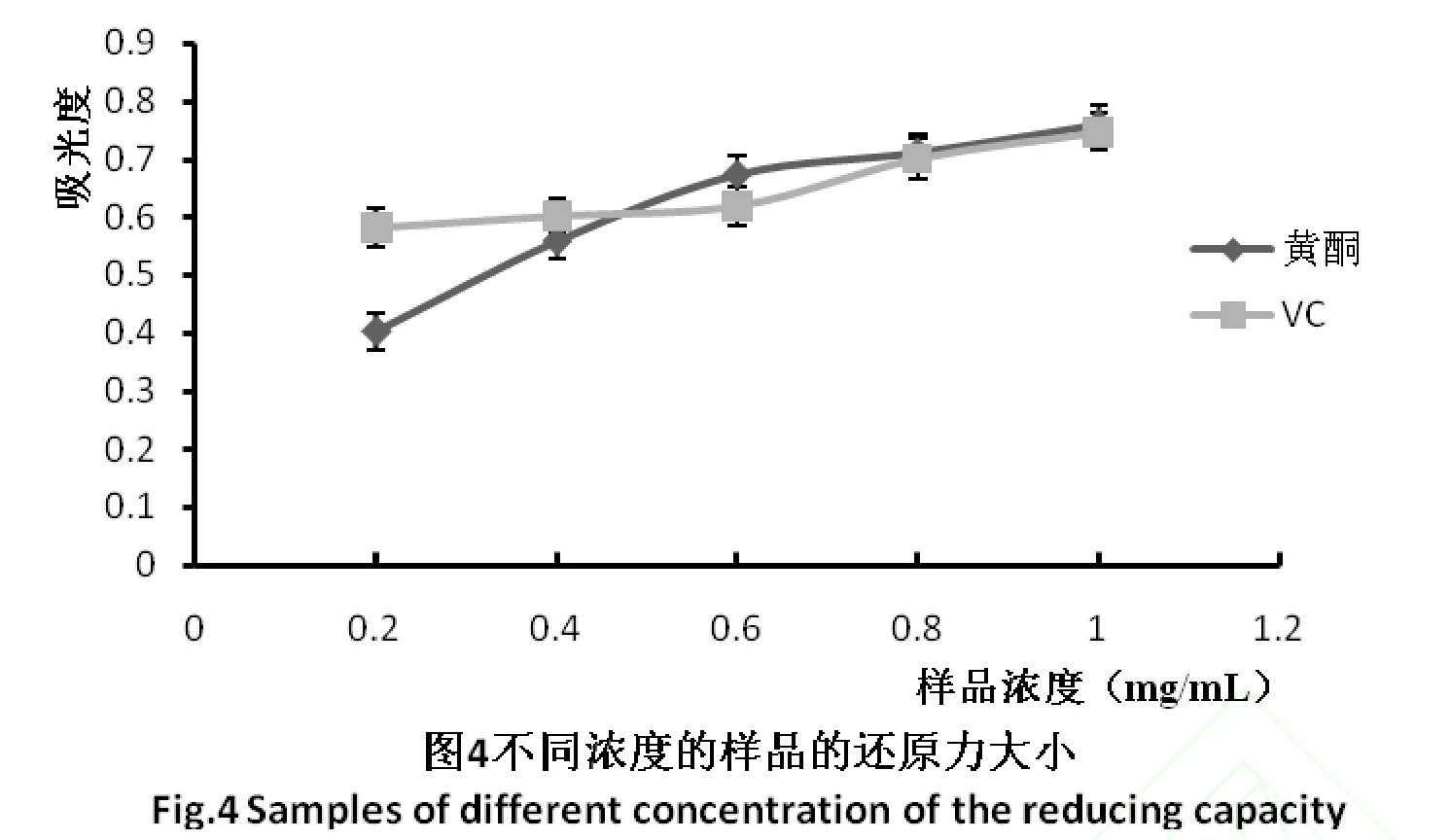
由图4可以看出,随着样品浓度的增加,样品的吸光度越大,还原力越大。当样品的质量浓度达到1.0mg/m L时,样品的吸光度为0.76,在相同的质量浓度下,Vc的吸光度为0.75。表明样品具有较强的还原力。
2.6 斑马鱼抗氧化活性
实验结果如表1所示,荧光图片如图5所示。

表1 黄酮对皮肤荧光斑马鱼胚胎生成的影响Table1 Effect of flavonoids on the skin fluorescent zebrafish embryo formation
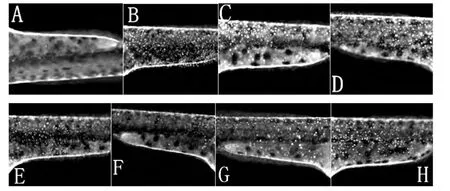
图5 黄酮对斑马鱼的抗氧化活性的影响Fig.5 Effects of flavonoids on the skin fluorescent zebrafish embryo formation
由表1可见,溶剂对照组中,斑马鱼的皮肤荧光点最多,加入甲硝唑后绝大部分荧光点消失,结果如图5中的A所示,再加入样品后,荧光点能够再次更多的被观察到,说明样品有抗氧化活性。随着样品浓度的增加,荧光点越多,说明样品的抗氧化能力增强。
3 结论
本文通过提取乐陵枣叶中的黄酮进行抗氧化研究,结果发现提取的黄酮类物质具有较好的还原力,对DPPH·、·OH和O·清除率随着质量浓度的增大而升高,说明有着明显的量效关系,当样品的浓度达到1mg/m L时,其对DPPH·、·OH和O·清除率分别达到了65.4%、55%和75.5%,同时在还原力测定中,吸光度值为0.76,与同浓度的VC相比,还原力相差不大,表明枣叶黄酮具有较好的还原力。同时从斑马鱼的抗氧化活性实验发现,通过添加甲硝唑消除荧光点后,再添加提取物后,斑马鱼皮肤上的荧光点能够重新在显微镜下观察到,添加量为100µg/mL时,相对抗氧化率能够达到77.8%,说明乐陵枣叶黄酮具有良好的抗氧化活性。本研究为乐陵枣叶的开发利用提供了理论依据。
[1] 金旺.乐陵金丝小枣[J].农业知识, 2013, (5): 50-51.
[2] 郭文场, 杨伯明, 赵吉成.乐陵金丝小枣[J].植物杂志, 1998, (3): 13-14.
[3] 王僧虎, 石晓云.邢台山区野生酸枣叶成分测定及开发利用[J].北方园艺, 2012, (17): 39-40.
[4] Pihlanto,A.Antioxidative peptides derived from milk proteins[J]International Dairy Journal, 2006,11(16):1306-1314.
[5] Reddivari L, Vanamala J, Chintharlapalli S,et al.Anthocyanin fraction from potato extracts is cytotoxic to prostatecancer cells through activation of caspase: independent pathways[J].Carcinogenesis, 2007, 28(10): 2227-2235.
[6] Martin,H.D., Beutner,S, Frixel,S, et al.Modified Flavonoidsas strong photoprotecting UV-Absorbers and Antioxi-dants[J].Chemische Vereniging,2003,1:288-291.
[7] 蔡凌云, 韩素菊, 肖杭, 等.密蒙花总黄酮抗氧化活性[J].光谱实验室, 2011, 28(3): 1343-1346.
[8] 李怡歆.自由基与人体健康[J].中国科技信息, 2008, (10): 181-182.
[9] 陈锡强, 侯海荣, 刘可春,等.西黄丸及其拆方药味对斑马鱼胚胎血管生成的影响[J].现代药物与临床, 2011, 26(1): 50-53.
[10] 李全国, 楚杰, 王君高,等.乐陵枣叶中总黄酮提取工艺研究[J].中国食物与营养, 2013, 19(7): 51-54.
[11] Westerfield M, Wegner J, Jegalian B G.Specific activation of mammalian Hox promoters in mosaic transgenic zebrafish [J].Genes Dev, 1992, 6(4): 591-598.
[12] 曹旭,曹剑锋,陈靠山.牛蒡根总黄酮抗氧化活性研究[J].食品工业科技, 2012, (19): 138-146.
[13] 周劝娥, 田呈瑞, 关为,等.陕西苦菜叶总黄酮的提取及抗氧化活性的测定[J].食品工业科技, 2013, (9): 97-102.
[14] 刘文颖, 徐亚光, 刘艳,等.液相法微量检测胶原肽清除羟基自由基能力[J].食品科技, 2011, 36(1): 265-268.
[15] 阎娥, 石玉萍, 王永宁, 等.沙枣叶中提取的总黄酮化合物对羟基自由基的清除作用[J].青海大学学报(自然科学版), 2006, 24(3): 65-67.
[16] 韩少华, 朱靖博, 王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造, 2009, (6): 155-157.
[17] Yen,G.C., Duh,P.D.Antioxidative Properties of Methanolic Extracts from Peanut Hulls [J] Journal of the American Oil Chemists’ Society, 1993, 70: 383~386.
