毕赤酵母发酵生产甲醇蛋白工艺条件的优化
2014-02-20苟万晓卫红伟胡元森王乐
苟万晓,卫红伟,胡元森,王乐*
(1.义马煤业集团煤生化高科技工程有限公司,河南义马472300;2.河南工业大学生物工程学院,河南郑州450001)
毕赤酵母发酵生产甲醇蛋白工艺条件的优化
苟万晓1,卫红伟2,胡元森2,王乐2*
(1.义马煤业集团煤生化高科技工程有限公司,河南义马472300;2.河南工业大学生物工程学院,河南郑州450001)
利用实验室选育驯化出的高产甲醇蛋白的毕赤酵母(Pichia pastorisYM-SCP02)作为甲醇蛋白生产菌种,对甲醇蛋白发酵生产过程中的关键因素进行较为全面的考察和优化,初步确定了摇瓶水平发酵各因素的最优条件为接种量8%,分段发酵温度采用0~36 h,30℃,36~64 h,28℃,初始pH值为5.0,初始甲醇添加量为1.2%,装液量为50 mL/250 mL摇瓶,转速为200 r/min。在此条件下,得到的甲醇蛋白最高产量(细胞干质量)为19.3 g/L。
甲醇蛋白;毕赤酵母;发酵;工艺条件;优化
以工业甲醇为原料生产出来的甲醇蛋白被称之为第二代单细胞蛋白,与天然蛋白相比,其粗蛋白含量比鱼粉和大豆都要高,且含有丰富的必需氨基酸、矿物质和维生素,可以部分替代鱼粉、大豆、骨粉、肉类以及脱脂奶粉[1-2]。而且甲醇蛋白的原料易得、资源相对丰富、不占耕地、不依赖海洋、生产不受气候条件影响、生产速度快[3]。甲醇蛋白生产成本低,以甲醇蛋白代替传统的鱼粉和豆类等蛋白,无疑会降低饲料成本,提高饲养效率,加速我国饲料工业的发展[4-6]。同时,利用现代微生物技术开发无粮食型,高效能生产蛋白质营养饲料是有力推进我国饲料工业发展的必要手段,是解决目前蛋白饲料短缺,依赖进口这一矛盾的有效途径[7-9]。
巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达外源蛋白的表达系统,具有遗传稳定、表达水平高、蛋白可翻译后加工、产物可分泌、可高密度发酵等许多优点,应用十分广泛[6]。毕赤酵母具有强烈的好氧生长偏好性,可进行细胞高密度培养,且由于自身分泌到培养基中的蛋白很少,因此纯化方便,利于大规模工业化生产[10]。不同外源蛋白要求不同的发酵工艺条件,可从发酵培养基、补料调节、溶解氧浓度、菌体密度等多个方面进行优化[11]。通过上述方面的调控可使外源蛋白表达量提高10%~900%[2]。因此对发酵工艺的优化调控是提高毕赤酵母外源蛋白表达量的重要手段之一[12]。
本实验选取毕赤酵母作为发酵生产甲醇蛋白的原始菌株,经过诱变和驯化选育得到了具有适应实验室所用底物的甲醇蛋白高产高效菌株。采用单因素试验,考察和分析发酵过程中的培养基、接种量、温度、pH值、装液量、转速等关键因素对甲醇蛋白产量的影响,旨在系统优化Pichia pastorisYM-SCP02菌株以甲醇为底物发酵生产甲醇蛋白的生产工艺。
1 材料与方法
1.1材料与试剂
1.1.1菌种
巴斯德毕赤酵母(Pichia pastoris)原始菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC NO.2477,经过本课题组诱变与驯化选育后获得了优良菌株Pichia pastorisYM-SCP02。该菌株能利用常规的工业甲醇生产菌体蛋白,与原始菌株相比,生长速率更快,甲醇产率更高。本菌株于4℃斜面试管中保存常用,-80℃甘油管中保存备用。
1.1.2培养基及培养条件
菌种的保存采用常规的酵母浸出粉胨葡萄糖(yeast extractpeptone dextrose,YEPD)复合培养基:酵母浸粉1%,蛋白胨2%、葡萄糖2%,琼脂粉2%。
种子扩大培养:
(1)种子培养基采用YEPD复合培养基:酵母浸粉1%,蛋白胨2%、葡萄糖2%,甲醇0.5%,KH2PO40.4%,MgSO4·7H2O 0.05%。
(2)种子发酵培养条件:250 mL摇瓶中装50 mL培养基,生长温度为30℃,培养基初始pH值为5.0,摇床转速200 r/min,培养时间24 h。
发酵培养基组成:
选择培养甲醇蛋白生产菌常用基础发酵培养基BSM培养基,用于生产甲醇蛋白,初始甲醇的体积分数为1.0%,每隔20 h,补加甲醇0.5%。
基础发酵培养基:85%磷酸26.7 mL/L,二水硫酸钙0. 93 g/L,硫酸钾18.3 g/L,七水硫酸镁14.9 g/L,氢氧化钾4. 13 g/L,甘油40 g/L,微量元素溶液8 mL/L。
微量元素溶液配方:五水硫酸铜6g/L,碘化钾0.088g/L,一水硫酸锰3 g/L,二水钼酸钠0.2 g/L,硼酸0.02 g/L,六水合氯化钴0.5 g/L,氯化锌20 g/L,七水合硫酸亚铁65 g/L,生物素0.8 g/L,浓硫酸5 mL/L。
基础发酵培养条件:在研究培养基各组分用量及单一因素发酵条件对甲醇蛋白产量影响时,发酵培养条件为250 mL摇瓶中装50 mL培养基,生长温度为30℃,培养基初始pH值为5.0,摇床转速200 r/min,培养时间64 h。
1.1.3化学试剂
实验所用的化学试剂纯度均为市售分析纯。
1.2仪器与设备
DGG-101-1电热鼓风干燥箱、HP-9052恒温培养箱:上海一恒科学仪器有限公司;ADVENTURER电子天平:奥豪斯仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;TDL-40B离心机:上海安亭科学仪器厂;HZQ-X100振荡培养箱:哈尔滨市东联电子技术开发有限公司;T-6可见-紫外分光光度计:北京新世纪电子技术开发有限公司;BH-2 Olympus显微镜:日本奥林巴斯公司;Agilent1200高效液相色谱仪:安捷伦科技有限公司。
1.3方法
1.3.1发酵液菌浓度的测定
将刚发酵结束的发酵液摇匀吸取2 mL,用去离子水定容至50 mL。用分光光度计测定其在波长630 nm处的吸光度值。
1.3.2发酵液pH值的测定
发酵开始后每隔2 h,采用无菌操作方法,利用精密pH计(精度为0.01),快速测定发酵液的pH值。
1.3.3湿菌质量与干菌质量的测定
(1)菌体干质量测定/甲醇蛋白含量
取50mL菌悬液,于称质量后的干燥离心管内,4500r/min离心10 min,弃上清,固形物(菌体)用去离子水洗涤-离心2遍后,于55℃烘干至质量恒定,称质量,为甲醇蛋白产量。
(2)菌体湿质量测定
取50mL菌体悬液于称质量后的干燥离心管内,4500r/min离心10 min,弃上清,固形物(菌体)用去离子水洗涤-离心2遍后,直接称质量。
1.3.4甲醇含量的检测
甲醇含量的测定,参照GB/T 9722—2006《化学试剂气相色谱法通则》。
2 结果与分析
2.1发酵培养基的优化
2.1.1磷酸和甘油对甲醇蛋白产量的影响

图1 培养基中磷酸的量对甲醇蛋白产量的影响Fig.1 Effect of phosphoric acid addition in medium on methanol protein yield
由图1可知,当磷酸的用量为原始量时(质量分数85%),53.4 mL/L),甲醇蛋白的产量相对于磷酸的用量为原始量1/2(26.7 mL/L)的75.4%,说明培养基中过高的磷酸浓度不利于甲醇蛋白生产菌的最大化生长。因此,最适的磷酸用量为原始量1/2,即26.7 mL/L时,甲醇蛋白产量最高,为18.4 g/L。
基础发酵培养基配方中的甘油的原始含量为40 g/L。由图2可知,甘油的用量为原始配方中1倍时,即甘油添加量为40 g/L时,甲醇蛋白产量能达到最高值,此时的甲醇蛋白含量为18.7g/L,这可能是由于甘油的用量较大时可使碳源量增大,在前期使得菌体增殖较快较多,有利于后期酵母细胞对甲醇的利用,提高了甲醇利用速率;甘油的用量较小时不能满足甲醇蛋白生产菌的最快生长时对碳源的需求,同时发酵液中菌体量不够,甲醇诱导生长时间较长,菌体容易出现中毒现象[13]。因此,培养基中最适的甘油质量浓度为40 g/L。
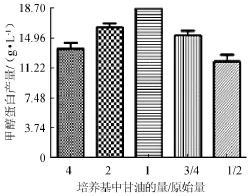
图2 培养基中甘油用量对甲醇蛋白产量的影响Fig.2 Effect of glycerinum addition in medium on methanol protein yield
2.1.2不同生物素添加量对发酵生产菌体蛋白影响
考察不同生物素添加量(生物素的浓度为5‰,添加量为0.4~2.0 mL)对发酵生产菌体蛋白影响,结果见图3。

图3 培养基中生物素用量对甲醇蛋白产量的影响Fig.3 Effect of biotin addition in medium on methanol protein yield
基础发酵培养基配方中生物素的原始添加量为6mg/L。由图3可知,当生物素的用量为原始配方时,即生物素添加量为6 mg/L时,发酵64 h后甲醇蛋白产量能达到最高值,此时甲醇蛋白的产量为18.3 g/L,表明生物素的添加量为6 mg/L即能满足菌体发酵生产所需。增加生物素的添加量至6 mg/L,甲醇蛋白的产量持续增加,但随着生物素添加量的继续增加,甲醇蛋白的产量基本保持不变甚至略有降低。
2.1.3微量元素溶液的添加量对发酵生产菌体蛋白影响
微量元素溶液的添加量(0.4~1.0 mL/100 mL培养基)对发酵生产菌体蛋白有一定的影响,结果见图4。
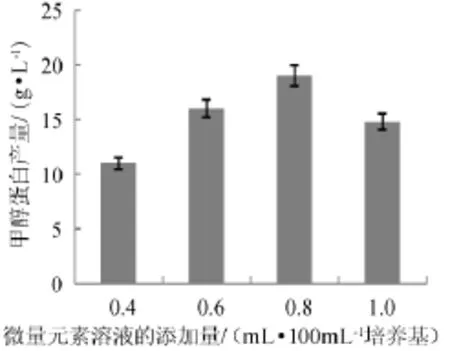
图4 微量元素溶液的添加量对甲醇蛋白产量的影响Fig.4 Effect of microelement solution addition on methanol protein yield
由图4可知,随着微量元素溶液的添加量小幅度增加,甲醇蛋白产量有明显增长。发酵64 h后,添加0.8 mL微量元素溶液/100mL培养基中甲醇蛋白产量值达到最高值,而添加0.4 mL微量元素溶液/100 mL培养基中的甲醇蛋白产量明显低于0.8 mL/100 mL。因此最适的微量元素溶液添加量为0.8mL/100mL培养基,此时甲醇蛋白的产量为18.8g/L。
2.2发酵培养条件的优化
2.2.1接种量对甲醇蛋白产量的影响
不同接种量(4%~14%)对甲醇蛋白的产量有一定影响,结果见图5。
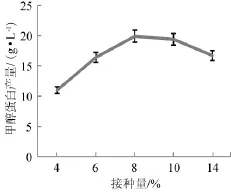
图5 接种量对甲醇蛋白产量的影响Fig.5 Effect of inoculum on methanol protein yield
由图5可知,当接种量为8%(接种量与培养基体积比),甲醇蛋白产量最高。接种量>10%时,由于菌体在初期对底物和营养成分的消耗过大,甲醇蛋白产量得不到明显提高,同时还会导致发酵液稀释严重,不利于甲醇蛋白的发酵生产[1]。当接种量<5%时,甲醇蛋白的产量随接种量的减少下降明显,原因是甲醇浓度过高会对菌体产生一定抑制作用,接种量过低导致单位菌体受到甲醇的抑制作用增加,细胞生长的停滞期较长。同时,由于接种量过小,细胞的初始浓度过低,菌体进入发酵液后不能形成良好的种群优势,抵抗微生物侵扰的能力显著下降,细胞的正常生长和代谢也会受到影响,造成甲醇蛋白的产量降低[6]。综上可知,最佳的接种量为8%。
2.2.2培养温度对的发酵结果的影响
不同培养温度(0~36 h,30℃,36~64 h,28℃和0~36 h, 28℃,36~64 h,30℃)对发酵结果的有一定影响,结果见表1。
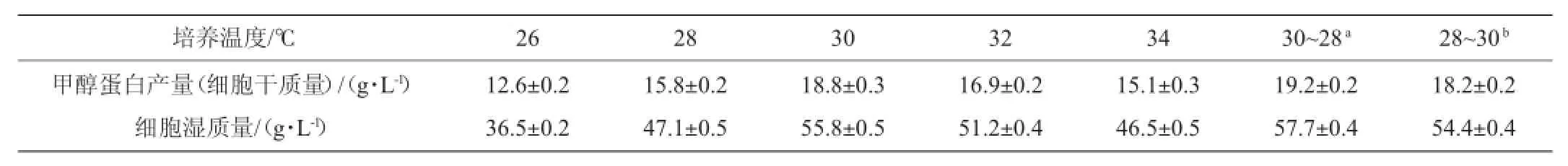
表1 培养温度对发酵结果的影响Table 1 Effect of temperature on fermentation result
适宜的发酵培养温度对细胞的正常生长和代谢十分必要[3]。温度对毕赤酵母发酵产物的活性、发酵液的物理性质及生物合成方向等都有影响[8]。由表1可知,28~32℃是毕赤酵母(Pichia pastorisYM-SCP02)发酵生产甲醇蛋白的较适宜温度范围。温度为32℃时,发酵结束后甲醇剩余量最低,但<30℃细胞量的结果,说明较高的温度利于菌体对甲醇的代谢,但并不利于细胞量的积累。温度<30℃时,随着温度的继续降低,发酵结束后甲醇的残留逐渐增高,细胞量呈现平稳上升,然后快速下降的趋势。表明在一定的温度范围内,低温诱导对分泌蛋白表达更有利,但随着温度的进一步降低,生化反应活性也随之降低,最终导致甲醇蛋白的产量出现降低的结果[12]。考虑到较高温度有利于菌体在初期快速生长,而较低的温度更适宜的甲醇蛋白的积累,因此采用0~36 h,30℃,36~64 h,28℃为最优的培养温度。发酵结束后甲醇蛋白的产量为19.2 g/L。
2.3初始pH值对发酵结果的影响
pH值是发酵调控中的关键参数,对微生物代谢的影响十分重要。采用滴加少许稀盐酸或氢氧化钠溶液对培养基初始pH值进行调节,考察不同初始pH值(3.0~8.0)对发酵结果的影响,结果见图6。

图6 初始pH值对甲醇蛋白产量的影响Fig.6 Effect of initial pH value on methanol protein yield
由图6可知,发酵最适初始pH值为4.5~5.5,说明弱酸性的发酵环境更适宜菌体的生长和甲醇蛋白的积累,此时甲醇蛋白产量为19.1 g/L。当pH<4.0时,甲醇蛋白的产量有所下降,可能是由于过低的pH值会影响膜表面电荷的性质及膜的通透性,进而影响对物质的吸收能力[2]。当pH值>7.0时,随着pH值的增加,甲醇蛋白的产量显著下降,原因可能与过高的pH值会抑制菌体中某些酶的活性,影响微生物对营养物质的吸收及代谢,甚至造成菌体的新陈代谢受阻[10]。因此,选择最适的发酵初始pH值为5.0。
2.4甲醇初始添加量对发酵结果的影响
考察不同甲醇初始添加量(0.4%~2.0%)对发酵结果的影响,结果见图7。

图7 甲醇初始添加量对甲醇蛋白产量的影响Fig.7 Effect of initial methanol addition on methanol protein yield
由图7可知,不同甲醇添加量对甲醇蛋白产量的影响不同,随着甲醇初始添加量(甲醇添加量与培养基质量比)逐步升高,甲醇蛋白产量逐渐增加之后又呈逐渐降低的趋势,反映出毕赤酵母是甲醇营养型酵母,可以在以甲醇为碳源和能源的培养基中生长,但过高甲醇添加量抑制细胞的生长和产物的表达[14]。实验发现甲醇添加量为1.2%时,甲醇蛋白的产量最大,高达19.0 g/L,而>1.2%时,随甲醇的添加量增加,甲醇蛋白的产量降低,表明较高甲醇添加量抑制菌体生长,因此最适的甲醇初始添加量为1.2%。
2.5装液量和转速对发酵结果的影响
在摇床转速为200 r/min条件下,考察不同的装液量(30~100 mL/250 mL摇瓶)对甲醇蛋白产量的影响,结果见图8。
由图8可知,装液量>80 mL/250 mL时,发酵结束后甲醇蛋白的产量<16 g/L,随着装液量的进一步提高,甲醇蛋白产量下降的趋势更加明显。当装液量<80mL/250mL时,甲醇蛋白的产量随着装液量的降低呈现明显的上升趋势,在装液量为50mL/250mL时达到最高产量18.9g/L。原因是毕赤酵母是好氧微生物,溶解氧浓度对菌体的生长和产物生成的影响很大,较高的溶氧条件是提高发酵效率和甲醇蛋白产量的重要保证[11]。但考虑到过低的装液量会带来成本的增加等不利因素,因此最适的装液量为50mL/250mL。
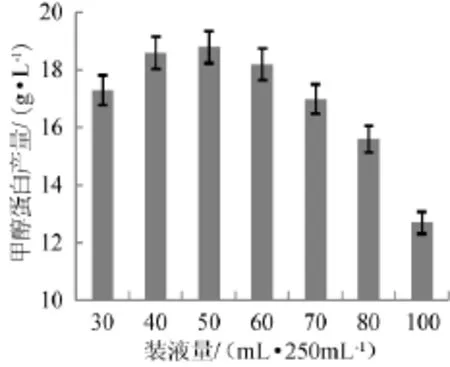
图8 装液量对甲醇蛋白产量的影响Fig.8 Effect of liquid volume on methanol protein yield

图9 转速对甲醇蛋白产量的影响Fig.9 Effect of rotate speed on methanol protein yield
在装液量为50 mL/250 mL条件下,考察不同转速(120~280 r/min)对甲醇蛋白产量的影响,如图9所示。转速调节是改变发酵过程中溶解氧的重要方面,较高的转速会提高氧的体积传递系数,增加发酵液中氧的供给[15]。因此选择合适的摇瓶转速,对提高毕赤酵母好氧发酵生产甲醇蛋白的产率十分重要。由图9可知,当转速<180 r/min时,由于发酵过程中的转速过低,溶氧浓度不能满足细胞快速生长时对氧气的需求,抑制的菌体的生长和繁殖,细胞增殖缓慢,甲醇蛋白产量较低。但若转速>250 r/min,发酵过程中的溶氧会过高,会发生细胞氧中毒的现象,此外过高的转速细胞所承受的剪切力过大,甚至会加剧细胞死亡速率,甲醇蛋白产量迅速降低。因此,最适的转速为200 r/min,此时的溶氧保持在有利于外源蛋白高效表达的范围,也可以降低底物和有害废物的抑制作用,细胞生长繁殖状态良好,甲醇蛋白的产量最高,发酵结束后甲醇蛋白的产量高达19.0 g/L。
3 结论
对毕赤酵母(Pichia pastorisYM-SCP02)发酵生产甲醇蛋白工艺条件进行了优化,最适的发酵培养条件为接种量8%、发酵温度采用0~36h,30℃,36~64h,28℃、初始pH值为5.0、初始甲醇添加量为1.2%,装液量为50 mL/250 mL摇瓶、转速为200 r/min,最终得到的甲醇蛋白最高产量(细胞干质量)为19.3 g/L。
[1]DALY R,HEARN M T W.Express ion of heterologous proteins inPichia pastoris:a useful experimental tool in protein engineering and production[J].J Mol Recognit,2005,18(2):119-138.
[2]林俊涵.毕赤酵母高密度发酵工艺的研究[J].中国生物工程杂志,2009,29(5):120-125.
[3]CELIK E,CALIK P,OLIVER S G.Metabolic flux analysis for recombinant protein production byPichia pastorisusing dual carbon sources:effects of methanol feeding rate[J].Biotechnol Bioeng,2010,105(2):317-329.
[4]高玉荣,刘洋,李大鹏,等.大豆糖蜜高产单细胞蛋白菌株的筛选及其生长条件[J].中国酿造,2010,29(8):33-36.
[5]王定昌,徐达伍.饲料级酵母单细胞蛋白生产技术[J].粮油食品科技,2009,17(1):7-9.
[6]彭毅,步威,康良仪.甲醇酵母表达系统[J].生物技术通报,2000,82(1):38-41.
[7]史先振.现代发酵工程技术在食品领域的应用研究进展[J].中国酿造,2005,24(12):1-4.
[8]李洪淼,王红宁,许钦坤.毕赤酵母高密度发酵研究进展[J].生物技术通讯,2005,16(2):210-212.
[9]周祥山,范卫民,张元兴.不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响[J].生物工程学报,2002,18(3):348-351.
[10]CHAROENRAT T,KETUDAT M,STENDAHL A H.Oxygen-limited fed-batch process:an alternative control forPichia pastorisrecombinant protein processes[J].Bioproc Biosyst Eng,2005,27(6):399-406.
[11]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005.
[12]STADLMAYR G,MECKLENBRAUKER A,ROTHMULLER M,et al. Identification and characterisation of novelPichia pastorispromoters for heterologous protein production[J].J Biotechnol,2010,150(10):519-529.
[13]宋留君,周长林,窦洁.甘油对毕赤酵母高密度发酵表达重组水蛭素II的影响[J].中国药科大学学报,2006,37(4):371-374.
[14]HEYLAND J,FU J,BLANK L M,et al.Quantitative physiology of Pichia pastorisduring glucose-limited high-cell density fed-batch cultivation for recombinant protein production[J].Biotechnol Bioeng,2010, 107(2):357-368.
[15]闫亚军,陈劲春.利用转基因毕赤酵母高表达小分子药用多肽的研究[J].北京化工大学学报,2002,29(4):1-3.
Optimization of fermentation conditions for methanol protein production byPichia pastoris
GOU Wanxiao1,WEI Hongwei2,HU Yuansen2,WANG Le2*
(1.Coal Biochemical Technology Engineering Co.,Ltd.of Yima Coal Industry Group,Yima 472300,China; 2.College of Biological Engineering,Henan University of Technology,Zhengzhou 450001,China)
Pichia pastorisYM-SCP02 strain bred and domesticated in laboratory with high methanol protein yield was used for methanol protein production.The key factors of methanol protein fermentation were investigated and optimized,and the optimal fermentation conditions in the shake flask were determined as follows:inoculum 8%,segmented fermentation temperature 0-36 h,30℃and 36-64 h,28℃,initial pH 5.0,initial methanol addition 1.2%,liquid volume 50 ml/250 ml shake flask,and rotate speed 200 r/min.Under these conditions,the highest yield of methanol protein(cell dry weight)was 19.3 g/L.
methanol protein;Pichia pastoris;fermentation;technology conditions;optimization
TQ920.6
A
0254-5071(2014)07-0078-05
10.11882/j.issn.0254-5071.2014.07.017
2014-05-08
河南工业大学博士科研基金项目(150493)
苟万晓(1964-),男,工程师,本科,研究方向为生物化工。
*通讯作者:王乐(1984-),男,讲师,博士,研究方向为发酵工程。
