响应面法优化米曲霉产孢工艺条件
2014-02-20张义伟刘瑞勇李新锐刘旭博张良沈阳农业大学生物科学技术学院辽宁沈阳110866
张义伟,刘瑞勇,李新锐,刘旭博,张良*(沈阳农业大学生物科学技术学院,辽宁沈阳110866)
响应面法优化米曲霉产孢工艺条件
张义伟,刘瑞勇,李新锐,刘旭博,张良*
(沈阳农业大学生物科学技术学院,辽宁沈阳110866)
米曲霉(Aspergillus oryzae)是一种在食品中应用广泛的真菌。为了得到较多的米曲霉孢子,基于单因素试验选取了培养温度、培养基含水量和接种量3个因素,利用Design-Expert响应面分析法对产孢进行了优化。结果表明,在培养温度为22.66℃,培养基含水量为48.79%,接种量为3.44‰时,产孢子数预测可达到12.743 7×109CFU/g,实际测得为12.1×109CFU/g,达到预测值的94.95%。
米曲霉;孢子粉;响应面优化
米曲霉(Aspergillus oryzae)是一种好气性真菌,属于半知菌亚门、曲霉属。菌丝一般在酸度较大的培养基上呈绿色,在酸度较小的培养基上呈黄色,老化后逐渐为褐色[1]。其分生孢子梗生长在厚壁的足细胞上,产生的分生孢子头呈放射形,顶囊球形或瓶形。米曲霉具有丰富的蛋白酶系,能产生酸性、中性和碱性蛋白酶,它的稳定性很高,可以耐受高温,主要存在于粮食、发酵食品、腐败有机物、土壤等处。米曲霉也是美国食品与药物管理局和美国饲料公司协会1989年公布的40余种安全微生物菌种之一[2]。
目前,在酱及酱油的工业化生产中普遍使用米曲霉作为发酵菌株[3]。在发酵制酱的过程中,米曲霉产生的蛋白酶系可以将含有丰富蛋白质、钙、磷、铁等营养物质的大豆[4-5]酶解,促使豆中的磷、钙等矿物质被释放出来,提高人对大豆中矿物质的吸收率,制得的大酱营养比大豆更易于消化吸收[6-7],具有良好的抗血栓、抗氧化、抗病劳、抗癌等生理作用[8-9]。且若利用米曲霉孢子粉[10]代替传统的自然发酵中产生的微生物还可弥补传统大酱酿造方法周期长的不足。
因此,高效生产米曲霉孢子粉具有工业价值,可以为寻找周期短、成本低、产量大的产孢条件提供依据,增强工业竞争实力。本研究选取了培养时间、培养温度、培养基含水量和接种量进行单因素试验,再利用基于统计学方法[11]的Design-Expert响应面法[12-15]对米曲霉产孢条件进行优化,确定了米曲霉产孢子的最佳工艺条件。为快速发酵产孢子生产提供了新思路,将为米曲霉研究的发展提供理论及技术储备。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
米曲霉沪酿3.042:武汉佳成生物制品有限公司提供。
1.1.2 培养基
麸皮、稻壳、玉米粉:均购自于市场,培养基中麸皮∶稻壳∶玉米粉=6∶1∶1.2。
1.1.3 试剂
无水乙醇(分析纯)、硫酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
JK-HI-9012恒温培养箱、JK-PSPS-18L高压蒸汽灭菌锅:上海精科仪器公司;FA2004A电子天平:上海精天电子仪器有限公司;GH-HZT电子天平:上海贵虎实业发展有限公司;XB.K.25血球计数板:上海市求精生化试剂仪器有限公司;XSP-8CA显微镜:上海上光新光学科技有限公司。
1.3 方法
1.3.1 米曲霉孢子粉的制备
按麸皮∶稻壳∶玉米粉=6∶1∶1.2的比例进行培养基的配制[16]。放入高压蒸汽灭菌锅121℃灭菌30 min,冷却至室温后进行米曲霉孢子粉的培养[17-18]。分成四大组:第一组以培养时间为自变量,加水量均为培养基总质量的55%,接种量均为总质量的3‰,培养温度均为20℃,每天观测产孢子的数量,直至第9天为止;第二组以培养温度为自变量,分别取20℃、21℃、21.5℃、22℃、22.5℃、23℃、23.5℃共7个温度梯度,其他条件均相同,培养5 d观测产孢子数;第三组以培养基含水量为自变量,选取培养基总量的45%~70%间6个含水量梯度进行试验,每个梯度相差5%,孢子粉接种量均为总质量的3‰,培养温度为20℃,5 d后观察产孢情况;第四组以接种量为自变量(1.5‰、2.0‰、2.5‰、3.0‰、3.5‰、4.0‰),培养温度20℃,含水量50%,培养5 d后计算产生孢子数量。
1.3.2 单因素试验
分别以培养时间、培养温度、培养基含水量、培养基接种量为单因素变量,以产孢量为指标进行试验。
1.3.3 产孢条件的优化
根据单因素试验的结果,选取培养温度、培养基含水量、接种量为自变量设定试验的因素和水平值见表1,以产孢量为响应值,利用Box-Behnken中心组合试验设计原理[19-21]设计响应面分析试验。

表1 响应面试验因素与水平Table 1 Factors and levels of the response surface methodology
1.3.4 产孢量的测定
(1)不同稀释度的孢子悬浮液制备
精确称取培养基(样品)0.100 0 g,倒入盛有玻璃珠的250 mL锥形瓶内,加体积分数为95%的酒精5 mL,加无菌水20 mL,加稀硫酸(10%)10 mL,充分振摇,使分生孢子充分分散,然后用4层纱布过滤、冲洗,使滤渣不含孢子,之后加水65 mL稀释至100 mL,在其中取出1 mL加至9 mL水中,使孢子悬液稀释至1 000倍。
(2)孢子数测定
取擦拭干净的血球计数板盖上盖玻片,将稀释的孢子悬液摇匀,用滴管吸取少许,从计数板中间平台两侧的沟槽内沿盖玻片的下边缘滴入一小滴,孢子悬液利用液体的表面张力充满计数区,并用吸水纸吸去沟槽中流出的多余孢子悬液。静置数分钟,待孢子沉降。
(3)孢子数计算
采用ZBX66028—87《孢子数测定法》[22]计算孢子数。使用血球计数板,选四角及中间共5大格为计数区,得到的孢子数值为n,孢子数计算公式如下:
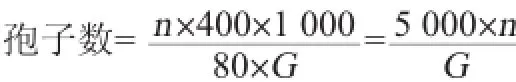
式中:n为血球计数板中5个大格中的总孢子数,个;G为样品质量,g。
2 结果与分析
2.1 单因素试验
2.1.1 培养时间对产孢的影响
培养时间是影响产孢量的重要因素之一。培养温度、培养基含水量培养基接种量均相同,培养时间分别为1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d,得到如图1所示产孢曲线。由图1可知,随着培养时间的延长,米曲霉的菌丝逐渐生成增多,培养基营养被逐渐利用,米曲霉的孢子数也在逐渐增加;培养至6 d左右,由于菌丝生长量一定,产孢量也趋于稳定。继续延长时间菌丝生长量不再增加,产孢量也不再有明显增加。因此,培养时间选择为6 d。

图1 培养时间对产孢量的影响Fig.1 Effect of fermentation time onA.oryzaespores production
2.1.2 培养温度对产孢的影响
培养温度会影响米曲霉菌丝的生长繁殖,从而会影响最终的产孢量。要得到大量的米曲霉孢子粉,控制合适的培养温度非常重要。分别在20℃、21℃、21.5℃、22℃、22.5℃、23℃、23.5℃共7个温度条件下进行试验,得到的产孢量曲线如图2所示。由图2可知,培养温度在20~22.5℃时,随着温度的升高,米曲霉菌丝生长繁殖逐渐加快,产孢量也逐渐增加,当培养温度达到22.5℃时,产孢量达到峰值;但当培养温度>22.5℃时,产孢量呈下降趋势,原因是培养温度升高对菌丝生长繁殖不利所致。故培养温度选择22.5℃比较合适。
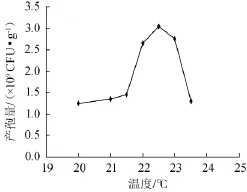
图2 温度对产孢量的影响Fig.2 Effect of fermentation temperature onA.oryzae spores production
2.1.3 培养基含水量对产孢的影响
水分多少直接影响着米曲霉的产孢量,米曲霉利用培养基中的水分进行生长繁殖,适宜的水分有利于菌丝的生长,从而提高孢子粉的产量。在其他条件不变,含水量分别为45%、50%、55%、60%、65%、70%的情况下得到的产孢曲线如图3所示。由图3可知,培养基含水量为50%时产孢量最多,含水量<50%时,培养基中水的活度会降低,酶的活性也会减小,菌丝生长繁殖受限,从而影响最终的产孢量;含水量>50%时,培养基湿度较大,质地较密实,氧气含量也少,不利于产孢。所以只有选择合适的培养基的含水量才会得到理想的产孢效果,而且随着发酵的进行,培养基内水分逐渐蒸发,其条件更有利于产孢。所以含水量选择50%为宜。

图3 含水量对产孢量的影响Fig.3 Effect of medium water content onA.oryzae spores production
2.1.4 接种量对产孢的影响
接种量分别为1.5‰、2.0‰、2.5‰、3.0‰、3.5‰、4.0‰,对产孢量影响的曲线如图4所示。由图4可知,在接种量<3.0‰的范围内,随着接种量的增多,菌丝生长量也会逐渐增多,产孢量也会随之增加;接种量在3.0‰时可得到产孢量的峰值;接种量>3.0‰,菌丝的生长也会随之增加,这时,由于培养基营养条件有限,菌丝主要利用营养物质进行其代谢活动,代谢的同时还会进行二氧化碳的释放,更不利于米曲霉进行繁殖积累孢子。因此,接种量选择3.0‰为宜。

图4 接种量对产孢量的影响Fig.4 Effect of inoculum onA.oryzaespores production
2.2 米曲霉产孢最佳工艺参数的确定
在单因素试验的基础上,以产孢量为考察指标,选取培养温度(℃)、培养基含水量(%)、接种量(‰)3个因素,根据Box-Behnken中心组合试验设计原理,采用3因素3水平的响应面分析方法进行试验对米曲霉产孢条件进行优化,试验设计及结果见表2。采用Design-Expert统计软件对试验结果进行响应面回归分析,回归方程的方差显著性分析结果见表3。

表3 响应面二次回归模型方差分析Table 3 Variance analysis for response surface quadratic regression model
结果显示,R2=0.987 1,说明回归方程的拟合度较好,经过回归拟合后,培养温度(A)、培养基含水量(B)和接种量(C)对产孢量(Y)的影响回归方程:Y=11.8+1.09A-1.48B+ 2.36C-1.15AB+1.87AC-0.3BC-3.42A2-4.1B2-3.42C2。
米曲霉产孢量模型极显著(P<0.01),其决定系数R2=0.987 1,说明本试验所选的因素之间存在着显著的回归关系,用此模型可以预测产孢量(Y)对培养温度(A)、培养基含水量(B)和接种量(C)3个因素的响应值。
由表3可知,模型的一次项A、B、C极显著,交互项AB显著、AC极显著、BC不显著,二次项A2、B2、C2极显著,因此各个具体试验因子与响应值都不是简单的线性关系。
根据上述模型进行响应面和等高线作图,培养温度(A)、培养基含水量(B)和接种量(C)与产孢量之间的关系见图5。由图5可知,培养温度(A)、培养基含水量(B)和接种量(C)存在极值点,在此条件下测得的产孢量达到12.1×109CFU/g,与预测值(12.743 7×109CFU/g)十分接近,表明预测值和实际值有很好的拟合性,验证了模型的可靠性。由Design-Expert响应面分析软件RSM分析得到米曲霉产孢最佳条件是培养温度为22.66℃、培养基含水量为48.79%、孢子粉接种量为3.44‰。在这种情况下培养基所得孢子数预测可达到12.743 7×109CFU/g。本试验对实际生产控制条件综合对比得到最佳产孢条件为培养温度为23℃、培养基含水量为50%、接种量为3.5‰。
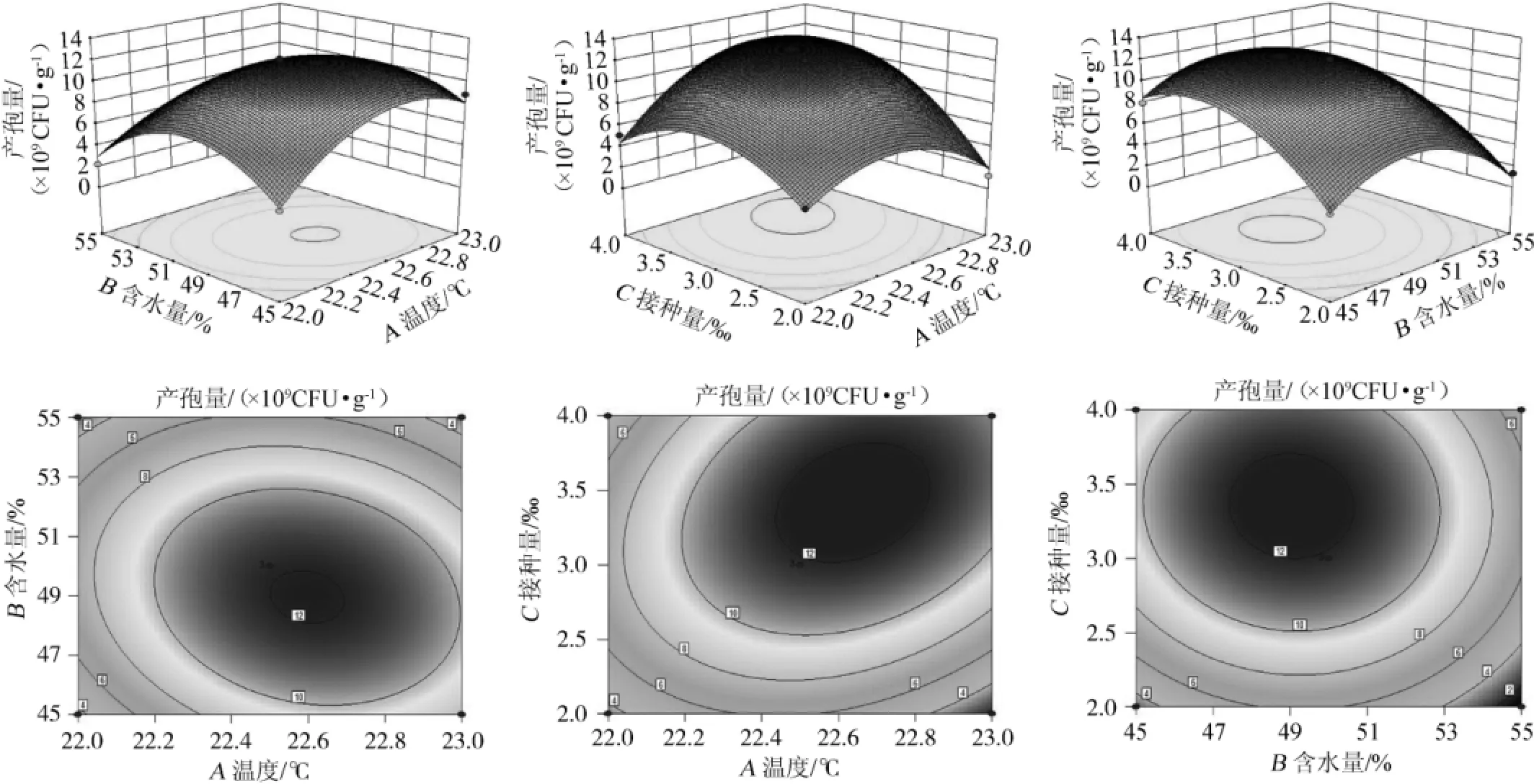
图5 各因素交互作用对米曲霉产孢量的响应面和等高线图Fig.5 Response surface plot and contour line of interaction among each factors onA.oryzaespores production
3 结论
响应面方法是优化米曲霉产孢条件的有效工具,Box-Behnken试验设计能建立主要因素影响米曲霉产孢的二次多项数学模型,并利用统计学方法对该模型进行了显著性检验,优化了内在因素水平,可以找出最佳值。经过优化后,在培养温度为22.66℃、培养基含水量为48.7%、接种量为3.44‰时,产孢量预测可达到12.743 7×109CFU/g,实际测得为12.1×109CFU/g,达到预测值的94.95%。
[1]刘丽萍,刘丽华.米曲霉研究进展与应用[J].中国调味品,2008(4):28-33.
[2]姜文侠,史连生,李韬,等.饲用微生态制剂—益生素[J].动物科学与动物医学,2000,17(2):57-59.
[3]郭继平,马莺.紫外诱变选育米曲霉高产蛋白酶菌株[J].微生物学通报,2007,34(2):246-250.
[4]刘志胜,李里特,陈巳英三.大豆蛋白营养品质和生理功能研究进展[J].大豆科学,2000,19(13):263-268.
[5]DAVIS G R,SOSULSKI F W.Nutritional quality of oilseed protein isolates as determined with larvae of the yellow mealworm,Tenebrio molitorL.[J].J Nutr,1974,104(9):1172-1177.
[6]鱼红闪,郭勇,韩桂焕,等.大酱发酵过程中大豆皂甙变化的研究[J].食品科学,1995(5):20-24.
[7]包启安.豆酱的功能性[J].中国酿造,2002,21(3):1-6.
[8]杨世平,邱德全.米曲霉产中性蛋白酶的适宜条件[J].湛江海洋大学学报,2005(6):47-51.
[9]李善仁,林新坚,蔡海松,等.混菌发酵豆粕制备大豆肽的研究[J].中国粮油学报,2009,24(12):52-55.
[10]姚继承,郭云芝,屈光伟,等.应用复合制曲技术提高大酱产品质量[J].中国调味品,2007(1):52-54.
[11]VAIDYA R,VYAS P,CHARHATPAR H S.Statistical optimization of medium components for the production of chitinase byAlcaligenes xylosoxydans[J].Enzyme Microb Tech,2003,33(1):92-96.
[12]胡丽娟,薛高尚,卢向阳,等.响应面法优化芽孢杆菌25-2产纤维素酶发酵条件[J].酿酒科技,2012(4):21-26.
[13]陈晓萍,孙付保,陈晓旭,等.响应面法优化康宁木霉产纤维素酶固态发酵培养基[J].食品与生物技术学报,2011,30(1):106-112.
[14]武为平,陈捷,段玉玺,等.响应面法优化棘孢木霉产厚垣孢子发酵工艺[J].中国生物工程杂志,2013,33(12):97-104.
[15]陈欣,李寅,堵国成,等.应用响应面方法优化Coniothyrium minitans固态发酵生产生物农药[J].工业微生物,2004,34(1):26-29.
[16]张良,纪明山,张玉芬,等.绿色木霉TR-8发酵工艺条件筛选[J].沈阳农业大学学报,2005,36(4):494-496.
[17]孟颢华.沪酿3.042米曲霉的纯化复壮[J].中国调味品,2001(7):7-9. [18]诸葛键,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1997.
[19]王文平,黄雅燕,肖美添.响应面法优化米曲霉发酵豆粕产大豆肽的研究[J].广东化工,2013,40(15):8-15.
[20]杨文雄,高彦祥.响应面法及其在食品工业中的应用[J].中国食品添加剂,2005(2):68-71.
[21]孙素华,孙金旭,朱会霞,等.响应面法优化樟芝真菌发酵培养条件研究[J].食品研究与开发,2012,33(7):157-160.
[22]上海市酿造科学研究所.发酵调味品生产技术[M].北京:中国轻工业出版社,2007.
Optimization ofAspergillus oryzaespores-producing process condition by response surface analysis
ZHANG Yiwei,LIU Ruiyong,LI Xinrui,LIU Xubo,ZHANG Liang*
(College of Biological Science&Technology,Shenyang Agricultural University,Shenyang 110866,China)
Aspergillus oryzaeis widely used in food.In order to get more spores ofA.oryzae,based on single factor test,three factors of culture temperature,medium water content and inoculums were selected to conduct response surface analysis to optimize spores production fromA.oryzae.The results showed that under the condition of temperature 22.66℃,medium water content 48.79%,inoculum 3.44‰,the predicted spores were up to 12.743 7×109CFU/g,and the actual detected number was 12.1×109CFU/g,reaching 94.95%of the predicted value.
Aspergillus oryzae;spores;response surface optimization
Q815
A
0254-5071(2014)07-0034-05
10.11882/j.issn.0254-5071.2014.07.007
2014-05-09
国家科技部“十二五”科技支撑计划项目(2012BAD31B05-3);沈阳农业大学大学生科技创新项目(201310157539)
张义伟(1989-),女,本科生,研究方向为微生物与酶工程。
*通讯作者:张良(1979-),男,讲师,博士,研究方向为生物工程。
