鸭肝炎病毒的分离与鉴定
2014-02-18
(青岛易邦生物工程有限公司,山东青岛 266032)
鸭肝炎病毒的分离与鉴定
徐保娟,郭伟伟,宫 晓,李陆梅,宋新宇,范根成
(青岛易邦生物工程有限公司,山东青岛 266032)
1999-2008年从山东、河南、浙江、江苏、广西、山西、江西、广东、福建和辽宁等地有典型鸭病毒性肝炎症状的病死雏鸭中共分离得到22株病毒。用鸭肝炎病毒(DHV)Ⅰ型(DHV-1)抗血清和新型DHV (NDHV)抗血清对分离的22株病毒进行血清中和试验;对22株病毒的抗原相关VP1基因进行RT-PCR扩增和测序,然后对VP1基因的核苷酸与推导的氨基酸序列进行分析。结果表明,目前我国存在DHV-1和N-DHV两种血清型。其中分离到的12株为DHV-1,10株为N-DHV。依据VP1基因序列同源性进行的血清型分型结果与根据抗原性鉴定进行的血清型分型结果一致。12株DHV-1的氨基酸序列同源性为95%左右,10株N-DHV的氨基酸同源性为98%左右;DHV-1分离株与N-DHV分离株间氨基酸同源性为72%~77%。同血清型病毒株间的VP1基因变异很小,表明DHV的抗原性稳定。
鸭肝炎病毒;VP1基因;序列分析;血清型;分离;鉴定
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭肝炎病毒(duck hepatitis virus,DHV)引起雏鸭的一种以肝脏为主要病理变化的急性、高度致死性、接触性传染病。临床表现痉挛、抽搐和角弓反张等神经症状,以肝肿胀和出血为特征性病变。1~3周龄的雏鸭易感,发病严重,传播迅速,雏鸭通常出现症状后的1小时内死亡,10日龄雏鸭感染后死亡率高达90%~95%。1949年,美国Levine首先分离到鸭肝炎病毒,并命名为I型鸭病毒性肝炎病毒[1]。苏敬良等在北京和广西等地从3-13日龄疑似鸭肝炎的北京鸭和樱桃谷鸭体内分离到两株与I型和Ⅲ型鸭病毒性肝炎病毒无血清学交叉免疫反应的鸭肝炎病毒,认为出现了新的血清型,并将其命名为新型鸭肝炎病毒[2,3]。
自2006年以来,范书才、苏敬良、Kim MC和Tseng等分别对各地区的DHV-1和N-DHV进行血清学与分子生物学系统鉴定,证实了N-DHV的存在[4-6]。有研究报道,DHV中的结构蛋白VP1包含病毒的中和表位和主要抗原位点,是最易发生变异的区域,并与病毒的抗原性密切相关。Oberste等通过对VP1基因部分序列的同源性分析比较,建立了一种血清型分型标准:核苷酸序列同源性≥75%、推导的氨基酸序列同源性≥88%的毒株可判定为同一血清型[7]。
为了解我国鸭病毒性肝炎的流行情况,本研究对保存的1999—2008年从山东、河南、浙江、江苏、广西、山西、江西、广东、福建和辽宁等地有典型鸭病毒性肝炎症状的病死雏鸭中分离得到的22株病毒,并对分离株进行血清型鉴定和易感鸭回归试验,对抗原相关的VP1基因进行扩增,参考GenBank登录的毒株序列,进行VP1基因同源性及氨基酸序列突变差异分析,结果表明分离毒均为鸭肝炎病毒。现将分离鉴定情况报告如下。
1 材料和方法
1.1 阳性血清
Ⅰ型和新型鸭肝炎病毒阳性血清均由中国动物卫生与流行病学中心提供,中和效价均为1∶1097。
1.2 鸭胚
12~13日龄麻鸭胚来源于无鸭肝炎病史、DHV抗体阴性的健康种鸭群,鸭胚液无菌检验、支原体检验和血凝性病毒检验均为阴性。
1.3 易感鸭
非免疫种鸭蛋购于北京兴平旺畜禽养殖专业合作社,种蛋购回后由青岛易邦生物工程有限公司实验动物室按SPF鸡要求孵化,负压隔离器内饲养。
1.4 SPF鸡
北京梅里亚维通实验动物技术有限公司提供。
1.5 病料及病料处理
1.5.1 病料。由青岛易邦生物工程有限公司于1999—2008年从山东、河南、浙江、江苏、广西、山西、江西、广东、福建和辽宁等地有典型鸭病毒性肝炎症状的病死雏鸭中采集,均为病死雏鸭肝脏,共35份。
1.5.2 病料处理。将无菌采集死亡雏鸭肝脏,剪碎后按照组织重量1∶4加入灭菌生理盐水,高速匀浆制成肝组织乳剂,60目铜网过滤;收集滤液,加入氯仿(终浓度为5%),振荡15min后,4℃,2000r/min离心20min,收集上清液,经0.22µm滤膜过滤除菌后作为接种用样品。
1.6 病毒分离
用含200U/ml双抗的生理盐水将上述样品做100倍稀释,经尿囊腔接种12-13日龄的易感鸭胚10枚,每胚0.2ml,置36~37℃继续孵育,每日照胚2次,观察7日,记录死胚情况。收集48-168小时死亡鸭胚的胚体,经无菌检验合格后,作为鸭胚毒,--70℃保存备用。
1.7 病毒含量测定
将分离毒用灭菌生理盐水作10倍系列稀释,取10-3、10-4、10-5、10-6、10-75个稀释度,分别尿囊腔接种12~13日龄易感鸭胚各5枚,每胚0.2ml。同时设接种生理盐水对照5枚,每胚0.2ml。置36~37℃继续孵育,每日照胚2次,观察7日。以鸭胚死亡并出现尿囊膜水肿增厚,头、颈、背部等全身出血性病变判为感染,计算ELD50。
1.8 血清中和试验
用Ⅰ型或新型阳性血清分别与分离毒进行血清中和试验。取适当血清与含200ELD50/0.2 ml的病毒液等量混合,37℃作用1小时。同时,将病毒(含100 ELD50/0.2ml)和生理盐水分别设为对照组。将各中和组、对照组经尿囊腔接种10枚易感鸭胚,0.2ml/胚,置36~37℃继续孵育,每日照胚2次,观察7日,每天记录各组死胚数(24小时内死亡胚弃之不计)。以病毒对照组鸭胚至少死亡8枚,生理盐水对照组全部健活为试验成立。中和组胚死亡判为感染,健活判为保护。
1.9 易感雏鸭回归试验
将分离毒用生理盐水作10倍稀释,分别肌肉注射接种3日龄易感雏鸭(来源种鸭群的Ⅰ型和新型鸭肝炎病毒中和抗体均<1∶4)各10只,每只0.5ml,同时设生理盐水接种对照组,各组保温隔离饲养,连续观察10日。
1.10 主要试剂
RNA提取试剂盒购自天泽公司;反转录酶及反转录试剂均购自Takara公司;2000bp marker购自TaKaRa公司。
1.11 引物设计与合成
参考DRL-62株(DQ219396)与韩国N-DHV AP-04114株(DQ812093)基因组全序列,选择VP1基因保守区域,使用gene runner软件设计2对特异性引物,由上海生物工程有限公司合成。
DHV-1:
上游:GGTGATTCCAACCAGTTGGG
下游:TTCAATTTCCAGATTGAGTTCAAA
N-DHV:
上游:CAGATGGCCGCCAATGATCA
下游:GTCTCTGACATTTCGAAATTGG
1.12 RNA提取
按照RNA提取试剂盒说明书提取总RNA。
1.13 RT-PCR扩增DHV-1、N-DHV VP1 PCR反应条件
94℃预变性4min;94℃变性30s、54℃退火30s、72℃延伸60s,35个循环 ;72℃延伸10min ;4℃结束反应。PCR产物由上海生物工程有限公司测序。
1.14 序列分析
应用DNAMan和MEGA4.0软件将获得的测序结果进行分析,将序列与GenBank中登录的DHV参考病毒株VP1基因核苷酸及推导的氨基酸序列进行序列比对,构建系统进化树。所用病毒株及GenBank登录号为:SG(FJ971623)、AP-03337(DQ256132)、AP-04009(DQ256133)、AP-04203(DQ256134)、AP-04114(DQ812093)、DRL-62(DQ219396)、F(EU264072) 和GZ(EU888310)。
2 结果
2.1 病毒分离结果
35份病料中有10份病料接种后24小时内鸭胚全部死亡,细菌检验为阳性;3份病料接种后168小时内鸭胚均无死亡;22份病料接种后96小时内鸭胚死亡6枚以上,死亡鸭胚胚体水肿、出血,肝出血或有白色坏死点。结果表明共从35份病料中共分离到22株病毒,暂分别命名为SD01、SD02、SD03、SD05、HN1、HN2、GX1、LN6、LN7、SX8、ZJ1、ZJ4、ZJ5、JS1、JS2、JS3、JS5、FJ1、FJ2、FJ3、GD1、JX2。
2.2 病毒含量测定结果(详见表1)
2.3 病毒株血清型鉴定结果
用Ⅰ型标准阳性血清和新型阳性血清,分别与各分离毒株进行鸭胚中和试验。结果表明,JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株病毒仅能够被Ⅰ型鸭肝炎病毒阳性血清所中和,属于Ⅰ型鸭肝炎病毒;而SD01、SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株病毒仅能够被新型鸭肝炎病毒阳性血清所中和,属于新型鸭肝炎病毒。
2.4 易感雏鸭回归试验结果
易感雏鸭接种后均发病,死亡均在6只以上,雏鸭发病后的临床症状与临床病例基本一致,具有典型的鸭病毒性肝炎症状。发病和死亡情况详见表2。
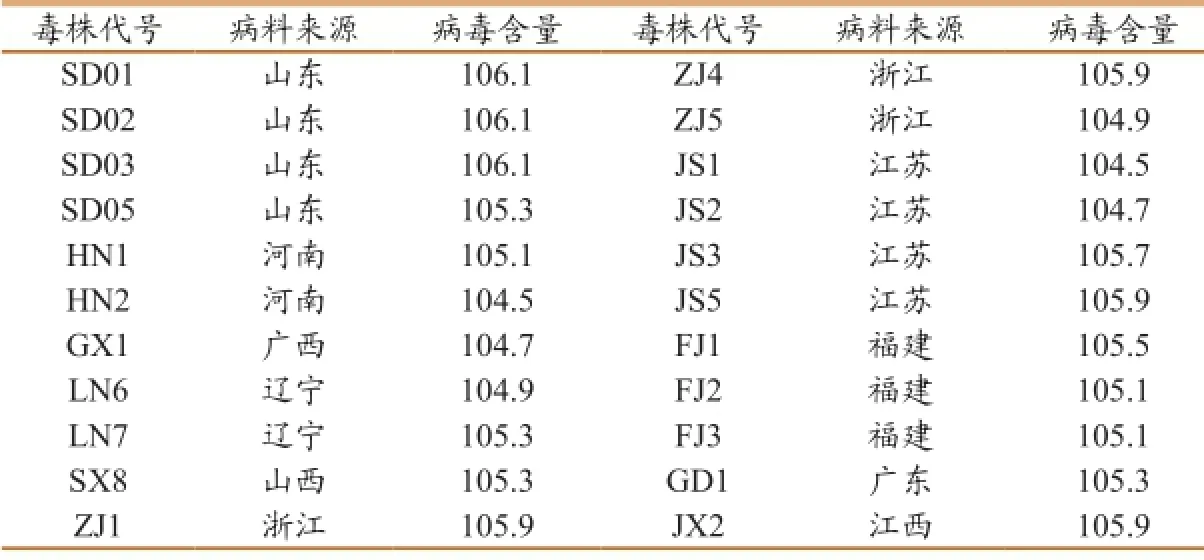
表1分离毒病毒含量检测结果(ELD50/0.2ml)

表2分离毒易感雏鸭回归试验结果

图1A DHV-1引物扩增条带
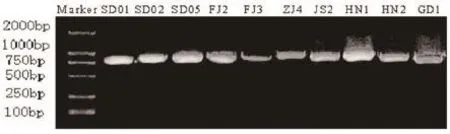
图1B N-DHV引物扩增条带
2.5 RT- PCR检测结果
采用DHV-1标准毒株VP1基因的引物进行RT-PCR检测,结果显示,JX2、SD03、ZJ1、 ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株均扩增出大小约710 bp的目的条带(图1A);采用韩国N-DHV株VP1基因的引物进行RT-PCR扩增,结果显示,SD01、SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株病毒均扩增出大小约760bp的目的条带(图1B)。
2.6 VP1基因同源性分析
利用DNAMan软件对扩增的22株病毒的VP1基因进行序列分析,比较不同血清型毒株VP1基因核苷酸序列及推导的氨基酸序列的同源性和差异。结果显示,JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株与标准毒株DRL-62 株的核苷酸序列同源性在91.7%~95.5%之间,氨基酸序列同源性在90.6%~94.9%之间;与其他N-DHV毒株的核苷酸序列同源性为70%左右,氨基酸序列同源性小于75%。SD01、SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株与DRL-62株的核苷酸序列同源性在69.1%~71.7%之间,氨基酸序列同源性在68.4%~70.3%之间;与新型DHV的SD01毒株核苷酸序列同源性在92.5%~99.0%之间,氨基酸序列同源性在91.2%~98.3%之间,10株病毒间的核苷酸序列同源性在96.5%~99.0%之间,氨基酸序列同源性在96.2%~99.2%之间。
2.7 依据VP1基因同源性的血清型分型
参照同属于微RNA病毒的人肠病毒(Human Enteroviruses)血清型分型标准,即VP1基因的核苷酸序列同源性≥75%、推导的氨基酸序列同源性≥88%的毒株可判定为同一血清型。根据各毒株VP1基因核苷酸及氨基酸序列同源性分析的结果,可判定,JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株与DRL-62株属于同一血清型(核苷酸序列同源性>95%,推导氨基酸序列同源性>93%);SD01、SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株与DRL-62株属于不同的血清型( 核苷酸序列同源性<69%,推导氨基酸序列同源性<78%);与韩国N-DHV株属于同一血清型(核苷酸序列同源性>92%,推导氨基酸序列同源性>91%)。
2.8 遗传进化分析
采用MEGA4.0软件对DHV各毒株VP1氨基酸序列进行比对,绘制遗传进化树。结果表明JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株与DRL-62株属同一基因型,而与SD01处于不同分支;SD02、SD05、FJ2、FJ3、ZJ4、JS2、HN1、HN2和GD1与SD01株属同一基因型,而与DHV-1(DRL-62株)处于不同分支。
3 讨论
本研究从不同地区采集的35份病料中分离到了22株病毒,经血清学鉴定均为鸭肝炎病毒,但其中12株为Ⅰ型鸭肝炎病毒,10株为新型鸭肝炎病毒;22株分离毒接种易感雏鸭后均出现典型的鸭病毒性肝炎症状。依据VP1基因划分血清型标准,对以上DHV各分离株血清型进行判定,结果表明,JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株属Ⅰ型鸭肝炎病毒;SD01、SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株属于新型鸭肝炎病毒;依据VP1基因序列同源性进行的血清型分型结果与依据抗原性鉴定进行的血清型分型结果完全一致。
分析、遗传进化树与血清型判定各项结果均表明:JX2、SD03、ZJ1、ZJ5、JS1、JS3、JS5、FJ1、GX1、LN6、LN7和SX8株与DRL-62株处于同一进化分支,亲缘关系密切。SD02、SD05、FJ2 、FJ3、ZJ4、JS2、HN1、HN2和GD1株与SD01株共同组成一个遗传关系群。对22株DHV VP1氨基酸突变差异分析表明,变异可能与毒株的生物学特性、采样时间、地点有一定的关系。血清型鉴定与抗原相关VP1基因序列分析结果表明,我国目前存在DHV-1和N-DHV两种DHV同时流行。依据VP1 氨基酸序列构建的遗传进化树显示:12株DHV-1与DRL-62株处于同一进化分支;10株N-DHV与韩国N-DHV AP-04114毒株处于同一进化分支,同进化支毒株间遗传关系密切。国内DHV-1和N-DHV各分离毒株间基因差异较小,抗原性稳定,未产生亚型变异。本研究为雏鸭病毒性肝炎的诊断和防治提供重要依据。
[1] Levine p p,Fabricant J.A hitherto-undescribed virus disease of ducks in North America[J].Cornell Vet,1950,40:71-86.
[2] 苏敬良,黄瑜,贺荣连,等.新型鸭肝炎病毒的分离及初步鉴定[J].中国兽医科技,2002,32(1):15-16.
[3] 施少华,苏敬良,黄瑜,等.鸭肝炎病毒新血清型基因组序列分析[J].微生物学报,2009,49(3):309-315
[4] 范书才,李虹,袁率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[5] Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus reveal the presence of a new genoand serotype when compared to duck hepatitis virus type 1 type stains [J].Arch Virol,2007,152(11):2059-2072.
[6] Tseng C H,Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus [J].Virus Res,2007,126(1-2) :19-31.
[7] Oberste M S,Maher K.Molecular evolution of the human enteroviruses:correlation of serotype with VP1 sequence and application to picornavirus classifcation [J].J Virol,1999,73(3):1941-1948.
Isolation and Identifcation of Duck Hepatitis Virus
Xu Baojuan,Guo Weiwei,Gong Xiao,Li Lumei,Song Xinyu,Fan Gencheng
(Qingdao Yebio Bio-engineering Co Ltd,Qingdao,Shandong 266032)
22 strains of duck hepatitis virus (DHV) were isolated from sick or died ducks with typical symptoms of duck hepatitis in Shandong,Henan,Zhejiang,Jiangsu,Guangxi,Shanxi,Jiangxi,Guangdong,Fujian and Liaoning Provinces from 1999 to 2008. Serum neutralization test were conducted using duck hepatitis virus I type (DHV-1)antiserum and the new DHV (N-DHV) antiserum with these 22 strains. The VP1 genes of the isolated strains were amplifed using RT-PCR and then sequenced. Amino acid sequences of VP1 were then deduced and analyzed. The results showed that there were two serotypes of DHV in China. Among the 22 strains,12 strains were in DHV-1 and 10 strainsin N-DHV. The serotyping result based on the homology of VP1 gene sequences was identical to the result based on the antigenicity serotyping. Amino acid sequence homology was 95% within 12 DHV-1 strains and 98% within 10 N-DHV strains respectively. The amino acid homology of VP1 gene was 72~77% between DHV-1 and N-DHV strains. The less variation of VP1 gene in the same serotype strains suggested that the antigenicity of DHV was stable.
duck hepatitis virus;VP1 gene;sequence analysis;serotype;isolation;identifcation
S852.65
:A
:1005-944X(2014)09-0064-05
