亲和素作为合成肽疫苗载体的初步研究
2014-02-18吴美丽蒋文明侯广宇庄青叶王楷宬李金平于建敏王素春黄保续陈继明
吴美丽,蒋文明,刘 朔,侯广宇,庄青叶,王楷宬,李金平,于建敏,王素春,黄保续,陈继明,单 虎
(1. 青岛农业大学,山东青岛 266109;2. 中国动物卫生与流行病学中心,山东青岛 266032)
亲和素作为合成肽疫苗载体的初步研究
吴美丽1,2,蒋文明2,刘 朔2,侯广宇2,庄青叶2,王楷宬2,李金平2,于建敏2,王素春2,黄保续2,陈继明2,单 虎1
(1. 青岛农业大学,山东青岛 266109;2. 中国动物卫生与流行病学中心,山东青岛 266032)
将人工合成带有生物素标记的禽流感病毒两条多肽与亲和素结合,形成亲和素-生物素-合成肽连接物,然后免疫小鼠。采用酶联免疫吸附试验进行抗体检测。检测结果发现这些连接物能够诱导抗亲和素抗体的产生,但不能诱导抗合成肽抗体的产生,检测结果表明亲和素不能借助其与生物素的特异性结合,成为合成肽疫苗的理想载体。
合成肽疫苗;亲和素;生物素;载体;禽流感病毒
现在用于疫病预防的疫苗大多数是对病原体进行灭活或者减毒而制备的。实际上,这些疫苗诱导产生的保护性免疫反应通常仅局限于疫苗中少数氨基酸或多肽[1]。人工合成这些诱导保护性免疫反应的多肽,将它们与某些大分子(即载体)共价偶联后,能刺激机体产生保护性免疫反应。这类疫苗被称为合成肽疫苗。目前,口蹄疫合成肽疫苗已应用于我国口蹄疫的防控[2]。
合成肽疫苗具有生产成本小、使用安全、副作用小等优点[1],但这类疫苗在载体选择和偶联等方面,仍然存在诸多困难和疑惑。目前,合成肽疫苗的载体都依靠化学共价偶联,不仅操作上较为困难,也难以控制偶联的质量。亲和素(Avidin,本文缩写为AV)与合成肽上标记的生物素(Biotin,本文缩写为B)能特异性结合,且这种结合反应结合力强,操作简单,质量易于控制[3]。但是,亲和素能否借助这种特异性结合,成为合成肽疫苗的载体,尚不明确。本研究人工合成带有生物素标记的禽流感病毒两条保守的多肽,将这两条多肽与亲和素结合,形成亲和素-生物素-合成肽连接物,然后分别免疫小鼠,用酶联免疫吸附试验检测抗体,检验这些连接物是否能够诱导产生针对合成肽的抗体。
1 材料与方法
1.1 多肽合成
由上海生工生物工程公司合成禽流感病毒基因中两个保守的多肽,各20mg。其序列分别为RIENLNKKMEDGFLDVWTYNAELLVLMENERTLDFHDSNVKNLYDKVRL QLRDNA和MSLLTEVETPTRNEWECRCSDSSD。这两条合成肽分别针对禽流感病毒HA和M基因上一段保守的区域;以前研究提示它们能够作为B细胞表位,诱导机体产生保护性抗体[4-5]。它们在N端都加有生物素,C端用氨基封闭。这两合成肽分别命名为B-HA和B-M。
1.2 合成肽与亲和素的连接
取340µL 200 µg/mL合成肽B-HA,加入660 µL亲和素(购自上海生工生物工程公司,配成5 mg/mL),混匀,37 ℃水浴反应45 min,制备成B-HA与亲和素的连接物(命名为AV-B-HA);同法制备合成肽B-M与亲和素的连接物(命名为AV-BM)。
1.3 免疫抗原的制备
取14 µL的B-HA(5 mg/mL),加入986 µL磷酸盐缓冲液(PBS),然后加入1 mL佐剂,乳化制备成B-HA免疫抗原,同法制备B-M免疫抗原;取660 µL 亲和素(5 mg/mL),加入340 µL PBS混匀后,加入1mL佐剂,乳化制备成AV免疫抗原;取上述水浴反应制备的AV-B-HA连接物1 mL,加入1 mL佐剂,乳化制备成AV-B-HA免疫抗原,且同法制备AV-B-M免疫抗原。上述抗原所用佐剂均为弗氏不完全佐剂(购自Sigma-Aldrich),乳化时间均为4~5 h,达到完全乳化的效果。
1.4 小鼠免疫
10日龄清洁级雌性小鼠18只(购自北京维通利华实验动物技术公司)随机分成6组;每组3只。第1至第5组分别接种B-HA、AV-B-HA、AV、B-M、AV-B-M免疫抗原;每只小鼠接种0.3 mL;每只小鼠首次免疫后第25天,进行再次免疫;每组再次免疫所用的抗原和剂量同首次免疫;第六组为空白对照,不接种任何抗原。
1.5 血清样品的采集
每只小鼠在首次免疫后第20天和再次免疫后第30天,断尾,用毛细管采血。每只鼠采血20µL,加到100 µL PBS中,37 ℃放置2 h,4 ℃放置过夜,1500 r/ min离心5 min,分离血清,保存在-- 20 ℃。
1.6 抗体检测
酶联免疫吸附试验(ELISA)板(购自海门市盛邦实验器材公司);链霉亲和素(streptavidin,本文缩写为SA,购自上海生工生物工程公司,它也能与生物素强有力地结合,但与亲和素在抗原性上有显著差异)。用SA、AV、SA-B-HA、SA-B-M、AV-B-HA、AVB-M分别作为包被抗原,浓度均为10 µg/mL。在ELISA板中,每孔加入包被抗原100 µL,4℃包被12 h,再用5 %脱脂乳37 ℃封闭2 h,然后加入稀释好的鼠血清,37℃反应2 h,再加入加酶标羊抗鼠抗体(购自武汉博士德生物工程有限公司),37℃反应1 h,再加入底物TMB(购自Amresco)进行反应,然后用硫酸终止反应,最后在OD450波长下测定各孔OD450值。在加封闭液、鼠血清、酶标羊抗鼠抗体、底物之前,均用含吐温的PBS液进行洗涤。
2 实验结果
2.1 首次免疫后抗体检测结果
用含链霉亲和素(SA)的抗原,包括SA、SA-B-HA、SA-B-M,包被ELISA板,检测各种抗原免疫小鼠的血清,得到的OD值均很低(表1)。用AV-B-HA包被ELISA板,检测AV-B-HA免疫的小鼠血清,用AV-B-M包被ELISA板,检测AV-B-M免疫的小鼠血清,用AV包被ELISA板,检测AV免疫的小鼠抗体,得到的OD450都较高(表1)。阴性对照小鼠的血清检测的OD值均<0.08(表中未列出)。
2.2 再次免疫后抗体检测结果
再次免疫后抗体检测结果,与首次免疫后抗体检测结果,完全相似(表2)
3 讨论
试验结果表明:用合成肽B-HA和B-M免疫小鼠,不能诱导抗合成肽的抗体,这是因为它们没有与载体偶联;用亲和素(AV)免疫小鼠,能诱导抗AV的抗体,但不能诱导链霉亲和素(SA)的抗体,说明AV与SA虽然都能与生物素紧密结合,但是它们没有共同的抗原位点。

表1 5种抗原首次免疫后ELISA检测OD450值
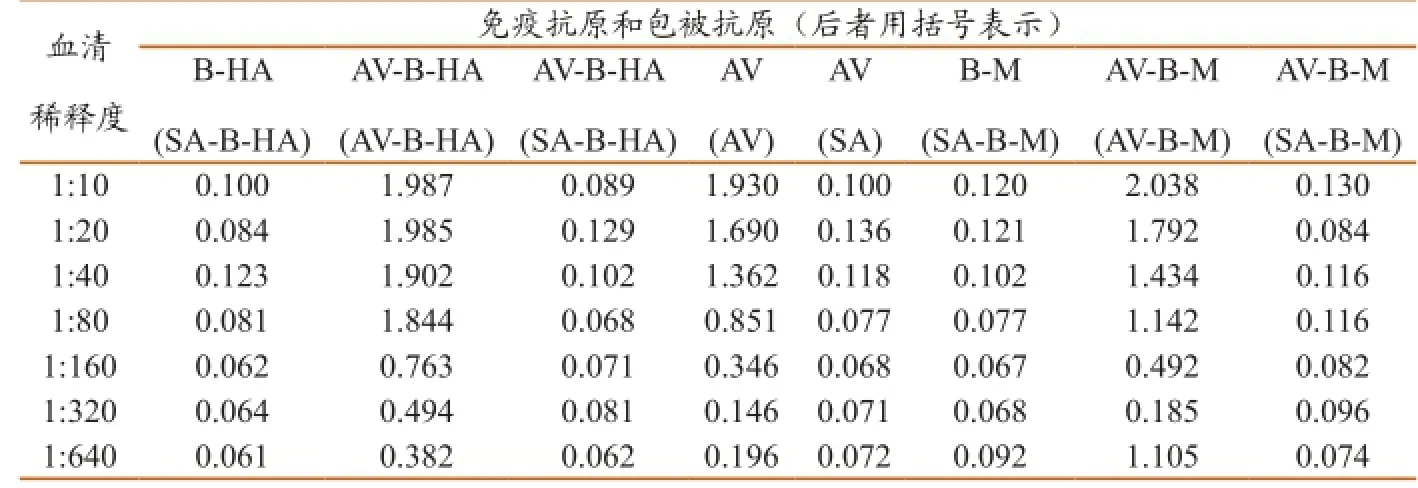
表2 5种抗原再次免疫后ELISA检测OD450值
结果还表明用AV-B-HA免疫,能诱导产生抗AV-B-HA的抗体,但是不能诱导产生抗SA-B-HA的抗体,而用AV-B-M免疫,能诱导产生抗AV-BM的抗体,但是不能诱导产生抗SA-B-M的抗体。这说明AV-B-HA或AV-B-M免疫能诱导针对AV的抗体,不能诱导针对合成肽B-HA或B-M的抗体。因此,本研究提示AV不能借助于它与生物素的特异性结合,成为合成肽疫苗的理想载体。
合成肽疫苗诱导机体产生针对合成肽的抗体通常需要以下步骤。首先,抗原提呈细胞(antigen presenting cell,APC)捕获这些合成肽与载体的连接物,然后将它们运送到APC细胞内的吞噬小体中,在吞噬小体中对合成肽与载体的连接物进行切割,形成T细胞表位(T cell epitope,TCE),然后APC将TCE通过MHC-II分子,提呈给T辅助细胞,激活T辅助细胞。被激活的T细胞与特定的B细胞,即与合成肽-载体连接物中的载体那部分相结合的B细胞,相互作用,能激活这些B细胞产生抗载体的抗体;而被激活的T细胞与特定的B细胞,即与合成肽-载体连接物中的合成肽那部分相结合的B细胞,相互作用,才能激活这些B细胞产生抗合成肽的抗体[6]。
本研究提示亲和素借助于它与生物素的特异性结合,形成亲和素-生物素-合成肽的连接物,只能诱导机体产生针对载体的抗体,不能诱导机体产生针对合成肽的抗体。其原因可能是在疫苗乳化阶段,或进入机体内部在T细胞和B细胞激活之前,在某种化学作用、物理作用或生物作用下,亲和素与标记生物素的合成肽的连接物被断开,从而不能刺激机体产生针对抗合成肽的抗体;也有可能合成肽通过生物素与亲和素连接后,其发生了空间构象的变化,导致合成肽的抗原性发生改变。由于缺乏深入研究的数据,本研究发现的亲和素借助于它与生物素的特异性结合,作为合成肽疫苗的载体,不能诱导机体产生针对合成肽的抗体的具体原因,尚并不清楚。继续深入开展这项研究,不仅有利于进一步提高合成肽疫苗研究水平,也能够以此为模型,研究体液免疫反应或抗体产生的机制。
[1] WHO. Guidelines for the production and quality control of synthetic peptide vaccine[EB/OL]. (1999) [2013-9-15]. http://www.who.int/biologicals/vaccines/synthetic_peptide_ vaccines/en/.
[2] Bittle J L,Hoµghter R A,Alexander H,et al. Protection against foot and mouth disease by immunization with a chemically synthesized peptide predicted from the viral nucleotide sequence [J]. Nature,1982,298:30-33.
[3] Vaknin D,Als-Nielsen J,Piepenstock M,et al. Recognition processes at a functionalized lipid surface observed with molecular resolution [ J ] . Biophysical journal,1991 ,60(6):1545 - 1552.
[4] Michael S,Marina D F,Walter F,et al. Universal M2 ectodomain-based influenza A vaccines:preclinical and clinical developments [J]. Expert Rev Vaccines,2009,8(4):499-508.
[5] Lee J S,Chowdhury M Y,Moon H J,et al. The highly conserved HA2 protein of the influenza a virus induces a cross protective immune response [J]. Journal of Virological Method,2013,194:280-288.
[6] 陈继明,黄保续. 重大动物疫病流行病学调查指南[M].北京:中国农业科学技术出版,2009:45-50.
Preliminary study of avidin as synthetic peptide vaccine carrier
Wu Meili1,2,Jiang Wenming2,Liu Shuo2,Hou Guangyu2,Zhuang Qingye2,
Wang Kaicheng2,Li Jinping2,Yu Jianmin2,Wang Suchun2,Huang Baoxu2,Chen Jiming2,Shan Hu1
(1. Qingdao Agriculture University,Qingdao 266109,China;
2. China Animal Health and Epidemiology Center,Qingdao 266032,China.)
In this study,two peptides labeled of avian infuenza virus with biotin were synthesized,and mixed with avidin to form avidin - biotin - peptide complexes,and used to immunize mice. Antibody was detected by enzyme linked immunosorbent assay (ELISA). The detection results showed that these complexes could induce anti-avidin antibodies,but they couldn’t induce antibodies against the synthesized peptide,suggesting that avidin cannot be considered as an ideal carrier of synthetic peptide vaccine through its specifc binding to biotin.
synthetic peptide vaccine;avidin;biotin;carrier;avian infuenza virus
S852.659.5;TQ563.7
:B
:1005-944X(2014)09-0077-03
陈继明
