不同荧光RT-PCR试剂盒检测H7亚型禽流感病毒的比较
2014-02-18
(广州市动物疫病预防控制中心,广东广州 510440)
不同荧光RT-PCR试剂盒检测H7亚型禽流感病毒的比较
郑丽兰,张海明,张海冰,沈 丹,段晓冬
(广州市动物疫病预防控制中心,广东广州 510440)
[目的]比较评价4种H7亚型禽流感病毒荧光定量PCR试剂盒检测结果的差异。[方法] 同时用4种H7亚型禽流感病毒荧光定量PCR试剂盒对已知结果的抗原和145份家禽泄殖腔棉拭子进行检测,并对检测结果进行比较分析。[结果]WHO推荐的方法和厂家A的检测试剂盒的灵敏度最好,在将H7禽流感抗原稀释至1∶10-7时均能检测到禽流感病毒;而厂家B的试剂盒在抗原浓度1∶10-4以上时均能检测到禽流感病毒,但在1∶10-4至1∶10-7的稀释度则只能判定为可疑,需要进行重新检测;厂家C的H7亚型禽流感病毒检测试剂盒的灵敏度更差,只在抗原浓度1∶10-3以上时显示阳性,抗原浓度为1∶10-6和1∶10-7时均不能检测到H7亚型禽流感病毒。另外,4种试剂盒均表现出较好的特异性和重复性。[结论]不同厂家H7亚型禽流感病毒检测试剂盒的灵敏度等方面存在一定差异,WHO推荐的H7亚型禽流感病毒检测方法和厂家A的总体性能优于试剂盒B和C,适于临床检测与筛查。
禽流感病毒;H7亚型;荧光RT-PCR;比较
2013年2月以来,我国浙江、江苏、广东等十多个省份相继出现人感染H7N9亚型禽流感病毒的事件[1-2],截止到2013年10月25日,已经造成137人感染,其中45人死亡[3-6]。该事件给我国养禽业造成了巨大的经济损失[7-9]。同年5月18日,我单位在日常例行监测工作中,在广州市增城某市场检测到H7N9亚型禽流感病毒,并及时采取相应的措施,为防止病毒扩散和预防我市市民感染H7N9亚型禽流感起到了十分重要的作用。众所周知,采取相应的措施控制疫情扩散的前提之一即为快速、准确地对疫情进行检测和确诊。由于H7N9亚型禽流感感染家禽后不表现明显的临床症状[10-11],因此,利用实验室检测方法对其进行及时检测和确诊显得尤为重要,而荧光RT-PCR方法作为一项快速、高度敏感、高度特异和高通量检测新型检测技术已经广泛应用于包括H7N9禽流感病毒检测在内的动物疫病检测工作中,并成为多种病原检测的首选方法[12-13]。
目前,市场上针对H7亚型禽流感病毒的荧光RT-PCR检测试剂盒种类较多,但由于试剂盒生产企业的扩增目的片段不尽相同及其技术平台不同,不同试剂的敏感性、特异性和准确率等方面可能存在一定的差异,因此,为保证检测的准确性和疫情控制的及时性,本试验对目前市场上的几种主要的H7亚型禽流感荧光RT-PCR试剂盒进行比较,分析其检测的敏感性和特异性,为试剂盒的选择提供参考。
1 材料与方法
1.1 试剂
H7亚型禽流感病毒荧光RT-PCR检测试剂盒分别购自目前市场上较为常见的三家公司,分别命名为厂家A、厂家B和厂家C ;世界卫生组织(WHO)推荐的H7亚型引物和探针由英韦创津(上海)贸易有限公司合成,序列见表1; RNA提取试剂盒购自美国应用生物系统公司(美国ABI公司)。

表1 H7亚型禽流感病毒实时RT-PCR的引物和探针序列
1.2 主要仪器
AB I 7500实时荧光核酸扩增仪,Kingfsher Flex磁珠分选纯化仪。
1.3 阳性样品
H7亚型禽流感抗原(H7N9禽流感毒株,批号2013001)、H5亚型禽流感HA抗原和H9亚型禽流感检测阳性抗原购自哈尔滨兽医研究所(批号分别为2013002和2012002);新城疫病毒HA抗原购自北京中海生物技术有限公司(批号为20130601)。
1.4 临床样品来源
145份家禽泄殖腔棉拭子源自本所2013年4~6月对广州市家禽交易市场例行监测的样品。
1.5 方法
1.5.1 核酸提取
严格按照试剂说明书进行操作:于试剂板样品孔中加入50 uL经充分振荡混悬的样品液体,随后每孔分别加入130 uL裂解液和20 uL磁珠Enhancer混合液(1∶1混合),再将所有试剂板置于Kingfsher Flex磁珠分选纯化仪进行核酸提取。阴、阳性样品操作同待检样品。
1.5.2 核酸检测和结果判定
WHO推荐的H7亚型禽流感病毒检测方法按WHO推荐的程序进行;其它三个不同厂家的检测试剂盒按说明书进行操作,并按照试剂盒说明书判定标准对结果进行判定。
1.5.3 灵敏性试验
将H7亚型禽流感抗原按10倍稀释成不同浓度(即7个滴度,分别为 1∶10、1∶100、1∶1000、1∶10000至1∶10-7),再用不同试剂盒同时进行检测以比较不同试剂盒的灵敏性。
1.5.4 特异性试验
分别对H5亚型禽流感HA抗原、新城疫病毒HA抗原和H9亚型禽流感检测HA抗原(各2个重复)进行核酸抽提,随后分别用上述4种H7亚型实时RT-PCR试剂盒进行检测。
1.5.5 重复性试验
对上述未稀释以及10倍稀释的H7亚型禽流感HA抗原进行核酸提取后,分别应用上述4种实时RT-PCR方法进行多次重复测定(n = 4),并通过统计学方法分析其重复性。
1.6 临床样品的检测
用上述4种检测试剂盒对临床采集的145份家禽泄殖腔棉拭子进行H7亚型禽流感病毒的检测,结果检出1份阳性和144份阴性,4种H7亚型荧光RT-PCR检测试剂盒检测结果一致。
1.7 统计学分析
试验所得数据运用SPSS 20统计软件进行分析。
2 结果
2.1 敏感性
以10倍梯度稀释的H7亚型禽流感抗原提取的RNA为模板,用四种荧光定量RT-PCR方法进行敏感性试验,并根据各自结果判定标准进行结果判定,发现WHO推荐的方法和厂家A的试剂盒检测均为阳性;而厂家B的试剂盒在10-4的稀释度以下均为阳性,而稀释度为10-5到10-7时均为可疑;用厂家C的试剂盒检测时,抗原稀释度在10-3以下时均为阳性,而在10-4和10-5时均为可疑,10-6和10-7时则均为阴性(表2)。对判定为可疑的样品,根据试剂盒说明书的要求进行了重复检测,结果均为阳性。
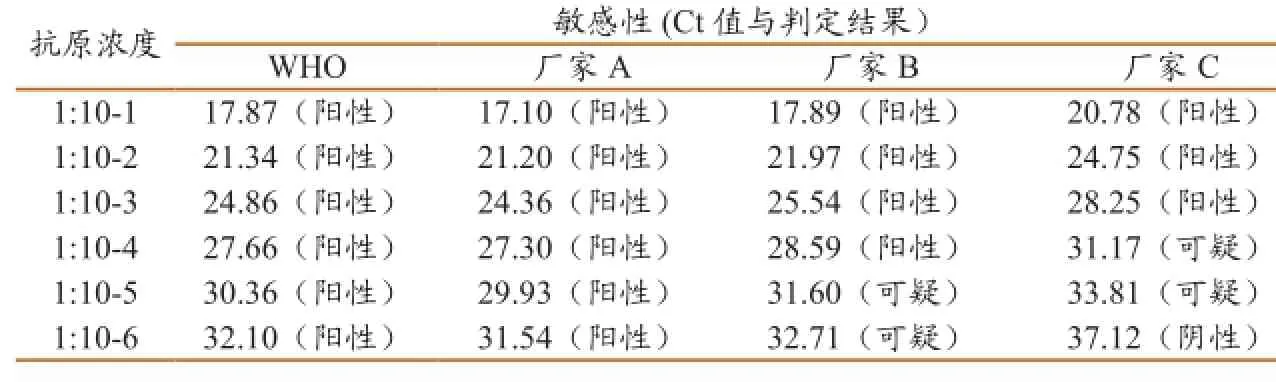
表2不同试剂盒灵敏性与结果判定比较
2.2 特异性
四种实时RT-PCR试剂盒均能检出H7亚型禽流感病毒,而对H5亚型禽流感HA抗原、新城疫病毒HA抗原和H9亚型禽流感均不能检测到任何荧光信号,说明这几种检测试剂盒特异性均较好。
2.3 重复性
重复试验结果表明,不同浓度参比样品进行了4次检测,4种荧光定量RT-PCR检测方法的变异系数均小于5%(表3),说明4种荧光定量PCR试剂盒都具有良好的结果重复性。
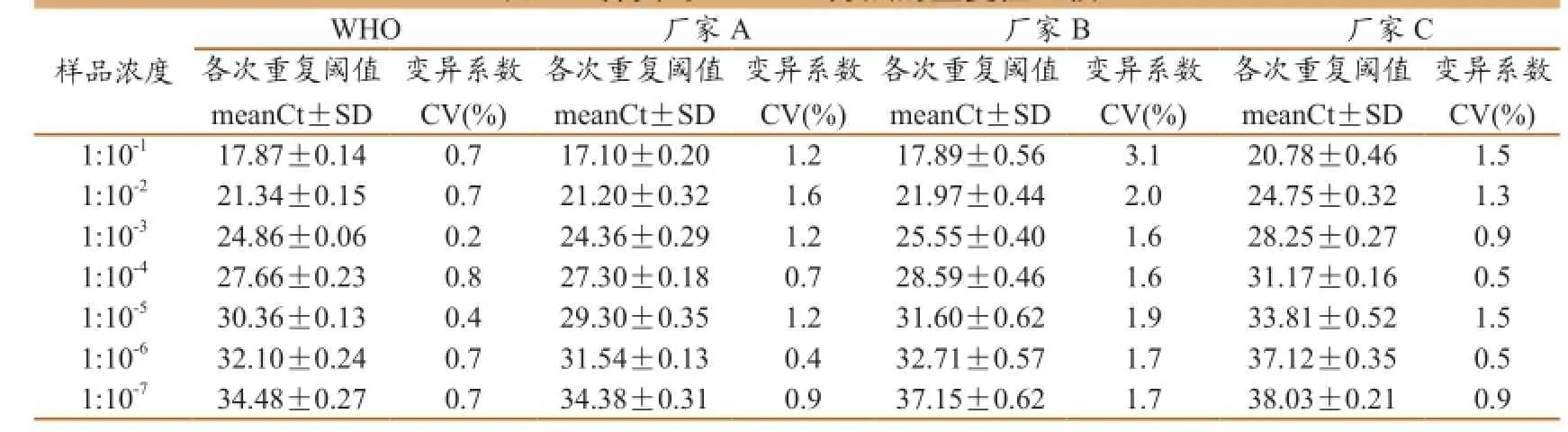
表3 4种实时RT-PCR方法的重复性比较
3 讨论
H7亚型禽流感病毒最先的报道是1902年的高致病性H7N7亚型禽流感病毒(A/Chicken/Brescia/1902(H7N7)),曾被认为是“鸡瘟(FEV)”[14]。近年来,全球范围内家禽中H7亚型禽流感已导致超过7000万家禽死亡,不仅波及美国、加拿大、智利等美洲国家,也波及巴基斯坦、德国、荷兰等亚欧国家,涉及H7N1、H7N3、H7N4、H7N7等低致病性毒株的多种亚型以及H7N1、H7N2、H7N3、H7N8 、H7N9等高致病性毒株的多种亚型[14]。2003年以前,人感染H7亚型禽流感的报道较少,且一般为实验室感染。2013年以前在人群中最大规模的暴发是在2003年的荷兰,该次H7N7亚型禽流感疫情共造成80余人感染,还导致了3000多万家禽死亡[15-16]。2013年3月,我国上海和安徽两地首先发现3例人感染新型重配H7N9亚型禽流感病毒的病例,在随后的几个月时间里,我国又有十多个省市陆续报道人感染和死亡,H7N9亚型禽流感不仅对公众健康的造成了巨大的威胁,也给我国养禽业带来了巨大的损失[9,17-18]。人感染H7N9禽流感事件发生后,病毒检测与分离、基因测序等工作迅速开展,特别是实时RT-PCR等快速检测方法的及时建立与应用,为动物卫生部门和卫生部门对H7N9亚型禽流感感染的及时确诊和有效处置提供了坚实的技术支持[19-20]。但是,随着商品化检测试剂的推出,在为检测工作带来便利的同时,由于不同厂家试剂盒的敏感性、特异性等有所差异,导致结果会有所偏差,有的甚至会漏检。因此需要对这些商品化试剂盒进行评估,以便为选择最合适的试剂盒以对H7N9亚型禽流感病毒的确诊提供技术依据。
本试验中所选的3个厂家的试剂盒是目前国内H7亚型禽流感检测常用的试剂盒,而WHO推荐的检测方法也是目前公认较为标准的H7禽流感检测方法。我们试验表明,WHO推荐的检测方法和3个厂家的试剂盒均具有较好的特异性和重复性,但是依据各自判定标准的灵敏性试验结果显示,4种检测方法之间差别较大:WHO推荐的方法和厂家A的检测试剂盒的灵敏度最好,在将H7禽流感抗原稀释至1∶10-7时均能检测到禽流感病毒;而厂家B的试剂盒在抗原浓度1∶10-4以上时均能检测到禽流感病毒,但在1∶10-4至1∶10-7的稀释度则只能判定为可疑,需要进行重新检测;厂家C的H7亚型禽流感病毒检测试剂盒灵敏度较差,只在抗原浓度1∶10-3以上时显示阳性,抗原浓度为1∶10-6和1∶10-7时均不能检测到H7亚型禽流感病毒。由于检测的灵敏度不高,当待检样品中病毒浓度不高时,使用厂家B的H7禽流感病毒检测试剂盒可能出现较多的“可疑”的检测结果,需要进行重复检测,这样不仅增加了检测成本和人力成本,更重要的是增加了检测所需要的时间,可能导致疫情诊断甚至处理的延误。而对于厂家C的H7禽流感病毒检测试剂盒,一旦样品中病毒含量较低时,很可能出现漏检的现象。
由于H7N9亚型禽流感病毒感染家禽后只表现轻微的临床症状甚至不表现症状,而该病毒又能引起重大的公共安全问题,因此对于该病毒的检测需要敏感性较高的试剂,以便避免可能的漏检给H7N9亚型禽流感的防控工作带来风险。鉴于此,我们认为WHO推荐的H7亚型禽流感病毒检测方法和厂家A的检测试剂盒试剂对于H7亚型禽流感病毒的快速检测更为合适。
[1] Kendal A P. Epidemiologic implications of changes in the infuenza virus genome[J]. Am J Med,1978,82(1):4-14.
[2] Cardona C J,Xing Z,Sandrock C E,et al. Avian influenza in birds and mammals[J]. Comp Immunol Microbiol Infect Dis,2009,32:255-273.
[3] Webster R G,Bean W J,Gorman O T,et al. Evolution and ecology of influenza A virus[J]. Microbiol Rev,1992,56:152-179.
[4] Gao R,Cao B,Hu Y,et al. Human infection with a novel avian-origin infuenza A(H7N9)virus[J]. N Engl J Med,2013,368(20):1888-1897.
[5]Chen Y, Liang W, Yang S,et al. Human infections with the emerging avian influenza A H7N9 virus from wet market poultry. Clinical analysis and characterization of viral genome[J]. Lancet, 2013,381(9881):1916-1925.
[6] WHO. Number of confrmed human cases of avian infuenza A(H7N9) reported to WHO.http://www.who.int/infuenza/ human_animal_interface/influenza_h7n9/Data_Reports/en/ index.html
[7] 武深树,何兴春,雷勇,等. H7N9 禽流感疫情对家禽业的影响及对策建议[J]. 饲料广角,2013(8):19-20.
[8] 王日强,宁子豪. H7N9禽流感对当前广东家禽业生产的影响和建议[J]. 南方农村,2013(5):9-13.
[9] 张宗军,郝桂兰. H7N9流感事件对家禽业的影响分析[J]. 中国家禽,2013,35(10):52-53.
[10] Liu,D. et al. Origin and diversity of novel avian infuenza AH7N9 viruses causing human infection:phylogenetic,structural and coalescent analyses[J]. Lancet,2013,381:1926-1932.
[11] Zhang Q,Shi J,Deng G,etal. H7N9 influenza viruses are transmissible in ferrets by respiratory droplet[J]. Science,2013,341(6144):410-414.
[12] 华哲云,褚维,宋黎黎,等. 实时荧光RT-PCR在人感染H7N9禽流感病毒检测中的应用[J]. 检验医学,2013,28(9):755-757.
[13] 罗宝正,莫秋华,李儒曙,等. 新型H7N9亚型禽流感病毒多重荧光RT-PCR快速检测方法的建立[J]. 病毒学报,2013,30(1):1-5.
[14] 朱闻斐,高荣保,王大燕,等.H7亚型禽流感病毒概述[J].病毒学报,2013,29(3):245-249.
[15] Fouchier R A,Schneeberger P M,Rozendaal F W,et al. Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome[J]. Proc Natl Acad Sci U S A,2004,101(5):1356-1361.
[16] Adams S,Sandrock C. Avian Influenza. Update[J]. Med Princ Pract,2010,19:421-432.
[17] Bao C J,Cui L B,Zhou M H,et al. Liveanimal markets and infuenza A(H7N9)virus infection[J]. N Engl J Med,2013,368(24):2337-2339
[18] Belser J A,Blixt O,Chen L M,et al. Contemporary North American influenza H7 viruses possess human receptor specifcity:Implications for virus transmissibility[J].Proc Natl Acad Sci USA,2008,105(21):7558-7563.
[19] 石霖,吴运谱,闫海滨,等. 动物H7N9 禽流感荧光RT-PCR 检测技术[J]. 现代畜牧兽医,2013(5):22-24.
[20] 雷永良,王晓光,叶碧峰,等. 丽水市禽流感病毒H7N9 及外环境标本检测分析[J]. 中国卫生检验杂,2013,23(13):2753-2754.
Comparison of different real-time RT-PCR kits for detection of H7 subtype avian infuenza virus
Zheng Lilan,Zhang Haiming,Zhang Haibing,Shen Dan,Duan Xiaodong
(Guangzhou Animal Disease Prevention and Control Center,Guangdong,Guangzhou,510440)
[Objective]To compare and evaluate the effcacy of the four real time RT- PCR diagnostic kits for H7 avian infuenza virus. [Methods]The H7 subtype antigen and 145 cloacal swabs of poultry with known results were detected by the four kits (the WHO recommended kit,Kit A,Kit B and Kit C) and their results were statistically analyzed.[Result]The WHO recommended method and Kit A had the highest sensitivity in detection of H7 virus with the dilution of 1∶10-7. The virus could be detected at the antigen concentration above 1∶10-4and 1∶10-3by Kit B and Kit C respectively. The virus could not be detected when the antigen dilution was 1∶10-6and 1∶10-7using Kit C showing the lowest sensitivity. However,all the four kits showed good specifcity and repeatability. [Conclusion]Different kits for H7 subtype avian infuenza virus had different performance of sensitivity. The overall performance of the WHO method and Kit A was better than the other two kits in screening and clinical surveillance.
avian infuenza virus;H7 subtype;real-time RT-PCR;comparison
S852.659.5;S859
:B
:1005-944X(2014)09-0073-04
