片仔癀调控ABCC1抑制大肠癌HCT-8/5-FU细胞药物外排功能的作用机制研究
2014-02-17黄进明沈阿灵李琼瑜陈宏伟褚剑锋林久茂洪振丰
黄进明,沈阿灵,李琼瑜,齐 飞,洪 绯,陈宏伟,褚剑锋,林久茂,洪振丰,彭 军
(1.漳州片仔癀药业股份有限公司,福建漳州363000;2.福建中医药大学中西医结合研究院,福建福州350122)
片仔癀调控ABCC1抑制大肠癌HCT-8/5-FU细胞药物外排功能的作用机制研究
黄进明1,沈阿灵2,李琼瑜2,齐 飞2,洪 绯1,陈宏伟2,褚剑锋2,林久茂2,洪振丰2,彭 军2
(1.漳州片仔癀药业股份有限公司,福建漳州363000;2.福建中医药大学中西医结合研究院,福建福州350122)
目的 探讨片仔癀对大肠癌HCT-8/5-FU细胞对药物外排功能的影响,并探讨其机制。 方法MTT法检测5-FU对HCT-8/5-FU细胞和HCT-8细胞活力的影响和片仔癀对HCT-8/5-FU细胞活力的影响;倒置显微镜观察片仔癀对HCT-8/5-FU细胞形态的影响;采用罗丹明染色通过流式细胞仪检测片仔癀对其在耐药细胞内蓄积的影响;RT-PCR检测ABC转运蛋白家族重要成员ABCC1的表达。 结果 MTT检测结果显示不同浓度的5-FU干预可显著降低HCT-8细胞活力,呈现一定的剂量依赖和时间依赖,而对HCT-8/5-FU细胞活力未见影响。经片仔癀干预后,HCT-8/5-FU细胞活力也受到显著的抑制;形态学观察表明:随着药物浓度的升高,细胞数目逐渐减少,体积缩小,出现悬浮、脱落而死亡;罗丹明蓄积实验显示:片仔癀干预可显著增加其在细胞内的蓄积;RT-PCR实验表明:经片仔癀干预可显著下调HCT-8/5-FU细胞ABCC1在mRNA水平的表达。 结论 片仔癀可抑制HCT-8/5-FU细胞生长和药物外排功能,通过下调转运蛋白ABCC1的表达是其重要机制之一。
片仔癀;大肠癌;逆转耐药;5-FU
大肠癌是常见的消化道恶性肿瘤之一,其死亡率已位于恶性肿瘤第二位,严重危害人类健康[1]。大肠癌的治疗过程中所产生的多药耐药的现象是造成当前化疗失败的最常见、最难解决的问题。多药耐药(multidrug resistance,MDR)是指在肿瘤细胞对一种化疗药物产生耐药的同时,对其他结构、作用机制不同的药物也产生耐药现象[2]。肿瘤产生MDR的机制极其复杂,其中肿瘤细胞膜上的ATP结合盒式跨膜(ABC)转运蛋白介导的药物外排是MDR产生的主要机制[4]。ABCC1基因编码的多药耐药性相关蛋白(multidrug resistance associated protein,MRP)是ABC(ATP binding cassette)转运蛋白家族的重要成员之一[5],是目前研究的热点。
我国传统中药具有疗效高、靶点多、不良反应少等特点,在逆转耐药的同时有杀伤肿瘤细胞、调节和提高机体免疫功能的多重功效[6-7]。片仔癀(PZH)是传统名贵中成药,由三七、麝香、牛黄、蛇胆等组成,已有研究[8-9]证实:片仔癀对许多晚期癌症患者能明显改善疼痛,缩小瘤体,延长生命,提高生活质量。本课题组前期研究发现片仔癀对大肠癌细胞有明显抑制作用,具有多靶点抗肿瘤活性,既可以直接杀伤肿瘤细胞,抑制肿瘤细胞生长或转移,诱导细胞凋亡分化,抑制肿瘤干细胞的生长[10-16],还可逆转大肠癌耐药[17],但其逆转耐药的机制尚不明晰。故本文旨在探讨片仔癀逆转大肠癌5-FU耐药的可能机制,进一步阐明片仔癀抗大肠癌的分子机制。
1 实验材料
1.1 药物和细胞株 人结直肠癌细胞株HCT-8/5-FU和HCT-8细胞购于南京凯基生物科技发展有限公司;片仔癀片剂(漳州片仔癀药业股份有限公司,生产批号:0908035);5氟尿嘧啶(5-FU,美国sigma公司)
1.2 试剂 RPMI-1640培养基、0.25%胰蛋白酶、胎牛血清(FBS)、琼脂糖、罗丹明(美国Life technology公司);Trizol试剂盒、RT试剂盒、PCR试剂盒(日本TaKaRa公司);Goldview核酸染料(北京赛百盛基因技术有限公司);无水乙醇、氯仿(分析醇,上海化学试剂采购供应站);磷酸盐缓冲液(PBS,美国Hyclone公司)。
1.3 仪器 超净工作台(苏州净化设备公司);ELX 800酶标仪(美国BioTek公司);二氧化碳培养箱(德国Heraeus公司);IX70荧光倒置相差显微镜(日本OLYMPUS公司);9600型PCR仪(美国PE公司);Gel DOC 2000型凝胶成像分析系统、APC 300型电泳仪、水平式电泳槽(美国Bio-Rad公司);5417R高速冷冻离心机(德国Eppendorf公司);低速普通离心机(上海安亭科学仪器厂);微调加样器(德国Eppendorf公司)。
2 实验方法
2.1 药物的配制 PZH溶液:配制前将片仔癀用研磨棒研成粉末,用PBS配制成20 mg/mL的溶液,超声溶解,高压灭菌后-20℃贮存备用。5-FU溶液的配制:称取适量5-FU粉末,溶解于DMSO配制成浓度为含1 M的5-FU溶液,超声30 mim,分装于-20℃贮存备用。使用前置室内恢复室温,用培养基配制成含5-FU培养液。
2.2 细胞培养 采用单层贴壁细胞培养法培养,细胞用含10%FBS的RPMI-1640培养液(含100 U/mL青霉素、100 μg/mL链霉素),置于37℃含5%CO2和饱和湿度的培养箱中培养。加入0.8 mL 0.25%胰蛋白酶消化,后加入2.4 mL的新鲜培养基终止消化后,1 000 rpm/min离心5 min,弃上清收集沉淀细胞,用完全培养液重悬制成新细胞悬液后传代或接种。HCT-8/5-FU和HCT-8细胞分别用含或不含5-FU(15 μg/mL)培养液中培养,实验前或接板前改用不含5-FU的培养基培养。
2.3 MTT法检测细胞活力 取对数生长期细胞,调整细胞终浓度为0.8×105/mL接种于96孔板中,每孔100 μL。分别加入终浓度为25~800 μM的5-FU或0.25~0.75 mg/mL的片仔癀干预。以不加药细胞作为对照组,细胞经药物干预一定时间后,每孔加入0.5 mg/mL的MTT溶液100 μL,37℃培养箱中孵育4 h后,弃去各孔中的MTT液体,加入DMSO各100 μL/孔,振荡混匀,于全自动酶标仪570 nm测定各组吸光度值(即A值),并按下列公式计算细胞活力[8]:
细胞活力/%=(实验组A值/对照组A值)× 100%。
2.4 细胞形态观察 HCT-8/5-FU细胞经不同浓度片仔癀(0 mg/mL,0.25 mg/mL,0.5 mg/mL,0.75 mg/mL)干预24 h后,在倒置显微镜下观察细胞的形态变化并拍照(400×)。
2.5 罗丹明染色观察细胞表面转运蛋白外排功能取对数生长期的HCT-8/5-FU细胞,以2×105个/孔接种于六孔板,37℃培养24 h后,分别加入不同浓度的片仔癀干预,用胰酶消化成细胞悬液,离心收集细胞,调整细胞密度至1×106/mL重悬于培养基中,10 mM罗丹明染液染色,37℃,5%CO2细胞培养箱孵育10 min。用PBS清洗细胞2次,重悬细胞于PBS中,用流式细胞仪(激发波长488 nm)检测荧光强度,判断其在细胞内的蓄集。
2.6 RT-PCR检测ABCC1的mRNA表达水平 取对数生长期的HCT-8/5-FU细胞,以2×105个/mL接种于六孔板,37℃培养24 h后,分别加入不同浓度的片仔癀干预24 h,用PBS洗清洗后每孔加入1 mL Trizol,按说明书进行RNA的抽提。采用逆转录(RT)试剂盒进行逆转录反应。RNA逆转录成cDNA后,在体外进行PCR的扩增反应。反应体系包括:cDNA1 μL上游引物,1 μL,1 μL下游引物,7 μL水及2×PCR Master Mix 10 μL,共20 μL。反应条件为:95℃预变性4 min,95℃变性30 s,退火30 s,72℃延伸45 s,持续35个循环,最后72℃延伸10 min,保存于4℃。ABCC1的引物序列为F:GTCGGGGCAT ATTCCTGGC;R:CTGAAGACTGAACTCCCTTCCT。PCR产物经1.5%琼脂糖凝胶电泳分析后,置于凝胶成像系统进行分析,以GAPDH为内参基因。
2.7 统计学处理 实验数据用SPSS 17.0软件进行统计学分析,计量资料用±s表示,组间比较采用单因素方差分析。
3 结 果
3.1 MTT实验结果 MTT检测细胞活力结果如图1所示,经不同浓度的5-FU干预48 h后,HCT-8细胞活力显著降低,而HCT-8/5-FU细胞活力下降不明显,二者比较具有显著性差异(P<0.05),可见HCT-8/5-FU细胞具有一定的耐药性。如图2所示,与对照组比较,经不同浓度片仔癀(0 mg/mL、0.25 mg/mL、0.5 mg/mL、0.75 mg/mL)干预后,细胞活力显著下降,具有显著性差异(P<0.05),并呈一定的剂量依赖。

图1 不同浓度5-FU干预HCT-8/5-FU和HCT-8的细胞活力影响

图2 不同浓度片仔癀干预对HCT-8/5-FU细胞活力影响
3.2 不同浓度片仔癀对HCT-8/5-FU细胞形态的影响 以不同浓度片仔癀干预24 h后,在倒置显微镜观察细胞的形态变化,结果如图3所示。对照组细胞均匀,核仁清楚,贴壁生长,片仔癀干预后,随着药物浓度的升高,细胞数目逐渐减少,体积缩小,甚至出现悬浮、脱落而死亡。
3.3 罗丹明染色检测片仔癀对细胞药物外排泵功能的影响 罗丹明染色检测结果如图4所示。经不同浓度的片仔癀干预后HCT-8/5-FU细胞中罗丹明荧光波峰右移,提示细胞内荧光明显增强,证实PZH可增加HCT-8/5-FU细胞中罗丹明的蓄积。3.4 片仔癀对ABCC1在mRNA水平表达的影响RT-PCR检测结果如图5所示,以不同浓度PZH干预24 h后,与对照组比较,片仔癀能显著下调ABCC1的mRNA水平的表达,提示通过下调ABCC1的表达可能是片仔癀抑制细胞外排功能的机制之一。

图3 不同浓度片仔癀干预HCT-8/5-FU细胞的形态图
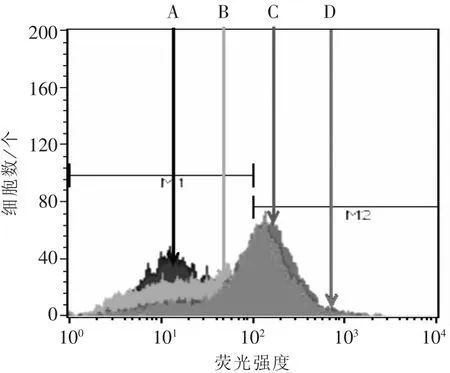
图4 不同浓度片仔癀对HCT-8/5-FU细胞内罗丹明蓄积的流式图
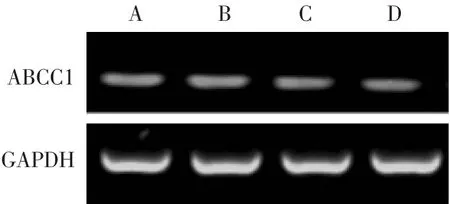
图5 不同浓度片仔癀干预后ABCC1的电泳图
4 讨 论
细胞表面存在具有能量依赖性“药泵”功能的跨膜糖蛋白,能将细胞内带阳性电荷的亲脂类化疗药物逆浓度泵至细胞外,使细胞内化疗药物达不到有效作用浓度而产生耐药性。耐药基因高表达导致细胞对化疗药物的外排增加是导致多药耐药产生的最重要机制之一。目前进入临床应用研究的西药逆转剂仍因作用机制单一、选择性差、毒副作用明显等原因使得其临床应用受到了较大的限制,这也使得具有多成分、多靶点、多途径治疗作用的中药备受关注。临床和基础研究均证实片仔癀可通过调控多条信号转到通路及其下游靶基因表达诱导细胞凋亡、抑制细胞增殖、抑制肿瘤血管新生、干细胞生长和逆转耐药的作用[14-21]。本文通过检测片仔癀对细胞外排功能和转运蛋白家族重要成员ABCC1的表达水平探讨了片仔癀逆转大肠癌的可能机制。MTT检测结果表明:与其亲本细胞相比,HCT-8/5-FU对5-FU具有一定的耐药性,而不同浓度片仔癀作用下,细胞活力受到明显抑制,并呈一定的剂量依赖。显微镜观察进一步证实了片仔癀对HCT-8/5-FU细胞生长的抑制作用。罗丹明染色实验证实了片仔癀干预可显著增加罗丹明在HCT-8/5-FU细胞内的蓄集,降低细胞外排功能。RT-PCR检测结果显示:片仔癀干预可显著下调ABC转运蛋白ABCC1在mRNA水平的表达,该结果提示:通过抑制下调ABCC1的表达降低细胞外排功能可能是片仔癀逆转大肠癌多药耐药的机制之一。
[1] JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3] BAGULEY B C.Multiple drug resistance mechanisms in cancer[J]. Mol Biotechnol,2010,46(3):308-316.
[4] 孙文霞,黄才国.肿瘤多药耐药:机制及逆转剂[J].生命的化学,2012,32(5):395-399.
[5] 李雅婷,窦骏.ABCC1介导多药耐药机制及其逆转的研究进展[J].医学研究生学报,2007,20(4):430-433.
[6] 李景旺.中医药逆转肿瘤多药耐药性的研究进展[J].河北中医,2007,29(6):557-560.
[7] 李志询,刘宗荣,周银桃,等.耐药直肠癌细胞的耐药机制及中药逆转耐药机制的研究[J].中国当代医药,2009,16(21):7-9.
[8] 顾兆雄.片仔癀治疗晚期大肠癌25例疗效观察[J].中成药,1993,15(10):23.
[9] 刘丛盛.片仔癀临床应用综述[J].北京中医,2001,20(5):63-64.
[10]SHEN A L,HONG F,LIU L Y et al.Pien Tze Huang inhibits the proliferation of human colon carcinoma cells via arresting G1/S cells cycle progression[J].Oncology Letters,2012,4(4):767-770.
[11]SHEN A L,CHEN Y Q,HONG F,et al.Pien Tze Huang suppresses IL-6-inducible STAT3 activation in human colon carcinoma cells through Induction of SOCS3[J].Oncology Reports,2012,28(6):2125-2130.
[12]SHEN A L,HONG F,LIU L Y,et al.Effects of Pien Tze Huang on angiogenesis in vivo and in vitro[J].Chinese Journal of Integrative Medicine,2012,18(6):431-436.
[13]ZHUANG Q C,HONG F,SHEN A L,et al.Pien Tze Huang inhibits tumor cell proliferation and promotes apoptosis via suppressing the STAT3 pathway in colorectal cancer mouse[J].International Journal of Oncology,2012,40(5):1569-1574.
[14]SHEN A L,LIN J M,CHEN Y Q,et al.Pien Tze Huang inhibits tumor angiogenesis in a mouse model of colorectal cancer via suppression of multiple cellular pathways[J].Oncology Reports,2013,30(6):1701-1706.
[15]WEI L H,CHEN P Y,CHEN Y Q,et al.Pien Tze Huang suppresses the stem-like side population in colorectal cancer cells[J]. Molecular Medicine Reports,2014,9(1):261-266.
[16]魏丽慧,林久茂,彭军,等.片仔癀对人结肠癌细胞株干细胞的影响[J].福建中医药,2012,43(1):45-47.
[17]蔡巧燕,沈阿灵,林久茂,等.片仔癀逆转人结肠癌HCT-8/5-Fu耐药性的实验研究[J].福建中医药,2013,44(1):58-60.
R285.5
:A
:1000-338X(2014)06-0051-03
2014-9-20
国家自然科学基金(81373819);中国博士后科学基金(2012M511437,2013T60636)
黄进明(1966—),男,主要从事中药的研发工作。
彭军(1969—),男,教授,博士生导师。
E-mail:pjunlab@hotmail.com
