大鼠视神经少突胶质细胞培养方法的改良
2014-02-16王晓虹王苏平车菊华朱艳玲
王晓虹,王苏平,车菊华,王 虹,汪 涛,朱艳玲
·基础研究·
大鼠视神经少突胶质细胞培养方法的改良
王晓虹,王苏平,车菊华,王 虹,汪 涛,朱艳玲
目的改良既往新生大鼠视神经组织块培养法体外培养少突胶质细胞。方法新生2 d SD大鼠,无菌条件下取双侧视神经,置于预先涂有多聚赖胺酸的培养皿中(直径3.5 cm),加入基础培养液约400 μL;培养第4天时,更换为含0.5%胎牛血清化学限定培养液约400μL;约第10天时,更换为无胎牛血清化学限定培养液约600μL;第11天行髓鞘碱性蛋白(myelin basic protein,MBP)细胞免疫化学鉴定,计算阳性细胞百分率。重复培养3次,方差分析方法的稳定性。结果视神经培养至第11天,每皿细胞数可达(6~8)×105个,90%以上为MBP阳性细胞;3次培养细胞的MBP免疫细胞化学染色阳性细胞百分率差异无统计学意义(P>0.05)。结论本实验方法所得成熟少突胶质细胞纯度高,数量足够一般细胞生物学实验使用,且方法简便、稳定。
视神经;少突胶质细胞;细胞培养
少突胶质细胞是中枢神经系统的髓鞘形成细胞,其突起包绕神经元轴突构成多层膜性结构,协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能。开展少突胶质细胞的体外培养,有利于研究少突胶质细胞形成髓鞘的机制、损伤后修复,为临床治疗遗传性脱髓鞘、多发性硬化的少突胶质细胞相关疾病奠定基础。由于脑组织中含有多种神经细胞,同时成熟的少突胶质细胞不再具有分裂增殖能力,为分裂终期细胞[1],因此如何获取纯化、足量的少突胶质细胞是深入研究的前提。少突胶质细胞的培养方法有震荡法[2]、免疫“淘选”法[3]和神经干细胞定向分化培养[4]等,但前者获取的细胞数量少,而后两者要求的条件较高、花费昂贵、操作过程复杂。近年来多采用振荡法结合差速贴壁法,但培养周期较长[5]。因此,获得一种简单、经济、高效的少突胶质细胞培养方法具有重要意义。
视神经是具有中枢神经特征的周围神经,不含神经元胞体和室管膜细胞[6],主要有Ⅰ、Ⅱ型星形胶质细胞和少突胶质细胞3种大胶质细胞,是研究胶质细胞在体外发育的极好材料。本实验在既往新生大鼠视神经组织块培养法体外培养少突胶质细胞基础上,经过探索,对其加以改良,方法简单,经济,可获得实验用足量纯化的少突胶质细胞。
1 材料与方法
1.1 材料 胎牛血清(foetal bovine serum,FBS)、亚硒酸钠、谷氨酰胺、甲状腺素、转铁蛋白(美国,Sigma公司);达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)/F12培养基(美国,HyClone公司);髓鞘碱性蛋白(myelin basic protein,MBP)抗体、链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)试剂盒(武汉博士德生物制剂公司)。CO2培养箱(日本,SANYO Electric CO.Ltd)、倒置相差显微镜(德国,LEICA公司)。新生2 d SD大鼠[大连医科大学实验动物中心,SCXK-(辽)-2008-0002]。培养液均以DMEM/F12培养基配制,加入100 U/mL青霉素及100μg/mL链霉素。培养用液配方[7]见表1。
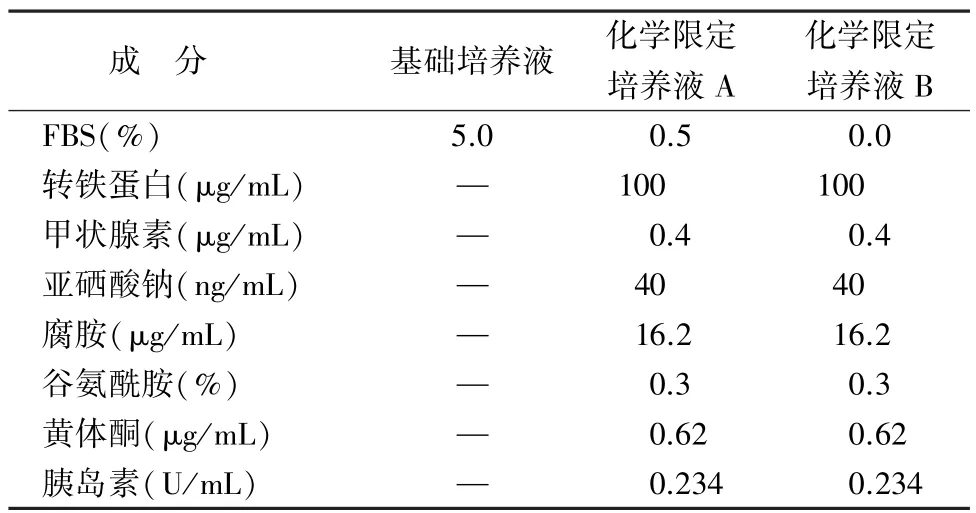
表1 培养用液配方
1.2 方法
1.2.1 视神经少突胶质细胞培养 新生2 d SD大鼠,75%乙醇浸泡2 min后,立即移进超净台,无菌条件下取双侧视神经,置于无菌培养皿中,剔除血管,预冷(4℃)的0.01 mol/L磷酸盐缓冲液冲洗3遍。常温下0.125%胰酶消化3~5 min,0.01 mol/L磷酸盐缓冲液终止消化,将组织块移入预先涂有多聚赖胺酸的培养皿中(直径3.5 cm),每皿3对神经,加入基础培养液(使组织块接触到培养液,又不悬浮于培养液,约400μL),37℃、5%CO2培养箱中培养;第4天时,更换为化学限定培养液A(约400 μL);每周更换培养液2次。约第10天时,更换为化学限定培养液B(约600μL),此时细胞生长成熟,1 d后进行免疫细胞化学染色。
1.2.2 少突胶质细胞免疫细胞化学鉴定及计数
细胞生长至11 d时,原位进行细胞免疫化学鉴定,按照SABC试剂说明进行。一抗为1∶100 MBP抗体,苏木素和伊红复染,乙醇脱水,50%无水乙醇及50%甘油混合液封闭培养皿,4℃保存。每皿计数500个细胞中MBP阳性细胞个数,计算MBP阳性细胞百分率。实验重复3次,每次设3个平行培养皿。1.3 统计学处理 应用SPSS 13.0软件,每次MBP阳性细胞百分率以均数±标准差(±s)表示,3次间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 少突胶质细胞培养形态学观察 视神经组织块24 h开始贴壁,48~72 h可见组织边缘游出少量细胞,主要为梭形。9~10 d,细胞基本全部从组织块中游离出来,平铺于皿底,组织块呈透明状,此时改用化学限定培养液B培养后部分细胞死亡。11 d左右获得的细胞胞体基本呈圆形或多角形,直径6~10μm,细胞核较大,胞质少,突起丰富(图1)。每皿计数细胞数为(6~8)×105个。
2.2 少突胶质细胞免疫化学染色 培养的细胞行MBP免疫化学染色,90%以上为MBP阳性细胞(图2),异质细胞少。
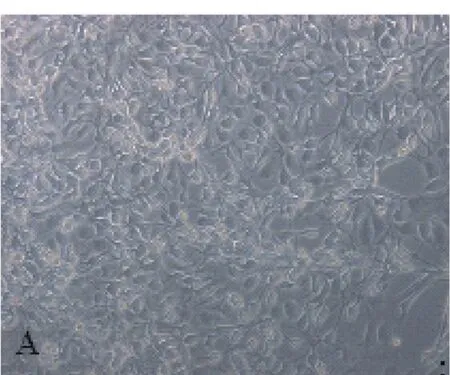
图1 培养第12天,纯化的视神经少突胶质细胞(×100)
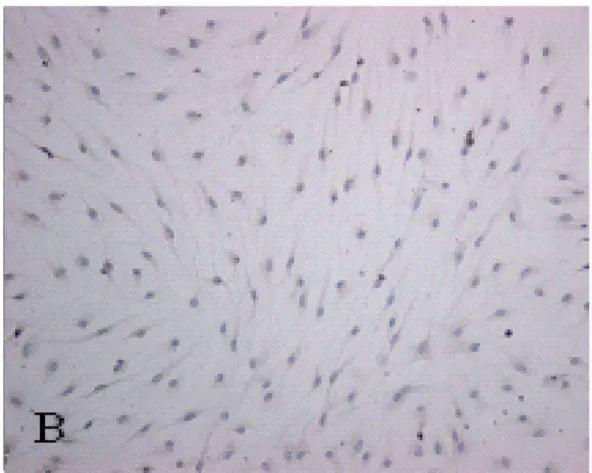
图2 培养第12天,MBP细胞免疫化学染色阳性的少突胶质细胞(×200)
2.3 培养方法的可重复性 3次培养细胞的MBP细胞免疫化学染色阳性细胞百分率分别为(95.33± 3.3)%、(94.33±2.2)%及(97.13±2.2)%,差异无统计学意义(P>0.05)。
3 讨论
视神经是由视网膜神经节细胞胞体发出的轴索和视神经胶质细胞组成,不含神经元胞体和室管膜细胞,成分单一,便于研究[6]。视神经胶质细胞主要包括星形胶质细胞和少突胶质细胞两大类,其中星形胶质细胞分为Ⅰ、Ⅱ型星形胶质细胞。星形胶质细胞和少突胶质细胞虽然均起源于神经外胚叶的神经上皮细胞,但2种细胞来自不同的分化谱系,Ⅰ型星形胶质细胞由Ⅰ型星形胶质细胞谱系分化,少突胶质细胞和Ⅱ型星形胶质细胞是由一种普通双向潜能的少突胶质细胞/Ⅱ型星形胶质细胞祖细胞(oligodendrocyte/type-2 astrocyte progenitor cells,O-2A)分化的。少突胶质细胞对中枢神经系统髓鞘形成起着决定性作用,而Ⅱ型星形胶质细胞的突起总是围绕着郎飞结,因此O-2A谱系可能对髓鞘形成有特殊的作用[1]。
体外分离培养少突胶质前体细胞,取材时间最好放在其前体细胞充分发育之后,但是要在活跃的髓鞘形成期之前,以保证其能在体外继续发育。大鼠出生后约1周,少突胶质细胞即逐渐成熟[1],因此采用新生2 d的SD大鼠视神经进行原代培养。彭锡嘉等[7]采用视神经组织块加双盖玻片法培养少突胶质细胞,将视神经剪碎使细胞容易从组织中游离,但对脆弱的视神经损伤较大,操作也不容易。由于新生大鼠视神经组织较轻,直接加入培养液后,组织块容易悬浮起来;加双盖玻片可帮助神经组织贴壁,但盖玻片在一定程度阻碍了组织块与培养液的接触,不利于细胞生长;如果选用膜性的盖玻片,成本又很高。本实验不对组织块进行剪碎,减少对其损伤,只对组织块在室温下稍做消化(3~5 min)后,直接接种于培养皿中,加入少量的培养液,使组织块既接触到培养液又不悬浮于培养液,细胞可接触培养皿底贴壁生长。
前O-2A祖细胞和O-2A祖细胞在血小板衍生生长因子(platelet derived growth factor,PDGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、神经营养因子-3(neurotrophin-3,NT-3)、胰岛素样生长因子-1(insulin like growth facto-1,IGF-1)等肽类生长因子的作用下可大量增殖,其中PDGF可以刺激少突胶质前体细胞合成DNA,bFGF、NT-3和IGF-1可促进细胞周期循环,阻止细胞分化[8]。星形胶质细胞体外培养可以分泌PDGF和bFGF[9],其条件培养液具有明显的促神经生长的作用[10]。因此,尽管血清可诱导O-2A向Ⅱ型星形胶质细胞分化,但本实验在视神经培养的早期仍使用了含有血清的培养液,但逐渐降低至仅含0.5%胎牛血清的化学限定性培养液。一方面保证一定数量的星形胶质细胞的存活,分泌细胞因子促进O-2A增殖;另一方面尽可能减少O-2A向星形胶质细胞的分化。待获得足够数量的细胞后,改为无胎牛血清化学限定性培养液继续进行培养,此时O-2A在无胎牛血清培养基中,在甲状腺素、腐胺、黄体酮及微量元素硒的作用下可向少突胶质细胞分化。由于成熟的少突胶质细胞为分裂终期细胞,不再具有分裂增殖能力,因此在无胎牛血清条件下生存不受影响;而星形胶质细胞及成纤维细胞具有分裂增殖能力,在此条件下很难存活[6]。在更换培养液第2天即可观察到部分细胞死亡,考虑为死亡的星形胶质细胞及成纤维细胞,从而实现了对培养的少突胶质细胞的纯化。
体外培养条件下的少突胶质细胞系的发育进展按抗原表达、形态和功能分为前O-2A祖细胞、O-2A祖细胞、原少突胶质细胞、未成熟少突胶质细胞和成熟少突胶质细胞5个阶段[11]。少突胶质细胞在形成髓鞘前1~2 d将表达MBP[12],这种蛋白在中枢神经系统只存在于少突胶质细胞胞体的胞浆面[13]。Mirsky等[14]观察到,体外培养的视神经在5~6 d时才有MBP阳性的少突胶质细胞出现。本实验方法所培养的细胞在第11天时,90%以上为MBP阳性细胞,提示均为成熟的少突胶质细胞,细胞数量每皿可达(6~8)×105个,足够一般细胞生物学实验使用,且方法简便、稳定,易于推广。
[1]何平,沈馨亚.少突胶质细胞增殖和分化的研究进展[J].神经解剖学杂志,2000,16(2):183-188.
[2]陈晓静,谢敏杰.新生SD大鼠少突胶质细胞前体细胞的培养与分化[J].卒中与神经疾病,2014,21(1):11-13.
[3]Emery B,Dugas JC.Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning[J].Cold Spring Harb Protoc,2013(9):854-868.
[4]NeriM,Maderna C,Ferrari D,et al.Robust generation of oligodendrocyte progenitors from human neural stem cells and engraftment in experimental demyelination models in mice[J].PLoSOne,2010,5(4):e10145.
[5]陈丽萍,郭力,李振飞,等.少突胶质祖细胞的体外分离、培养和定向分化[J].广东医学,2012,33(15):2221-2223.
[6]Skaper SD.Culture of purified glial cell populations from optic nerve[J].Methods Mol Biol,2012,846:131-145.
[7]彭锡嘉,刘少章,叶剑,等.新生大鼠视神经少突胶质细胞体外培养纯化及鉴定[J].眼科新进展,2003,23(3): 151-152.
[8]Barres BA,Raff MC,Gaese F,etal.A crucial role for neurotrophin-3 in oligodendrocyte development[J].Nature,1994,367(6461):371-375.
[9]Rousselet A,Autillo-Touati A,Araud D,et al.In vitro regulation of neuronalmorphogenesis and polarity by astrocytederived factors[J].Dev Biol,1990,137(1):33-45.
[10]薛庆善,郭畹华.大鼠大脑皮质星形胶质细胞的体外培养及其促神经突起生长作用研究[J].神经解剖学杂志,1996,12(2):151-155.
[11]Armstrong RC.Isolation and characterization of immature oligodendrocyte lineage cells[J].Methods,1998,16(3): 282-292.
[12]Kornguth SE,Anderson JW,Scott G.Temporal relationship betweenmyelinogenesis and the appearance of a basic protein in the spinal cord of thewhite rat[J].JComp Neurol,1966,127(1):1-18.
[13]Barbarese E,Barry C,Chou CH,et al.Expression and localization ofmyelin basic protein in oligodendrocytes and transfected fibroblasts[J].JNeurochem,1988,51(6):1737-1745.
[14]Mirsky R,Winter J,Abney ER,et al.Myelin-specific proteins and glycolipids in rat Schwann cells and oligodendrocytes in culture[J].JCell Biol,1980,84(3):483-494.
Modified method for ratoptic nerve oligodendrocytes in vitro culture
WANG Xiaohong1,WANG Suping1,CHE Juhua2,WANG Hong3,WANG Tao4,ZHU Yanling5
(1.Department of Neurology,Dalian Municipal Central Hospital Affiliated to Dalian Medical University,Dalian Liaoning 116033,China;2.Dalian Medical University,Dalian Liaoning 116044 China;3.Department of Neurosurgery,Dalian Municipal Central Hospital Affiliated to Dalian Medical University,Dalian Liaoning 116033,China;4.Department of Rehabilitation Medicine,Dalian Municipal Central Hospital Affiliated to Dalian Medical University,Dalian Liaoning 116033,China;5.Department of Neurology,the Third People′s Hospital of Dalian,Dalian Liaoning 116033,China)
ObjectiveTo improve the pastmethod for in vitro culture of neonatal rat optic nerve oligodendrocytes.MethodsSix optic nerves of newborn rats were placed in poly-lysine precoated dish(diameter 3.5 cm),cultured with 400μL basic culturemedium for 3 days,and then replaced by 400μL chemically defined culturemedium containing 3%foetal bovine serum(FBS). For about the 10th days,culturemedium was replaced by 600μL chemically defined culturemedium without FBS.At the 11st days,immunocytochemistry with myelin basic protein(MBP)was used to identify oligodendrocyte,and the percentage of positive cellswas calculated.Oligodendrocyte in vitro culture with themethod was repeated three times,analysis of variance was used to evaluate the stability of the improved method.ResultsFor the 11st cultured days,number of cells in per dish was up to(6—8)×105,more than 90%cellswere positive with MBP immunocytochemistry.There was no statistical difference among the percentage ofMBP immunocytochemistry positive cells of the three times(P>0.05)of culture.ConclusionHigher purified and enough for cell biology experiments mature oligodendrocytes can be obtained with the improvedmethod for in vitro culture of neonatal rat optic nerve oligodendrocytes.This improved method is relatively easy and stable,compared with the othermethods for oligodendrocytes culture.
Optic nerve;Oligodendrocyte;Cell culture
R322.85-332
A
2095-3097(2014)06-0330-04
10.3969/j.issn.2095-3097.2014.06.003
2014-09-25 本文编辑:徐海琴)
116033辽宁大连,大连医科大学附属大连市中心医院神经内科(王晓虹,王苏平),综合神经外科(王 虹),康复医学科(汪涛);116044辽宁大连,大连医科大学(车菊华);116033辽宁大连,大连市第三人民医院神经内科(朱艳玲)
王苏平,E-mail:wangsuping@medmail.com.cn
