人脐带间充质干细胞的高效分离及对小鼠免疫功能的影响
2014-02-16秦力维张宁坤郭建巍彭秀军王桂琴曹利群田春雨
秦力维,张宁坤,郭建巍,彭秀军,王桂琴,曹利群,田春雨,崔 蓓,王 静,高 原
·生物样本库·
人脐带间充质干细胞的高效分离及对小鼠免疫功能的影响
秦力维,张宁坤,郭建巍,彭秀军,王桂琴,曹利群,田春雨,崔 蓓,王 静,高 原
目的建立一种从健康人脐带中分离间充质干细胞(mesenchymal stem cells,MSCs)的简单、经济、高效方法,并探讨其对小鼠免疫细胞的影响。方法取经剖宫产获得的健康人脐带血管与外膜之间的胶状物并剪切成小于1mm3的小块,用组织块贴壁法直接培养MSCs,并用获得的MSCs注射于健康C57 BL/6小鼠皮下。结果获得的MSCs高表达CD105、CD73、CD44和CD90,不表达CD34、CD45和人类白细胞抗原-DR,符合干细胞的各种生物学特性。结论用简便、经济的方法获得了健康人脐带间充质干细胞,注射C57 BL/6小鼠体内后,小鼠的血细胞及T细胞亚型未改变,自身免疫系统稳定,为进一步的研究奠定了实验基础。
脐带;间充质干细胞;直接贴壁法;异种注射
[注 明]秦力维,张宁坤:并列第一作者DMEM)培养基(美国,HyClone公司)、青霉素和链霉素(美国,HyClone公司)、胎牛血清(美国,Gibco公司);生物安全柜(美国,Thermo公司);CO2培养箱(美国,Thermo公司);倒置相差显微镜(日本,Olympus公司);普通离心机(杭州奥盛仪器有限公司);恒温水浴箱(上海森信实验仪器有限公司);一次性无菌培养瓶、离心管、移液管、过滤器(美国,Gibco公司)。
FACSCaliburTM流式细胞仪(美国,Becton Dickinson公司),功率15 W,激光光源采用氩离子气体激光器,波长488 nm,进行藻红蛋白(phycoerythrin,PE)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、甲藻叶绿素蛋白(peridinin chlorophyll protein,PerCP)等检测;另配小功率半导体激光器,波长为635 nm,别藻蓝蛋白(allophycocyanin,APC)检测。全自动血球分析仪(日本,Sysmex公司)。18~20 g雌性C57 BL/6 30只wide type(WT)小鼠购自海军总医院实验动物中心[SCXK-(京)-2011-0006]。1.2 试剂配制 DMEM完全培养基:90 mL DMEM培养基+20 mL特级胎牛血清(100 U/mL青霉素、100μg/mL链霉素)。
1.3 方法
1.3.1 脐带间充质干细胞分离 无菌取剖宫产新鲜脐带,以磷酸盐缓冲液(phosphate buffer saline,PBS)洗去脐带残留血液,剪成3~4 cm的小段,每一段沿静脉腔剪开,平铺后剔除脐带动、静脉;取血管之间血管与外膜之间的胶状物,并剪切成小于1 mm3小块,以PBS冲洗后,把组织块放置含15%胎牛血清的DMEM培养基,在37℃5%CO2培养箱中培养。
1.3.2 脐带间充质干细胞培养 倒置相差显微镜下观察组织块,24 h后半量换液,待组织块周围均有细胞出现时,移出组织块;当细胞扩增占80%~90%细胞瓶底面积时,用0.05%胰蛋白酶-乙二胺四乙酸液消化后传代,用0.01 mol/L PBS调整细胞为5×105/mL,0.01 mol/L PBS洗涤2次后,加入PBS 1 mL重悬细胞,取1×106个细胞待用。用第3代细胞进行实验。
1.3.3 脐带间充质干细胞鉴定 取1×106个细胞,加100μL的细胞染色缓冲液,根据抗体说明书加入相应体积的抗体[小鼠抗人PE、APC或FITC标志的单抗CD105、CD73、CD44、CD90、CD34、CD45和人类白细胞抗原(human leucocyte antigen,HLA)-DR],室温孵育30 min,1 000 r/min离心5 min,弃上清,加入500μL PBS上机检测。
1.3.4 分组 用无菌PBS调整脐带间充质干细胞至1×106/mL,随机数字法将30只雌性小鼠分为实验组及对照组,每组15只。实验组于每只小鼠腹股沟皮下多点注射MSCs细胞液,每只注射0.5 mL,连续注射3 d;对照组腹股沟皮下多点注射PBS 0.5mL。7 d后尾静脉取血检测小鼠血常规,处死后流式细胞仪检测外周血细胞、脾细胞T细胞亚群变化。
1.4 统计学处理 应用SPSS 17.0软件,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 培养结果 培养至第7天时,倒置相差显微镜下观察到脐带组织块周围有成纤维样细胞爬出,移出组织块后,可见大量贴壁细胞。细胞形态不规则,边缘较钝,细胞间杂质较多。培养第10天,细胞转变为长梭形,细胞间杂质消失,细胞边缘光滑,呈成纤维细胞样形态。传代至第3代时,细胞内外不见明显颗粒,细胞表面光滑、状态良好(图1),用于后续实验。

图1 倒置相差显微镜下的脐带间充质干细胞(×200)
2.2 脐带间充质干细胞免疫表型的鉴定 经流式细胞仪检测,分离培养的脐带间充质干细胞表达骨髓间质干细胞的表面标志CD105(90.0%)和CD44 (99%)、CD73(85.1%)和CD90(99.5%),很少表达造血干细胞的表面标志CD34(0.32%)、CD45(0.27%)和HLA-DR(1.03%)。见图2~6。
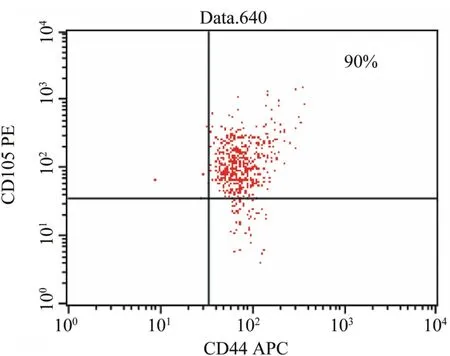
图2 CD105和CD44分子在脐带间充质干细胞表面的表达
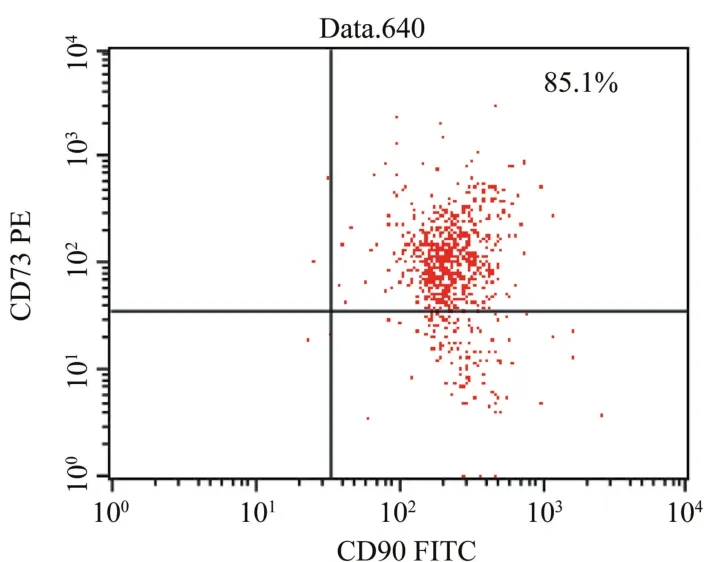
图3 CD73和CD90分子在脐带间充质干细胞表面的表达
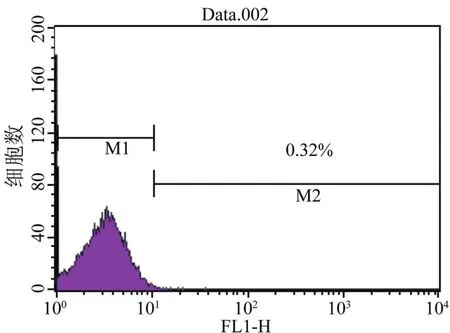
图4 CD34分子在脐带间充质干细胞表面的表达
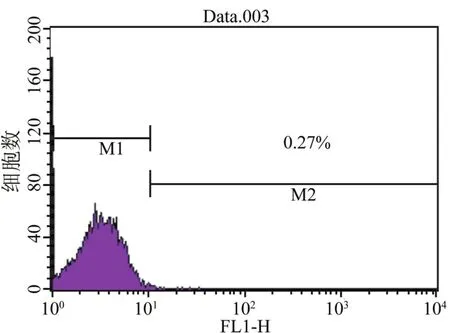
图5 CD45分子在脐带间充质干细胞表面的表达
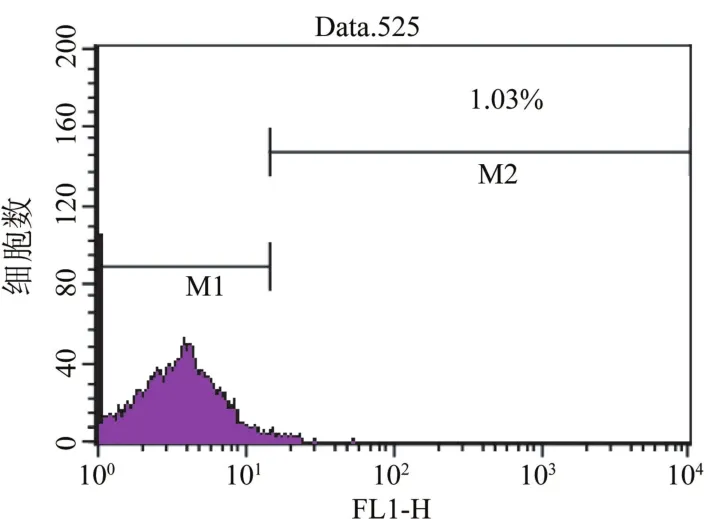
图6 HLA-DR分子在脐带间充质干细胞表面的表达
2.3 小鼠外周血细胞、脾细胞T细胞亚群的变化
小鼠腹股沟皮下多点注射脐带间充质干细胞7 d后,尾静脉取血进行血常规检测;结果显示,与对照组相比,小鼠白细胞计数、红细胞计数、血小板计数和血红蛋白水平差异均无统计学意义(P>0.05,表1);实验组与对照组相比,脾脏CD3+CD4+细胞、CD3+CD8+细胞数量、CD3+CD4+/CD3+CD8+比值差异均无统计学意义(P>0.05,表2)。
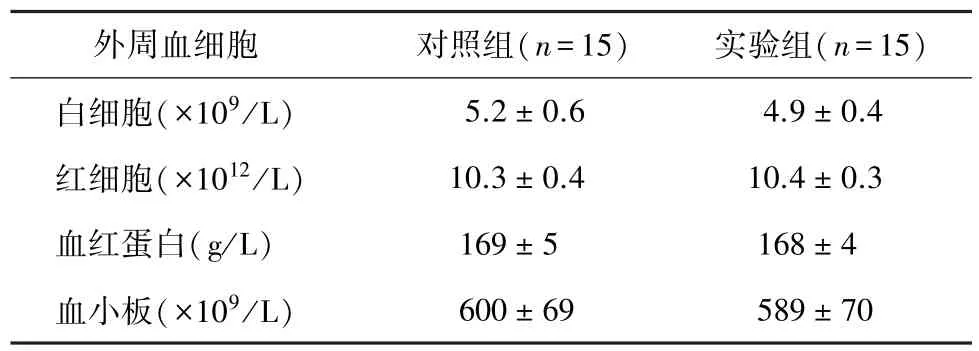
表1 注射脐带间充质干细胞后小鼠外周血细胞的变化
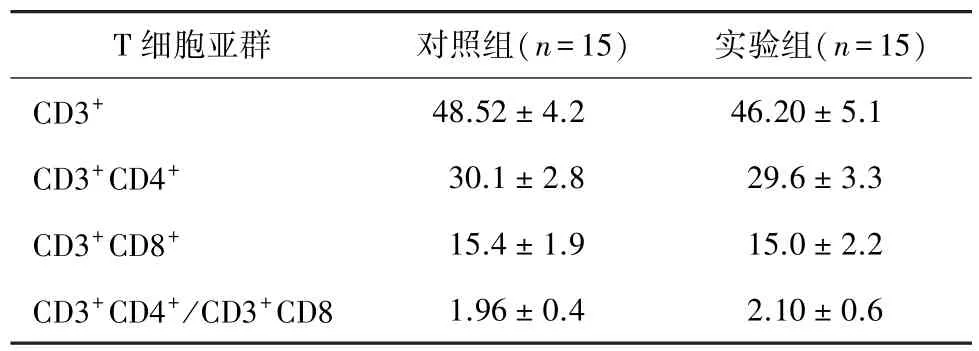
表2 注射脐带间充质干细胞后小鼠脾细胞T细胞亚群的变化
3 讨论
间充质干细胞来源于中胚层的间充质,分布广泛,形态与成纤维细胞相似,是一类具有自我更新、增殖和多向分化潜能的成体干细胞,已在组织工程领域展现出良好的应用前景。脐带间充质干细胞在特性上类似于骨髓间充质干细胞,但在增殖及分化潜能方面优于骨髓间充质干细胞,并且易于获得、取材方便,排除了伦理道德方面限制,容易工业化制备,是组织工程和再生医学理想的种子细胞[1]。
脐带间充质干细胞培养一般采用酶消化法、组织块贴壁法和两者联合的方法[2-3]。我们在长期研究中发现,用酶消化法分离脐带干细胞时使用大量的Ⅱ型胶原酶,这种方法耗时长达20 h。由于Ⅱ型胶原酶的大量使用,使组织消化过程不易控制,常导致细胞活性降低,表面受体降解甚至功能改变。实验中使用的胶原酶均为进口产品,价格不菲,使实验成本增加。
本研究中,将要培养的脐带组织块剪切成小于1 mm3大小的小块,经PBS充分洗涤后,使用组织块直接贴壁培养,在处理及培养过程中不使用0.2%Ⅱ型胶原酶,同时在培养液中加大胎牛血清至15%,加速了组织块的贴壁。这种方法使组织块中的干细胞能在48 h左右爬出并贴壁,增加了细胞生长的速度。换液过程中充分利用干细胞生长过程中分泌的各种细胞及组织生长因子,进行半量换液,始终使细胞处于有细胞和组织生长因子的状态,使细胞生长状态良好,增殖加快。实验结果证实本方法培养的脐带间充质干细胞镜下呈长梭形或多角形,平行生长或漩涡状生长,高表达CD105、CD73、CD44和CD99,不表达CD34、CD45和HLA-DR,符合干细胞的各种生物学特性[4]。
近年来,脐带间充质干细胞在组织损伤的治疗中得到了很多应用。有学者将人脐带间充质干细胞移植给视网膜疾病的啮齿目动物,可挽救其光感受器,效果优于骨髓间充质干细胞或胎盘干细胞移植[5];可显著降低心搏骤停复苏所致的脑缺血大鼠神经元的丧失[6];可改善脱水诱导的帕金森病大鼠动作的缺陷[7]。由于免疫原性低,同种异体移植无免疫排斥反应或反应较弱,已有异种移植对自身免疫性疾病的防治[8]及治疗糖尿病[9]、肝损伤[10]方面的研究报道。
在眼科疾病的研究中,MSCs有利于视网膜色素变性和视网膜光损伤的治疗[11-12];它具有神经保护作用,可减轻或延缓视网膜组织损伤,在视网膜缺血再灌注损伤和青光眼的治疗中具有广阔的应用前景[13-14];MSCs还具有免疫调节作用,它可抑制脉络膜新生血管生长并促进其消退[12]。在后续研究中,我们将用获得的人脐带间充质干细胞治疗实验动物的各种眼科疾病的研究。
相对于实验动物来说,人MSCs是异种来源的细胞,对于来源于不同人体、不同培养方式得到的人脐带间充质干细胞,重复多次输注,受体动物是否安全、是否产生免疫原性?带着这个问题,本研究将获得的人脐带间充质干细胞注入健康小鼠,7 d后对其血细胞及脾细胞T细胞亚群进行了分析测定,结果显示注入脐带间充质干细胞后小鼠的血细胞及免疫细胞表型均没有明显的改变,进一步证实了有关研究的结果[15],可以用于后续的实验研究。
[1]Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bonemarrow[J].Stem Cells,2007,25(6):1384-1392.
[2]Troyer DL,Weiss ML.Wharton′s jelly-derived cells are a primitive stromal cell population[J].Stem Cells,2008,26 (3):591-599.
[3]Kestendjieva S,Kyurkchiev D,Tsvetkova G,et al.Characterization ofmesenchymal stem cells isolated from the human umbilical cord[J].Cell Biol Int,2008,32(7):724-732.
[4]DominiciM,Le Blanc K,Mueller I,et al.Minimal criteria for definingmultipotentmesenchymal stromal cells.The International Society for Cellular Therapy position statement [J].Cytotherapy,2006,8(4):315-317.
[5]Lund RD,Wang S,Lu B,et al.Cells isolated from umbilical cord tissue rescue photoreceptors and visual functions in a rodentmodel of retinal disease[J].Stem Cells,2007,25(3):602-611.
[6]Jomura S,Uy M,Mitchell K,et al.Potential treatment of cerebral global ischemia with Oct-4+umbilical cordmatrix cells[J].Stem Cells,2007,25(1):98-106.
[7]Weiss ML,Medicetty S,Bledsoe AR,et al.Human umbilical cordmatrix stem cells:preliminary characterization and effect of transplantation in a rodentmodel of Parkinson′s disease[J].Stem Cells,2006,24(3):781-792.
[8]Hao H,Chen G,Liu J,et al.Culturing on Wharton′s jelly extract delaysmesenchymal stem cell senescence through p53 and p16INK4a/pRb pathways[J].PLoSOne,2013,8 (3):e58314.
[9]Fu YS,Cheng YC,Lin MY,etal.Conversion of human umbilical cord mesenchymal stem cells in Wharton′s jelly to dopaminergic neurons in vitro:potential therapeutic application for Parkinsonism[J].Stem Cells,2006,24(1): 115-124.
[10]Yu J,Cao H,Yang J,etal.In vivo hepatic differentiation of mesenchymal stem cells from human umbilical cord blood after transplantation into mice with liver injury[J].Biochem Biophys Res Commun,2012,422(4):539-545.
[11]Wang S,Lu B,Girman S,et al.Non-invasive stem cell therapy in a ratmodel for retinal degeneration and vascular pathology[J].PLoSOne,2010,5(2):e9200.
[12]Hou HY,Liang HL,Wang YS,et al.A therapeutic strategy for choroidal neovascularization based on recruitment of mesenchymal stem cells to the sites of lesions[J].Mol Ther,2010,18(10):1837-1845.
[13]LiN,Li XR,Yuan JQ.Effects of bone-marrow mesenchymal stem cells transplanted into vitreous cavity of rat injured by ischemia/reperfusion[J].Graefes Arch Clin Exp Ophthalmol,2009,247(4):503-514.
[14]Johnson TV,Bull ND,Hunt DP,et al.Neuroprotective effects of intravitreal mesenchymal stem cell transplantation in experimental glaucoma[J].Invest Ophthalmol Vis Sci,2010,51(4):2051-2059.
[15]何君,李洋,陈威,等.人脐带间充质干细胞静脉输注小鼠的安全性[J].中国比较医学杂志,2013,23(9):36-41.
Effective isolation of human umbilical cord mesenchymal stemcells and immunity changes after injection in mice
QIN Liwei1,ZHANG Ningkun2,GUO Jianwei3,PENG Xiujun1,WANG Guiqin1,CAO Liqun1,TIAN Chunyu1,CUIBei1,WANG Jing1,GAO Yuan1
(1.Department of Ophthalmology,Navy General Hospital,Beijing 100048,China;2.Heart Center,Navy General Hospital,Beijing 100048,China;3.Department of Laboratory,Navy General Hospital,Beijing 100048,China)
ObjectiveTo explore an effective,convenient and economicalmethod for extraction and cultivation human umbilical cord mesenchymal stem cells(MSCs)and discussion changes of peripheral blood cells and T lymphocyte subgroups in C57 BL/6 mice after MSCs infection.MethodsUnder sterile conditions,umbilical artery and vein were excluded from cesarean section fetal umbilical cord,cut umbilical cord into shiver smaller than 1 mm3and cultured in vitro until getting adherent cells.5×106MSCs were injected subcutaneously in C57 BL/6 mice for 3 days.ResultsMSCs were effectively isolated from human umbilical cord with high expression CD105,CD73,CD44 and CD90moleculars,but less expression for CD34,CD45 and human leucocyte antigen-DR moleculars.ConclusionAn effective,convenient and economical method to isolate and culture MSCs in vitro was successfully established.No changeswere detected in peripheral blood cells and T lymphocyte subgroups of C57 BL/6 mice after MSCs infection.
Umbilical cord;Mesenchymal stem cells(MSCs);Direct adherent cells;Xerogeneic injection
R329
A
2095-3097(2014)06-0333-04
10.3969/j.issn.2095-3097.2014.06.004
1 材料与方法
海军总医院创新培育基金资助(CXPY201312)
100048北京,海军总医院眼科(秦力维,彭秀军,王桂琴,曹利群,田春雨,崔 蓓,王 静,高 原),心脏中心(张宁坤),检验科(郭建巍)
高 原,E-mail:gaoyuan999@sina.con
2014-05-27 本文编辑:冯 博)
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新及多向分化潜能的干细胞,广泛存在于成体及胎儿的各种组织中,在组织再生和修复中具有重要作用。由于来源于成体组织MSCs数量有限,限制了其临床应用。近年来的研究发现,来源于脐带的MSCs具有更强的增殖效力和自我更新能力,是再生医学理想种子细胞[1]。本研究拟建立一种从健康人胎盘脐带中分离MSCs的简单、经济、高效方法,并探讨其对小鼠免疫细胞的影响,为MSCs的广泛使用奠定实验基础。
1.1 材料与仪器 新生儿脐带取自海军总医院妇产科(37~40周胎龄剖宫产健康胎儿)。达尔伯克改良伊格尔(Dulbecco′smodification of Eagle′smedium,
