广西罗非鱼和卵形鲳鲹海豚链球菌的生化特性及基因多态性分析
2014-02-15黄婷李莉萍王瑞梁万文罗洪林陈福艳张彬杨传萍罗永巨陈明甘西
黄婷,李莉萍,王瑞,梁万文,罗洪林,陈福艳,张彬,杨传萍,罗永巨,陈明,甘西
(1.广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁530021;2.安徽省当涂县水产局,安徽 当涂243100)
研究海豚链球菌的血清型有助于有针对性地制定海豚链球菌病的防控措施。海豚链球菌不能采用传统的Lancefield 链球菌血清型分型方法对其进行血清型鉴定[1],因此,至今尚未建立其血清型鉴定系统。以色列、美国、日本和中国分别采用血清凝集试验和/或RAPD 方法,研究报道了各地海豚链球菌流行菌株所具有的不同血清型[2-5],然而,因无标准血清,加之所采用的分型方法不同,对目前海豚链球菌究竟有几种血清型尚不清楚。随机扩增多态性DNA 标记(RAPD)技术因其具有快速可靠、灵敏度高、检测容易、样品用量少等优点,近年来被广泛应用于细菌、真菌、支原体等微生物的血清型分型研究中。Bachrach等[2]采用RAPD 技术证实,不同血清型(Ⅰ和Ⅱ型)的海豚链球菌具有两种不同的RAPD 带型(基因多态性)。
目前国内关于海豚链球菌血清型的研究仅见两例报道。周素明[5]采用微量凝集方法,以国外标准株为对照,对广东省所分离的26 株海豚链球菌及浙江省所分离的1 株分离菌株进行了血清型鉴定,结果表明,海豚链球菌分为2种血清型;程爽[6]采用RAPD 技术对山东省分离到的1 株海豚链球菌SF1 进行基因多态性分析,确认其与血清型Ⅰ型海豚链球菌的基因多态性一致。国内对海豚链球菌血清型的研究局限于广东省、山东省和浙江省的临床菌株,尚未对其他地区海豚链球菌临床菌株的血清型进行深入研究。本研究中,采用RAPD 技术对2006—2011年从广西分离到的22 株海豚链球菌进行基因多态性分析,以期阐明广西海豚链球菌的基因多态性特征,为针对性地筛选中国罗非鱼海豚链球菌病疫苗候选菌株及疫苗研制提供参考。
1 材料与方法
1.1 材料
细菌基因组DNA 提取试剂盒购自北京天根生化科技有限公司,细菌API 20 生化鉴定试剂条购自法国梅里埃试剂有限公司,Taq DNA 聚合酶购自宝生物工程(大连)有限公司,PCR所用引物由生工生物工程(上海)股份有限公司合成。
本试验中所用菌株均为广西水产遗传育种与健康养殖重点实验室2006—2011年从广西养殖的罗非鱼Oreochromis Niloticus和卵形鲳鲹Trachinotus ovatus 中分离的海豚链球菌流行菌株,各菌株详细信息如表1所示。

表1 试验菌株信息Tab.1 Information on the experimental bacterial strains
1.2 方法
1.2.1 二重PCR 鉴定 将细菌置于含TSB 液体的培养基中,28 ℃下振荡培养24 ~48 h 后,按细菌DNA 抽提试剂盒说明书操作,抽提23 株细菌的基因组DNA,分装后于-20 ℃下保存备用。二重PCR 扩增参照黎炯等[7]的方法进行,无乳链球菌引物为
P-F:5' AAGCGTGTATTCCAGATTTCCT 3',
P-R:5' CAGTAATCAAGCCCAGCAA 3'。
海豚链球菌引物为
P-F:5' CTAGAGTACACATGTACTTAAG 3',
P-R:5' GGATTTTCCACTCCCATTAC 3'。
无乳链球菌特异性扩增片段大小为474 bp,海豚链球菌特异性扩增片段大小为296 bp。
1.2.2 海豚链球菌的生化鉴定 生化鉴定步骤参照API STREP 20 试剂条使用说明书进行。
1.2.3 随机扩增多态性DNA 标记(RAPD)分析
以23 株细菌的基因组DNA 为模板,以5' GATCAAGTCC 3'[2]为引物,进行RAPD PCR。PCR 体系(共50 μL):10 ×Buffer(Mg2+)5.0 μL,dNTP 4.0 μL,引物1.0 μL,DNA 模板0.5 μL,Takara Ex Taq(5 U/μL)0.5 μL,ddH2O 39.0 μL。PCR仪器为德国Biometra 公司的T GraDient。PCR 反应程序:95 ℃下预变性5 min;95 ℃下变性30 s,38℃下退火1 min,72 ℃下延伸1 min,共进行30 个循环;最后在72 ℃下再延伸10 min。用15 g/L 琼脂糖凝胶进行电泳,用GoldView Ⅰ型核酸染色剂进行染色,用凝胶成像系统拍照。
2 结果
2.1 二重PCR 扩增
23 株海豚链球菌二重PCR 检测结果见图1。阳性对照出现2 条特异性条带,23 株海豚链球菌均在预期296 bp 处出现了目的条带。
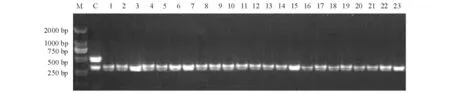
图1 23 株菌株的二重PCR 扩增图Fig.1 Duplex PCR analysis of the 23 bacterial strains
2.2 生化鉴定分型
23 株细菌的生理生化试验详细结果见表2。由表2可知,GX003、GX005、GX023和GX025 的精氨酸水解(ADH)呈阴性反应,其余均为阳性。
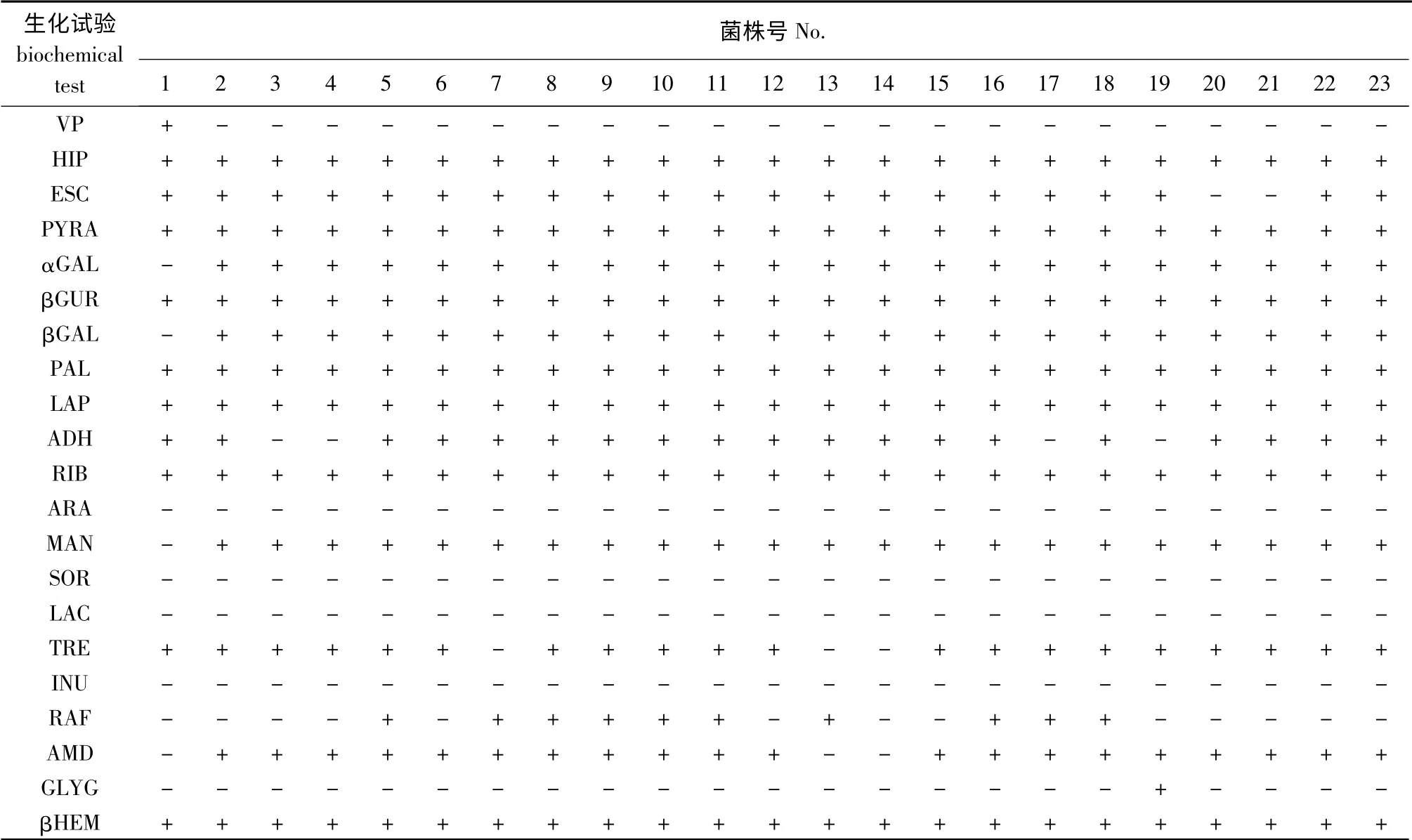
表2 23 株试验菌株的生化反应结果Tab.2 Biochemical characterization of the 23 bacterial strains
2.3 随机扩增多态性DNA 标记
随机扩增多态性DNA 标记结果见图2。1 号菌株为海豚链球菌标准菌株ATCC 29178,其在750 bp 处出现了特异性条带。本实验室分离到的另外22 株菌株也均在750 bp 处出现了特异性条带,且均出现3 条明显的条带。推测本实验室分离保存的23 株菌与海豚链球菌标准菌株ATCC 29178 属于同一个血清型,均为血清型Ⅰ型海豚链球菌。
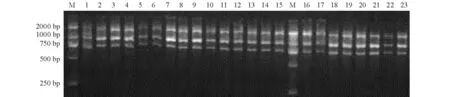
图2 RAPD 分析菌株电泳图Fig.2 RAPD analysis of the 23 bacterial strains
3 讨论
近年来,中国罗非鱼养殖深受链球菌病的危害,严重影响了罗非鱼养殖业的持续发展。2009年前还可用抗生素控制病情,而近几年抗生素的效果越来越不明显。防治该病的有效途径是使用疫苗,但相关文献报道疫苗在使用时免疫效果差异较大,曾经免疫效果很好的疫苗,后来却失去免疫保护作用[2,8]。笔者在几年的生产实践中发现,有些养殖场使用疫苗后几乎不发病,而有些则是推迟发病,推测这可能与各时期、各区域病原血清型差异有关。Bachrach等[2]对海豚链球菌血清型与基因多态性进行了比较研究,发现以色列1997—2000年分离到的海豚链球菌较之前分离菌株具有不同的基因多态性,并且2种基因多态性对应2种血清型,即基因多态性中出现750 bp 条带的菌株对应血清型Ⅰ型海豚链球菌,未出现750 bp 条带的菌株对应血清型Ⅱ型海豚链球菌。国内对海豚链球菌的研究起步较晚,柴家前等[9]最早(2002年)报道了中国罗非鱼海豚链球菌病;周素明[5]于2010年首次报道了广东省分离的海豚链球菌有2种不同的血清型,研究发现,标准菌株ATCC29178、浙江分离株SO-2、淡水菌株(广东)与海水菌株(广东)属于同一类的血清型;本研究结果表明:广西地区从2006—2011年,海豚链球菌的基因多态性未发生变化,标准菌株ATCC 29178、淡水菌株(广西)与海水菌株(广西)的基因多态性相同,根据Bachrach等[2]的研究结果,可推测广西所分离的菌株均为血清型Ⅰ型海豚链球菌;程爽[6]也研究发现,海水菌株SF1 属于血清型Ⅰ型海豚链球菌。国内外的研究结果表明,海豚链球菌目前至少存在2种不同血清型,这些结果为今后疫苗的研发及疫苗在国内的应用提供了理论依据。
Barnes等[3]研究发现,精氨酸水解酶为阳性的海豚链球菌,其RAPD 分型能扩增出750 bp 的特异条带;而精氨酸水解酶为阴性的海豚链球菌,其RAPD 分型则在750 bp 无特异性条带。本试验研究结果与Barnes等[3]的研究结果不同,RAPD 反应在750 bp 处均出现了特异性条带,但是GX003、GX005、GX023和GX025 的精氨酸水解酶呈阴性反应。本试验结果与周素明[5]的研究结果也存在差异,周素明所分离的2 个血清类群的所有菌株的精氨酸水解酶反应均呈阳性。出现这种现象的原因,可能归因于生理生化鉴定结果的不准确性或试验人员个体主观判断误差;也可能是笔者收集的菌株不够多,具体原因有待进一步研究。
[1]Pier Q B,Madin S H.Streptococcus iniae,a beta-hemolytic Streptococcus isolated from an Amazon freshwater dolphin,Inia geoffrensis[J].Int J Syst Bacterio,1976,26:545 -553.
[2]Bachrach G,Zlotkin A,Hurvitz A,et al.Recovery of Streptococcus iniae from diseased fish previously vaccinated with a Streptococcus vaccine[J].Appl Environ Microbiol,2001,67:3756 -3758.
[3]Barnes A C,Young E M,Home M,et al.Streptococcus iniae:serological differences,presence of capsule and resistance to immune serum killing[J].Dis Aquat Organ,2003,53(3):241 -247.
[4]Kinya K,Masakazu N,Tatsuo K,et al.Serological characterization of Streptococcus iniae strains isolated from cultured fish in Japan[J].Fish Patho,2006,41:57 -66.
[5]周素明.鱼类海豚链球菌流行病学及诊断技术的研究[D].广州:中山大学,2010.
[6]程爽.一株海豚链球菌的分离鉴定及其亚单位疫苗研究[D].青岛:中国科学院研究生院(海洋研究所),2010.
[7]黎炯,叶星,卢迈新,等.双重PCR 快速鉴别无乳链球菌和海豚链球菌[J].湖南农业大学学报:自然科学版,2010,36(4):449 -452.
[8]Eldar A,Horovitcz A,Bercovier H.Development and efficacy of a vaccine against Streptococcus iniae infection in farmed rainbow trout[J].Vet Immunol Immunopathol,1997,56(1/2):175 -183.
[9]柴家前,丁巧玲,王振龙,等.罗非鱼链球菌的分离鉴定[J].中国预防兽医学报,2002,24(1):l8 -20.
