中间球海胆、光棘球海胆自繁和杂交后代幼体发育及对高温的反应
2014-02-15田晓飞常亚青张伟杰经晨晨亓守冰
田晓飞,常亚青,张伟杰,经晨晨,亓守冰
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁大连116023)
中间球海胆Strongylocentrotus intermedius 原产于日本北海道和俄罗斯远东海域,最大壳径为90 mm,生长适温为16 ~19 ℃。由于其性腺色泽好、味道鲜美、营养价值高,深受广大消费者的喜爱。1989年,中间球海胆由日本引入中国,并开展了人工选育研究,经过多年的增养殖,目前已为中国经济海胆中最重要的水产养殖品种之一[1]。温度是影响海胆生长、发育和性腺品质的重要因素之一[2-4]。中间球海胆在原产地的生长温度低于20℃,当水温超过25 ℃时即可导致其大面积死亡[1]。在中国中间球海胆主要分布于山东、辽宁的部分海区,而中国大部分海域的夏季水温高于25 ℃,过高的水温会引发海胆幼体活力下降、变态困难、生长缓慢、畸形率高等一系列问题[5],导致其成活率下降,不利于苗种的培育。
种间杂交技术已经广泛应用于水产动物抗逆品种的培育。Cruz等[6]对两种鲍鱼进行了杂交(Haliotis rufescens ×H.discus hannai),研究了其杂种后代对高温的耐受性,结果表明,其杂交后代HSP70 基因的表达量高于亲本,这就为鲍鱼向低纬度地区引种以扩大养殖范围提供了可能性。王祖熊等[7]用草鱼Ctenopharyngodon idellus、鲤Cyprinus carpio、鲢Hypophthalmictuthys molitrix和鲮Cirrhinus molitorella 的混合精液与鲮的卵进行了混合受精培育,得到的后代具有较强的抗寒能力。刘国安等[8]和李传武[9]分别对兴国红鲤C.c.haematopterus(♀)×草鱼C.idellus(♂)进行杂交,研究了其杂交后代对草鱼出血病的抗性,结果表明,杂种后代在注射草鱼出血病活浆组织后其死亡率显著低于同规格的草鱼。关于海胆远缘杂交的研究较多,但多数研究都集中在种间杂交的可行性、杂交后代的发育特征和杂种优势方面。Osanai[10]和Hata等[11]分别对中间球海胆和光棘球海胆S.nudus 进行了杂交试验,均认为杂交海胆幼体的遗传表现介于父母本之间或偏向于母本。Rahman等[12-13]对两种海胆进行杂交(Echinometra sp.A × E.sp.C),结果表明,杂交子代具有很好的遗传亲合力,并且杂交海胆的性状表现出明显超过亲本的优势。常亚青等[14]对中国北方地区的4种经济海胆进行了杂交试验,分析了几种杂交组合的可行性。Ding等[15]对中间球海胆(Si)、光棘球海胆(Sn)和紫海胆Anthocidaris crassispina(Ac)进行了杂交试验,其中杂交组合Si♀×Ac♂的后代表现出明显的杂种优势。王丽梅等[16]对中间球海胆和光棘球海胆进行了杂交试验,探讨了杂交海胆的发育规律和生长特性。王笑月等[17]研究发现,盐度能显著影响海胆杂交子代Si♀×Sn♂的受精率、孵化率和幼体的生长发育。但种间杂交能否用于提高海胆的抗逆、抗病能力,目前尚未见报道。
光棘球海胆自然分布于辽宁和山东等地,生长的适宜温度在15 ~24 ℃[5]。相比于中间球海胆,光棘球海胆具有一定的耐高温能力。本研究中,通过研究高温对中间球海胆、光棘球海胆自繁及其杂交后代幼体发育的影响,探讨了杂交后代幼体耐热的可能性,以期为中间球海胆抗逆品种的培育提供科学依据。
1 材料与方法
1.1 材料
光棘球海胆亲胆于2013年7月采捕于大连市小平岛附近海域,壳径为75.15 ~79.19 mm,体质量为150.18 ~171.09 g。中间球海胆亲胆于2013年9月购自旅顺龙王塘养殖场,壳径为34.3 ~49.21 mm,体质量为43.62 ~49.04 g。
1.2 方法
1.2.1 亲胆的暂养与催产 将采回的光棘球海胆亲胆放于水泥池(5 m×2 m×2 m)中暂养,水深为0.5 m。将采回的中间球海胆亲胆放于水槽(1.8 m×1.0 m×0.8 m)中暂养。暂养期间,每3 d 换水1/2,强充气,投喂足量的海带,并适当投喂煮熟的紫贻贝肉促熟。
通过注射0.5 moL/L 的KCl 溶液(剂量为1 ~2 mL/个)进行人工催产,分别收集每个亲胆的精液或卵液,按照Si♀×Si♂、Sn♀×Si♂、Si♀×Sn♂、Sn♀×Sn♂交配方案受精。受精完成后,将各组的受精卵置于独立的70 L 孵化槽内,并在2 ~4 h 内洗卵2次,然后进行孵化[1]。
1.2.2 幼体的培养及发育观察 孵化阶段水温为18.0 ~19.0 ℃,光照强度低于300 lx,不充气。发育至棱柱幼体时(受精后24 h)利用260 目筛绢制成的漏网捞取上浮的幼体进行选优,并调整培育密度为0.5 ~0.8 个/mL,微弱充气使幼体在水中分布均匀,此时,开始投喂牟氏角毛藻Chaetoceros muelleri,每天8:00、14:00、20:00 投喂,开始投喂量参照常亚青等[1]的投喂方法,以后投喂量视幼体摄食消化情况而定。每天换水1次,每次为全量的1/2,每隔4 d 倒池1次。在以上条件下培育约22 d,各组的培育条件保持一致。在幼体培育阶段,每次投饵前进行1次镜检,观察幼体发育状况,并用数码相机拍照记录各阶段的形态。
1.2.3 温度对海胆的受精率、孵化率和不同发育阶段幼体生长的影响试验 将刚受精的受精卵置于500 mL 玻璃烧杯中,分别于18、22、26、30 ℃(温差在±0.3 ℃内)水浴锅内水浴,1 h 后镜检其受精率。受精卵的孵化密度为3 ind./mL,发育至棱柱幼体时(受精后24 h),随机取样测定孵化率。
取正常受精、发育至各期(四腕幼体、六腕幼体、八腕幼体)的幼体,分别置于18、22、26、30 ℃水温下培育,用设定好温度的加热棒保持水温,培育密度为0.3 个/mL,每天用同水温海水换水1次,每次换水量为全量的1/2,投喂牟氏角毛藻,每次投饵前镜检幼体摄食消化情况,并以此确定合适的投喂量。每天取样1次,观察幼体的生长发育情况,当18 ℃下培育幼体中有50%发育至该期末期的时候,对试验幼体进行取样测量,保证每种海胆至少测量100 个幼体,测量的性状包括四腕幼体的体长以及六腕幼体和八腕幼体的体长和胃长(图1)。观察及测量方法参考“水产动物浮游幼体尺寸的测量方法”[18]。各指标的计算方法如下:
受精率=2 细胞期胚胎数/(2 细胞期胚胎数+未分裂的细胞数)×100%,
孵化率=棱柱幼体数/(棱柱幼体数+未发育的细胞数)×100%,
畸形率=畸形幼体总数/幼体总数×100%。
1.3 数据处理
用Excel 2003 软件对数据进行初步整理,采用SPSS 13.0 软件,分别以海胆幼体种类和水温为影响因素,对受精率、孵化率、不同发育阶段的畸形率和各生长性状进行单因素方差分析,用Duncan法对各种间和各温度间性状的差异进行多重比较,显著性水平设为P<0.05。
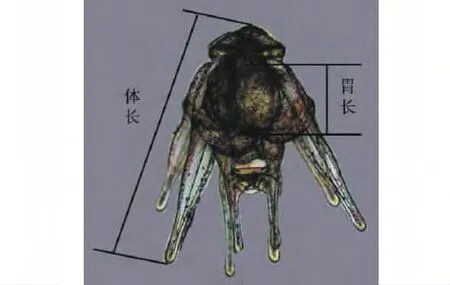
图1 海胆幼体体长、胃长的测量Fig.1 Measurements of body length and stomach length of the sea urchin larva
2 结果与分析
2.1 不同海胆的幼体发育
中间球海胆自繁、光棘球海胆自繁和杂交海胆子代的胚胎发育及发育时间见表1。两种自繁海胆和杂交海胆胚胎发育到各时期的时间有差异,3种海胆从受精卵发育到四腕幼体、六腕幼体和八腕幼体的时间均是光棘球海胆最快,杂交海胆其次,中间球海胆最慢。图2 为两种自繁海胆和杂交海胆的各期幼体,具体形态特征如下。

表1 18 ℃下海胆幼体的发育时间Tab.1 Developmental time of the sea urchin larvae at 18 ℃

图2 自繁与杂交海胆各期幼体形态Fig.2 Larval morphology of the sea urchin at various developmental stages in conspecific cross and interspecies hybridization
2.1.1 中间球海胆 中间球海胆四腕幼体,最明显的特征是具有4 条长腕和贯穿全身的骨针,顶部的2 根骨针交汇形成凸起的顶尖,消化系统已经较为完善,明显地区分出口、胃、肠等消化器官,躯干部占整个身体的比例较大,而胃所占比例较小;六腕幼体末期,顶端的2 根骨针断裂,躯干部变形呈顶端凸起的方形,胃部所占比例变大;八腕幼体时期,其幼体顶部变平滑,胃部明显增大,胃壁颜色加深。
2.1.2 光棘球海胆 光棘球海胆四腕幼体,4 条长腕向四周张开呈发散状,贯穿全身的2 根主骨针交汇于顶部,躯干部呈有规则的金字塔形,占整个身体的比例比腕小,而胃占躯干部的比例较大,腕的基部有若干突起;六腕幼体末期,长腕进一步张开,顶端的骨针断裂变圆,躯干部演变成不规则的扁圆形,具有多个瓣状褶皱,胃部所占的比例变大;八腕幼体时期,长腕完全张开,顶部变平呈柱状,躯干部具多个瓣状褶皱,胃部的比例更大,胃壁增厚、颜色加深。
2.1.3 杂交海胆 杂交海胆四腕幼体,躯干部与光棘球海胆基本相同,长腕则与中间球海胆相似,躯干部与长腕的比例介于两种自繁海胆之间;六腕幼体时期,顶端骨针断裂,顶部更加平滑,外部形态特征与中间球海胆相似,胃部所占比例增大;八腕幼体时期,外部形态与中间球海胆相近,但腕的基部与光棘球海胆相似,具有瓣状褶皱,胃部变大,胃壁增厚、颜色加深。
2.2 温度对海胆子代受精率和孵化率的影响
在4 个不同温度下,3种海胆子代的受精率和孵化率见表2。由表2可知:中间球海胆和光棘球海胆在18 ~30 ℃时的受精率均达到90%以上,而二者杂交子代在不同温度下的受精率均较低;Si♀×Si♂、Sn♀×Sn♂和Si♀×Sn♂、Sn♀×Si♂的最适受精温度分别为22、18、22、18 ℃,而Sn♀×Si♂在18 ℃以上高温组的受精率均为0。
中间球海胆在22 ℃时孵化率最高,为96.39%,而在26 ℃和30 ℃时不能孵化;光棘球海胆在18 ℃时孵化率最高,为97.52%,在26 ℃时孵化率则显著降低(P<0.05);杂交子代Si♀×Sn♂在18 ℃时孵化率为95.56%,显著高于22℃时(91.39%)(P<0.05);杂交子代Sn♀×Si♂的孵化率极低,因此,未能用于后续试验。几种海胆的孵化率在18 ℃时无显著性差异(P >0.05),在22 ℃时杂交子代的孵化率显著低于两种自繁海胆(P<0.05),在26 ℃时只有18.62%的光棘球海胆子代发育到棱柱幼体,而在30 ℃时所有的海胆子代均未发育(表2)。
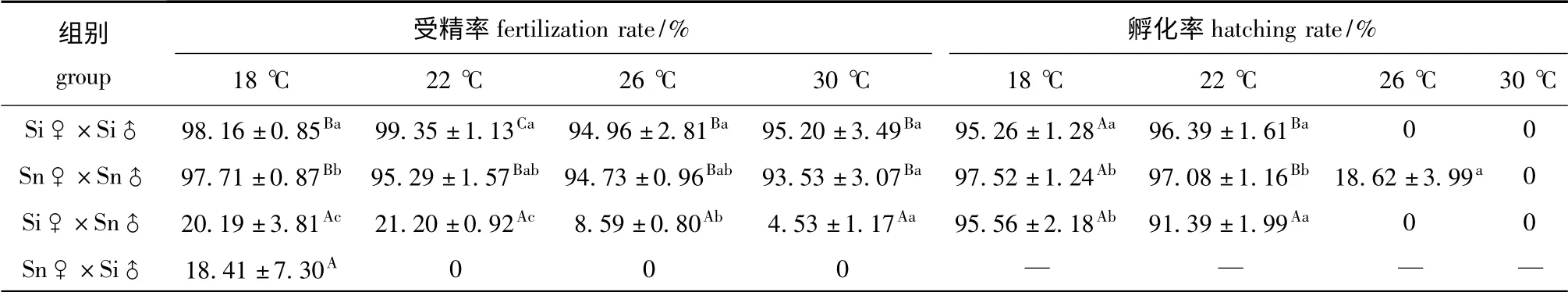
表2 各温度下不同海胆的受精率和孵化率(平均值±标准差)Tab.2 Fertilization rate and hatching rate(mean±S.D.)in various sea urchins at different water temperature
2.3 温度对不同发育期海胆幼体生长发育的影响
2.3.1 四腕幼体 温度对3种海胆四腕幼体发育的畸形率均有显著影响(P<0.05)。中间球海胆四腕幼体在18 ℃和22 ℃时的畸形率均较低,显著低于26 ℃时(P<0.05);光棘球海胆四腕幼体在22 ℃时的畸形率显著高于18 ℃时,显著低于26℃时(P<0.05);而杂交海胆四腕幼体由于培育不当,在22 ℃时全部死亡,因此,无法统计其畸形率,其在18 ℃时的畸形率则显著低于26 ℃时(P<0.05)。对于3种海胆的四腕幼体来说,在18℃时的畸形率均为最低,而当温度达到26 ℃时,畸形率均为最高(表3)。本试验中,30 ℃是3种海胆四腕幼体耐受的极限温度,在该温度下所有四腕幼体全部死亡。
各温度下,3种海胆四腕幼体的生长具有显著性差异(P<0.05)。多重比较结果显示:中间球海胆四腕幼体在22 ℃时的体长显著高于18 ℃和26 ℃时(P<0.05);而光棘球海胆四腕幼体在18℃时的体长显著高于26 ℃和22 ℃时(P<0.05);杂交海胆四腕幼体在18 ℃时的体长显著高于26 ℃时(P<0.05)。对于种间差异而言,在18、26 ℃时,光棘球海胆四腕幼体的体长显著高于中间球海胆和杂交海胆(P<0.05);在22 ℃时,中间球海胆四腕幼体的体长显著高于光棘球海胆(P<0.05)(表4)。
2.3.2 六腕幼体 温度对3种海胆六腕幼体发育的畸形率均有显著影响(P<0.05)。3种海胆六腕幼体在18 ℃时的畸形率均显著低于22 ℃时(P<0.05),3种海胆的六腕幼体在26 ℃和30 ℃时均全部死亡。多重比较结果显示:在18 ℃时,中间球海胆六腕幼体的畸形率显著高于光棘球海胆(P<0.05);在22 ℃时,3种海胆六腕幼体的畸形率均高于80%,其中仅光棘球海胆六腕幼体的畸形率显著高于中间球海胆(P<0.05)(表3)。
各温度下,3种海胆六腕幼体的生长性状具有显著性差异(P<0.05)。3种海胆六腕幼体在18℃时的生长性状均显著高于22 ℃时(P<0.05)。多重比较的结果显示:在18 ℃时光棘球海胆六腕幼体的体长显著高于中间球海胆和杂交海胆(P<0.05);在22 ℃时,中间球海胆六腕幼体的体长显著高于光棘球海胆和杂交海胆(P<0.05);在18 ℃时,光棘球海胆六腕幼体的胃长显著高于中间球海胆和杂交海胆(P<0.05);而在22 ℃时,杂交海胆六腕幼体的胃长显著高于中间球海胆和光棘球海胆(P<0.05)(表4)。
2.3.3 八腕幼体在18 ℃时,3种海胆八腕幼体的畸形率均较低,并且三者间无显著差异(P >0.05)。在22、26、30 ℃时,3种海胆的八腕幼体全部死亡(表3)。
3种海胆八腕幼体的生长性状具有显著性差异(P<0.05)。多重比较的结果显示:在18 ℃时,中间球海胆八腕幼体的体长显著低于光棘球海胆和杂交海胆(P<0.05);光棘球海胆八腕幼体的胃长显著高于中间海胆和杂交海胆(P<0.05)(表4)。
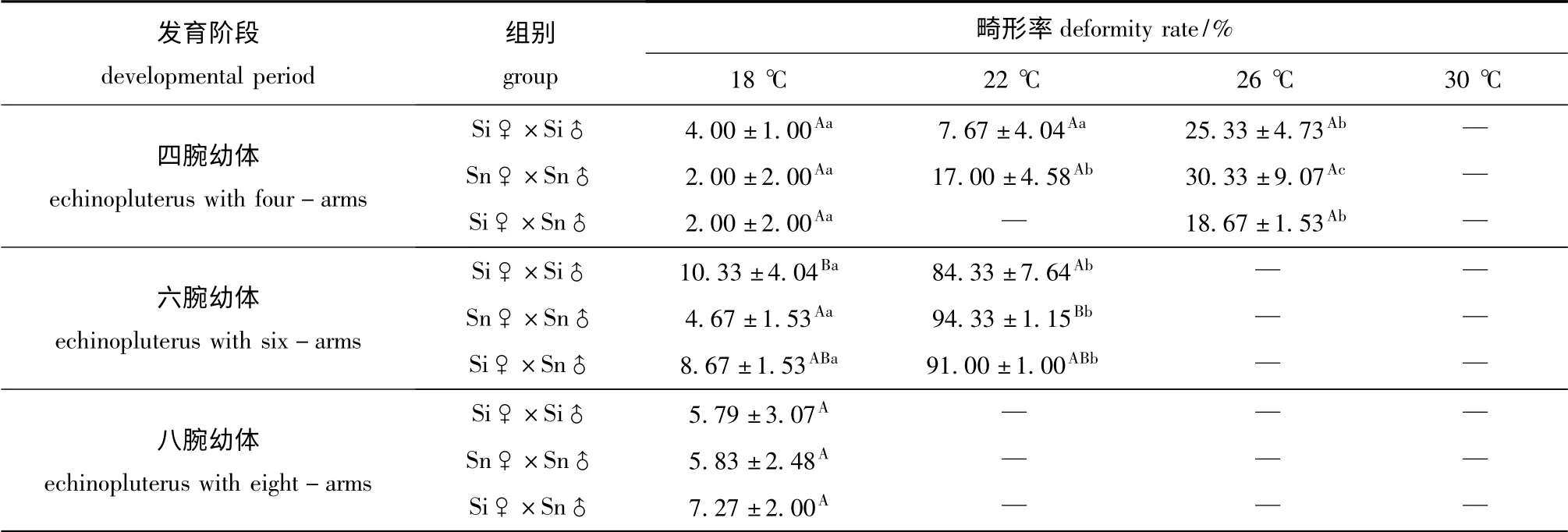
表3 各温度下不同发育阶段海胆幼体的畸形率(平均值±标准差)Tab.3 Deformity rate(mean±S.D.)of sea urchin larvae at various developmental periods at different temperatures
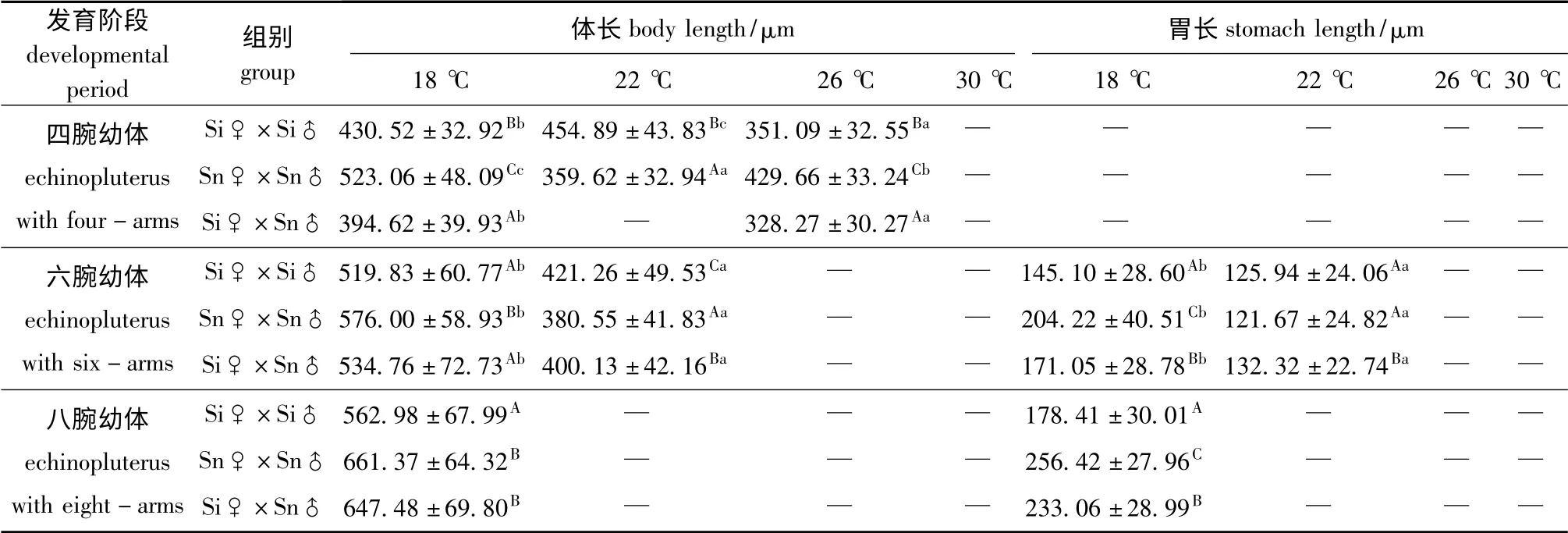
表4 各温度下不同发育阶段海胆幼体的生长性状(平均值±标准差)Tab.4 Growth(mean±S.D.)of sea urchin larvae at various periods at different temperatures
3 讨论
3.1 3种海胆幼体发育的比较
本研究结果表明,杂交海胆幼体在形态上与双亲均有相似和不同。六腕幼体和八腕幼体时期,杂交海胆的长腕并不像光棘球海胆一样向外张开,而是与中间球海胆的表现一致。但是其长腕基部带有一些瓣状褶皱,与光棘球海胆相似。这说明杂交幼体融合了父母本的基因,是真正的杂交后代。Ding等[15]通过观察杂交海胆成体的形态发现,杂交海胆与所有亲本并无完全相同的形态特征,而是融合了父母本形态的结合体。本研究中,3种海胆由受精卵发育到四腕幼体、六腕幼体和八腕幼体的时间均为光棘球海胆最快,杂交海胆其次,中间球海胆最慢,并且杂交海胆与中间球海胆的发育时间最接近,这表明杂交海胆幼体的生长速度处于亲本间,并且偏向于母本。隋娟等[19]对牙鲆Paralichthys olivaceus和夏鲆P.dentatus 进行了杂交和回交试验,结果表明,杂交后代的胚胎发育时间与其母本自繁后代的发育时间相近,且处于亲本之间,本研究结果与其一致。除发育速度外,不同种间海胆幼体的体长、胃的大小,以及躯干部和腕部占整个身体的比例也有较大差异,光棘球海胆的长腕占整个身体的比例显著大于中间球海胆和杂交海胆,而胃占躯干部的比例也是光棘球海胆最大。这表明本研究中杂交海胆几乎在各个时期体长及胃性状的表现均介于两种自繁海胆之间。Rahman等[20]研究发现,梅氏长海胆E.sp.A(♀)×白刺长海胆E.sp.C(♂)的杂交后代,其生长性状从幼体发育到成体生长阶段均处于父母本之间,本研究结果与其一致。
3.2 温度对海胆子代受精率、孵化率和幼体发育的影响
温度是影响海胆生长、发育和性腺品质[2-4]的最重要的因素之一。本研究结果表明,温度对光棘球海胆和杂交海胆的受精率和孵化率均有显著影响,但对中间球海胆的受精率和孵化率无显著影响。本研究中,中间球海胆的受精率和孵化率均在22 ℃时最高,该温度明显高于常亚青等[14]和王丽梅等[16]的研究结果(16 ~17 ℃),其原因尚需进一步研究;而光棘球海胆在18 ℃时受精率和孵化率最高,这与高绪生等[5]的研究结果一致;常亚青等[14]和王丽梅等[16]研究表明,中间球海胆(♀)×光棘球海胆(♂)杂交海胆的受精率最高可达53.7%,而本研究显示,杂交海胆在22 ℃时受精率最高为21.20%,这可能是由于杂交的精子量较少,并未按照自繁海胆精子量的10 ~40 倍进行受精[21],导致一个卵子周围聚集精子量较少,从而降低了卵子的受精率。Ding等[15]的研究也表明,利用纯精液能够提高杂交海胆的受精率。本研究中,随着温度的升高,3种海胆的受精率和孵化率均呈现下降趋势,当温度达到26 ℃以后,3种海胆的受精卵均会停止发育;而对于光棘球海胆(♀)×中间球海胆(♂)的杂交后代仅在18 ℃时受精,且受精卵发育孵化的较少,无法用于后续试验,而高于18 ℃时均没有出现受精现象。
本研究结果表明,温度对3种海胆幼体不同时期的畸形率和生长性状均有显著影响。四腕幼体时期,3种海胆的四腕幼体均在18 ℃时畸形率较低,中间球海胆四腕幼体的体长在22 ℃时最大,而光棘球海胆和杂交海胆四腕幼体的体长在18 ℃时最大;六腕幼体时期,3种海胆的六腕幼体在18 ℃时畸形率最低,体长和胃长也最大;八腕幼体时期,3种海胆的八腕幼体在温度高于22 ℃时几乎全部死亡。从本研究可知,3种海胆子代的热耐受性均为受精卵>四腕幼体>六腕幼体>八腕幼体,这与Byrne等[22]认为海胆Heliocidaris erythrogramma 受精卵的热耐受性要高于浮游幼体的研究结果一致。综上所述,本研究中涉及的3种海胆的最适宜培育水温均为18 ℃。对于中间球海胆而言,可在六腕幼体之前适当的提高培育水温,加快幼体的生长速度,从而缩短培育周期。
3.3 不同海胆子代受精率和孵化率以及幼体发育的表现
在本研究中,各温度下杂交海胆的受精率均显著低于两种自繁海胆,这是由于精卵的结合是由受精素和抗受精素的相互作用所导致,对于这种相互作用的结合,同种之间的反应强,而异种之间的反应就比较弱[23];不同温度下,杂交海胆的孵化率均介于两种自繁海胆之间,这与常亚青等[14]认为杂交海胆的孵化率均低于自繁组的研究结果不同,这可能是由于常亚青等的试验中子代受精率较高,导致胚胎质量参差不齐,从而降低了孵化率。本研究结果表明:四腕幼体时期,杂交海胆的畸形率在3种海胆中最低,其生长性状在3种海胆中也最差;六腕幼体时期,杂交海胆的畸形率和生长性状均介于两种自繁海胆之间;八腕幼体时期,杂交海胆的畸形率在3种海胆中最高,而其生长性状也优于中间球海胆。综上可知,本研究中的杂交海胆在浮游早期并未表现出生长上的优势,而是具有一定的耐热性。但随着其生长发育,杂交海胆在耐热上的表现逐渐变差,而在生长上的优势逐渐得到体现。这可能是由于在生长阶段,杂交幼体将大部分能量用于生长,从而对热的耐受能力相对减弱。Dégremont等[24]构建了太平洋牡蛎Crassostrea gigas耐高温品系,研究发现,耐高温品系牡蛎通过将繁育的部分能量用于抵抗夏季的高水温,从而导致其性腺指数显著低于对照品系。本研究结果表明,3种海胆中光棘球海胆在高温下的耐热性和生长形状最差。高绪生等[5]认为,光棘球海胆的最适水温为15 ~24 ℃,明显高于中间球海胆。这说明光棘球海胆幼体比成体更易受高温的影响。Dégremont等[24]发现,太平洋牡蛎某些群体的幼体比成体更容易受夏季高温的影响,这与本试验结果一致。
3.4 遗传效应对杂交后代的影响
杂交海胆是由来自不同种海胆亲本的配子结合发育而来,杂交可以使杂种后代增加变异性和异质性,综合双亲的优良性状,从而出现可利用的杂种优势[25]。本研究中,杂交海胆在发育的不同阶段就表现出不同亲本的优良性状。杂交海胆的最佳受精温度为22 ℃,与母本中间球海胆的最适受精温度一致,而父本光棘球海胆受精率最高时的温度为18 ℃。这说明在受精卵阶段母性效应起主导作用,提高了杂交海胆受精卵对热的耐受性,这与Byrne等[26]报道的母性效应能够影响无脊椎动物幼体的耐受性和生态分布的研究结果一致。孵化阶段,杂交海胆的最佳孵化温度与光棘球海胆相同,同时随着海胆幼体的生长发育,杂交海胆在生长性状上的表现更接近于父本光棘球海胆的快速生长。这说明随着幼体的发育,其受母性效应的影响在逐渐减弱,而父本对幼体的影响在逐渐增强。Rahman等[27]研究发现,对梅氏长海胆E.sp.A(♀)×白刺长海胆E.sp.C(♂)进行杂交时,以生长速度较快的白刺长海胆为父本杂交的后代生长优势更明显,这与本试验结果一致。本研究中,杂交海胆幼体的杂种优势体现在受精卵阶段的耐热性和后期幼体生长上的表现。
由于杂种海胆生长优势明显,种间杂交被认为具有育种潜力[13,25]。尽管如此,育种过程中应注意杂种海胆是否会对原种种质资源的威胁和破坏。Ding等[15]研究表明,在繁殖季节,成体中间球海胆(♀)×光棘球海胆(♂)的杂交海胆仅能产生少量精子。然而,董颖等[28]通过性腺组织切片发现,中间球海胆(♀)×光棘球海胆(♂)杂交海胆性腺发育不能明显分期,仅个别雌性个体能产生极少量成熟卵细胞,而雄性个体性腺中则无成熟精子。由此可认为,杂交海胆的繁殖力极低或无繁殖力,不会对原种的种质资源造成破坏。
[1]常亚青,丁君,宋坚,等.海参、海胆的生物学研究与养殖[M].北京:海洋出版社,2004.
[2]常亚青,王子臣,王国江.温度和藻类饵料对虾夷马粪海胆摄食及生长的影响[J].水产学报,1999,23(1):69 -76.
[3]Lawrence J M,Cao X,Chang Y,et al.Temperature effect on feed consumption,absorption,and assimilation efficiencies and production of the sea urchin Strongylocentrotus intermedius[J].Journal of Shellfish Research,2009,28(2):389 -395.
[4]Fuji A.Ecological studies on the growth and food consumption of Japanese common littoral sea urchin,Strongylocentrotus intermedius(A.Agassiz)[J].Memoirs of the Faculty of Fisheries Hokkaido University,1967,15(2):83 -160.
[5]高绪生,孙勉英,胡庆明,等.温度对光棘球海胆不同发育阶段的影响[J].海洋与湖沼,1993,24(6):634 -640.
[6]Cruz F L,Acuña G N,Escárate C G.Hybridization between Haliotis rufescens and Haliotis discus hannai:evaluation of fertilization,larval development,growth and thermal tolerance[J].Aquaculture Research,2013,44(8):1206 -1220.
[7]王祖熊,黄文郁.鲮鱼混精受精的育种实验[J].水产学报,1985,9(2):203 -206.
[8]刘国安,吴维新,林临安,等.兴国红鲤同草鱼杂交的受精细胞学研究[J].水产学报,1987,11(1):17 -21.
[9]李传武.兴国红鲤、草鱼及其杂种一代血清蛋白质的电泳分析[J].淡水渔业,1991(6):12 -14.
[10]Osanai K.Interspecific hybridization of sea urchins,Strongylocentrotus nudus and Strongylocentrotus intermedius[J].Bulletin of the Marine Biological Station of Asamushi Tohoku University,1974,15:37 -45.
[11]Hata M,Osanai K.Phenotypic analyses of sea urchin species interspecifically hybridized between Strongylocentrotus nudus and Strongylocentrotus intermedius[J].Bulletin of the Marine Biological Station of Asamushi Tohoku University,1994,19:65 -78.
[12]Rahman M A,Uehara T,Pearse J S.Hybrids of two closely related tropical sea urchins(genus Echinometra):evidence against postzygotic isolating mechanisms[J].The Biological Bulletin,2001,200(2):97 -106.
[13]Rahman M A.F1and F2backcrosses in the hybrids between two unnamed genetically distinct species of tropical sea urchins,Echinametra sp.A and Echinametra sp.C[J].Pakistan Journal of Biological Sciences,2003,6(13):1163 -1175.
[14]常亚青,王子臣,宋坚,等.四种海胆杂交的可行性及子代的早期发育[J].水产学报,2000,24(3):211 -216.
[15]Ding J,Chang Y Q,Wang C H,et al.Evaluation of the growth and heterosis of hybrids among three commercially important sea urchins in China:Strongylocentrotus nudus,S.intermedius and Anthocidaris crassispina[J].Aquaculture,2007,272(1):273-280.
[16]王丽梅,韩家波,许伟定,等.中间球海胆与光棘球海胆杂交及子一代人工育苗技术[J].水产科学,2003,22(2):9 -11.
[17]王笑月,董颖,王丽梅,等.盐度对中间球海胆(♀)×光棘球海胆(♂)杂交子代受精卵孵化及浮游幼体生长发育的影响[J].水产科学,2009,28(8):472 -474.
[18]大连海洋大学.水产动物浮游幼体尺寸的测量方法[P].中国发明专利:201010281748.5,2011 -02 -16.
[19]隋娟,徐世宏,王文琪,等.牙鲆与夏鲆杂交及回交子代胚胎发育及早期生长比较[J].海洋科学,2012,36(6):54 -58.
[20]Rahman M A,Uehara T.Interspecific hybridization and backcrosses between two sibling species of Pacific sea urchins(genus Echinometra)on Okinawan intertidal reefs[J].Zoological Studies,2004,43(1):93 -111.
[21]王子臣,常亚青.中间球海胆人工育苗的研究[J].中国水产科学,1997,4(1):60 -67.
[22]Byrne M,Ho M,Selvakumaraswamy P,et al.Temperature,but not pH,compromises sea urchin fertilization and early development under near-future climate change scenarios[J].Proceedings of the Royal Society B:Biological Sciences,2009,276:1883-1888.
[23]Palumbi S R.What can molecular genetics contribute to marine biogeography?An urchin's tale[J].Journal of Experimental Marine Biology and Ecology,1996,203(1):75 -92.
[24]Dégremont L,Boudry P,Ropert M,et al.Effects of age and environment on survival of summer mortality by two selected groups of the Pacific oyster Crassostrea gigas[J].Aquaculture,2010,299(1):44 -50.
[25]Rahman M A,Uehara T,Lawrence J M.Growth and heterosis of hybrids of two closely related species of Pacific sea urchin(Genues Echinometra)in Okinawa[J].Aquaculture,2005,245(1/4):121 -133.
[26]Byrne M,Sewell M A,Prowse T A A.Nutritional ecology of sea urchin larvae:influence of endogenous and exogenous nutrition on echinopluteal growth and phenotypic plasticity in Tripneustes gratilla[J].Functional Ecology,2008,22(4):643 -648.
[27]Rahman M A,Uehara T,Aslan L M.Comparative viability and growth of hybrids between two sympatric species of sea urchins(genus Echinometra)in Okinawa[J].Aquaculture,2000,183(1/2):45 -56.
[28]董颖,周遵春,王丽梅,等.中间球海胆(♀)× 光棘球海胆(♂)F1代的生殖腺特征[J].水产科学,2007,26(6):310 -314.
