自噬对巨噬细胞吞噬金黄色葡萄球菌的影响
2014-02-14吕允相吴惠梅刘荣玉
吕允相,吴惠梅,方 磊,刘荣玉
自噬对巨噬细胞吞噬金黄色葡萄球菌的影响
吕允相,吴惠梅,方 磊,刘荣玉
目的探讨金黄色葡萄球菌(简称金葡菌)对巨噬细胞自噬的影响,并研究其在巨噬细胞吞噬病原微生物中的作用。方法以小鼠单核巨噬细胞系RAW264.7为研究对象,以磷脂酰肌醇3激酶(PI3K)抑制剂3-甲基腺嘌呤(3-MA)为干预药物,空白处理作为对照组,金葡菌感染作为实验组,3-MA干预作为抑制组。金葡菌感染细胞后,Western blot检测自噬蛋白Beclin1、LC3以及吞噬相关蛋白Rac1的表达,激光共聚焦显微镜观察自噬、吞噬现象。结果金葡菌感染RAW264.7 1 h后,实验组LC3Ⅱ和PI3K蛋白表达最强(P<0.05),抑制组Beclin1和LC3Ⅱ表达显著降低(P<0.05),自噬颗粒聚集显著减少(P<0.05),Rac1表达显著降低(P<0.05),同时,RAW264.7吞噬金葡菌数目显著减少(P<0.05)。结论金葡菌诱导的自噬增强了巨噬细胞吞噬能力,自噬抑制剂3-MA抑制PI3K活性的同时,减弱了巨噬细胞自噬吞噬金葡菌的能力。
吞噬;自噬;巨噬细胞;磷脂酰肌醇3激酶;金黄色葡萄球菌
外来微生物进入身体无菌部位时,巨噬细胞通过趋化作用黏附、内化这些病原体,最终被清除,并产生细胞因子,诱导机体炎症反应,从而保护机体组织和器官[1]。自噬是哺乳动物细胞降解自身老化细胞器和蛋白集聚体必不可少的稳态过程,营养缺乏和免疫信号激活都能够诱导自噬从而清除细胞自身成分。研究[2]表明自噬具有桥接先天免疫和后天免疫的功能,自噬通路能够平衡免疫和炎症,从而对抗感染、自身免疫病和炎症性疾病。磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)家族是一类磷酸化酶,目前已知的有Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型和Ⅲ型都在自噬中有重要作用,Ⅰ型PI3K通过激活下游蛋白参与自噬,而Ⅲ型PI3K通过与Beclin1蛋白结合参与自噬过程[3]。酵母多糖可以通过Toll样受体2(Toll-like receptor 2,TLR2)招募Beclin1和激活PI3K诱导RAW264.7发生自噬[4]。金黄色葡萄球菌(简称金葡萄)是一种革兰阳性球菌,临床上分为耐甲氧西林金葡菌与甲氧西林敏感性金葡菌,其致病性主要是其细胞壁成分及产生外毒素和酶,然而金葡菌刺激巨噬细胞后能否诱导其自噬,以及自噬过程的激活能否增强巨噬细胞吞噬病原微生物尚不清楚。该实验以小鼠单核巨噬细胞系RAW264.7为研究对象,研究金葡菌诱导的巨噬细胞自噬对其吞噬能力的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系及菌株 小鼠单核巨噬细胞系RAW264.7购于上海细胞库;金黄色葡萄球菌NCTC8325由中国科学技术大学生命科学学院孙宝林教授馈赠。
1.1.2 主要试剂及仪器 DMEM培养基、Lipofectamine 2000、胎牛血清、青霉素和链霉素购于美国Invitrogen公司;噻唑蓝(MTT)试剂盒购于中国Solarbio公司;3-甲基腺嘌呤(3-methyladenine,3-MA)购于美国Sigma公司;LC3多克隆抗体购于美国Novus Biologicals公司;PI3K、Beclin1和Rac1单克隆抗体购于美国Cell Signaling公司;辣根过氧化物酶(HRP)标记的GAPDH和β-actin一抗购于中国康城公司;HRP标记的羊抗兔和兔抗鼠二抗购于美国Santa Cruz Biotechnology公司;ECL化学发光检测试剂盒、细胞培养箱购于美国Thermo公司;细胞培养板购于美国Corning公司;LSM510激光共聚焦显微镜购于德国蔡司公司;ELX800酶标仪购于美国Bio-Tek instruments公司;蛋白电泳转移系统购于美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 RAW264.7细胞用含10%胎牛血清、100 U/L青霉素和100 μg/ml链霉素的DMEM培养于37℃、5%CO2培养箱内,根据细胞数目形态2~3 d传代1次,保持细胞处于对数生长期。
1.2.2 细菌培养 金葡菌在0.1%氯霉素的LB培养基(胰蛋白胨10 g/L;酵母提取物5 g/L;氯化钠10 g/L)中培养20 h后,测定其650 nm处吸光度(optical density,OD650)(OD650=5.0,约5×109/ml),16%甘油冻存,-80℃保存。
1.2.3 金葡菌感染细胞 将对数生长期的RAW264.7按1×106/ml的密度分别接种6孔板,培养过夜。PBS清洗金葡菌3次,用不含抗生素的DMEM培养基重悬并稀释,根据预实验结果,按感染复数(multiplicity of infection,MOI)为100∶1(细菌∶细胞)加入培养板中感染细胞。将实验分为3组:空白处理作为对照组,金葡菌感染作为实验组,3-MA干预作为抑制组。
1.2.4 MTT检测3-MA作用下RAW264.7活力PBS冲洗细胞后,加入0.25%胰酶消化,待细胞形态变圆时弃去胰酶,用培养基轻轻吹落细胞,计数将细胞密度控制在5×104/ml,种于96孔板中36孔,每孔100 μl,96孔板四周孔加入PBS,每孔100 μl,放入培养箱内培养过夜,待细胞完全贴壁,密度约90%后,分别加入0、1.25、2.5、5和10 mmol/L 3-MA处理2 h后,弃去培养基加入新鲜培养基,每孔加入5%MTT(0.5 mg/ml)10 μl,继续培养4 h后,向每孔加入二甲基亚砜(DMSO)150 μl,在摇床上摇15 min,整个过程避光操作。紫色结晶溶解后用酶标仪检测各孔于490 nm波长处的吸光值。细胞存活(%)=(加药组吸光度/对照组吸光度)× 100%。
1.2.5 细胞转染及自噬吞噬观察 取对数期RAW264.7,计数约1×106/ml接种于玻璃底动态皿中,培养过夜,按Lipofectmine 2000说明书转染GFP-LC3,转染后,各组细胞处理如1.2.3所示,之后去除上清液,用PBS冲洗2次,加入10%甲醛固定10 min,弃去甲醛用PBS冲洗3次,最后加入1 ml PBS 4℃保存待激光共聚焦显微镜镜下观察。
1.2.6 蛋白提取和Western blot法检测相关蛋白表达 12孔板中细胞处理如1.2.3所示,之后加入含蛋白酶抑制剂和磷酸酶抑制剂细胞裂解液在冰上裂解细胞30 min,吹打裂解的细胞获取混合液于4℃12 000 r/min离心15 min,收集上清液加入等体积2×loading buffer混匀,煮沸10 min,-20℃保存。采用SDS-PAGE凝胶电泳法,下层12%分离胶,上层5%浓缩胶,蛋白上样,120 V恒压电泳1.5 h后,280 mA恒流转膜2 h将蛋白转至PVDF蛋白膜上,根据预染蛋白Marker,剪下不同的蛋白于湿盒内孵育相应一抗(稀释比例:LC3 1∶5 000;Beclin1 1∶2 000;PI3K 1∶1 000;Rac1 1∶1 000;GAPDH 1∶2 000;β-actin 1∶2 000),4℃过夜后室温1 h,TBST洗膜3次,每次15 min,室温孵育二抗1 h(稀释比例:1∶2 000),TBST洗膜3次,每次15 mim,ECL A、B液等体积混合后敷于蛋白膜上,于化学发光成像ChemiScope显影。运用Image J软件对蛋白灰度值进行分析。
1.3 统计学处理
2 结果
2.1 3-MA对RAW264.7活力的影响
3-MA预处理RAW264.7 2 h后,MTT比色法测得各组细胞活力相对百分比结果显示3-MA浓度为5 mmol/L时显著影响细胞活力(F=20.08,P<0.05),见表1。3-MA是一种特异性自噬抑制剂,在不影响RAW264.7活力的情况下,根据结果选择其最适浓度为2.5 mmol/L,因此在接下来的实验中使用3-MA的浓度为2.5 mmol/L。
表1 3-MA预处理2 h对RAW264.7活力的影响(n=6,±s)

表1 3-MA预处理2 h对RAW264.7活力的影响(n=6,±s)
与5 mmol/L组比较:*P<0.05
3-MA(mmol/L)细胞活力(%)0 84.36±9.87*1.2581.38±2.22*2.581.24±3.55*5 59.43±3.16 1040.77±2.05*
2.2 不同感染时间对RAW264.7 PI3K和LC3蛋白表达量的影响研究金葡菌诱导的RAW264.7自噬作用,金葡菌感染时间分别设为0、15、30、45、60、75、90、105、120、180和240 min。采用Western blot检测蛋白PI3K和LC3表达量。金葡菌感染1 h,PI3K和LC3Ⅱ表达量最高(P<0.05),见图1。
2.3 抑制PI3K活性下调了RAW264.7自噬相关蛋白的表达和自噬颗粒的聚集3-MA预处理RAW264.7后,金葡菌感染后,Western blot检测PI3K、Beclin1和LC3Ⅱ蛋白表达量。实验组和抑制组PI3K表达量差异无统计学意义(P>0.05);实验组与对照组LC3Ⅱ表达量差异有统计学意义(P=0.001 9);实验组与抑制组LC3Ⅱ表达量差异有统计学意义(P=0.001 1);对照组与抑制组LC3Ⅱ表达量差异无统计学意义(P>0.05);对照组与实验组Beclin1表达量差异有统计学意义(P=0.021 9);实验组与抑制组Beclin1表达量差异有统计学意义(P=0.000 3)。见图2。同时,激光共聚焦观察LC3自噬颗粒聚集。实验组(6.27±0.405)带绿色荧光LC3自噬颗粒表达量较对照组(1.16± 0.334)、抑制组(2.17±0.176)显著增加(P<0.01),见图3。

图1 金葡菌感染RAW264.7不同时间后,Western blot检测PI3K和LC3Ⅱ蛋白表达量与金葡萄感染60 min组比较:*P<0.05
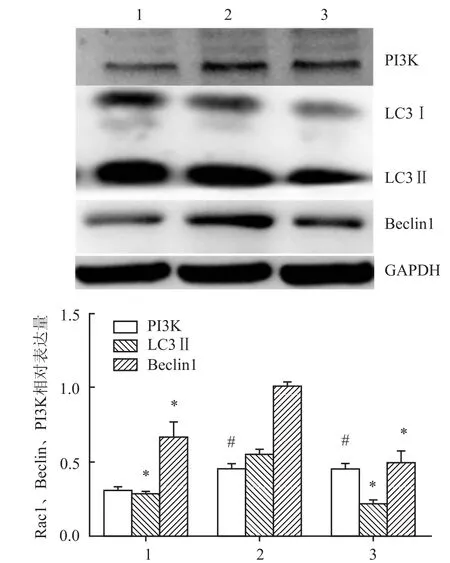
图2 金葡菌感染RAW264.7后PI3K、LC3Ⅱ及Beclin1表达量1:对照组;2:实验组;3:抑制组;与实验组比较:*P<0.05;与对照组比较:#P<0.05
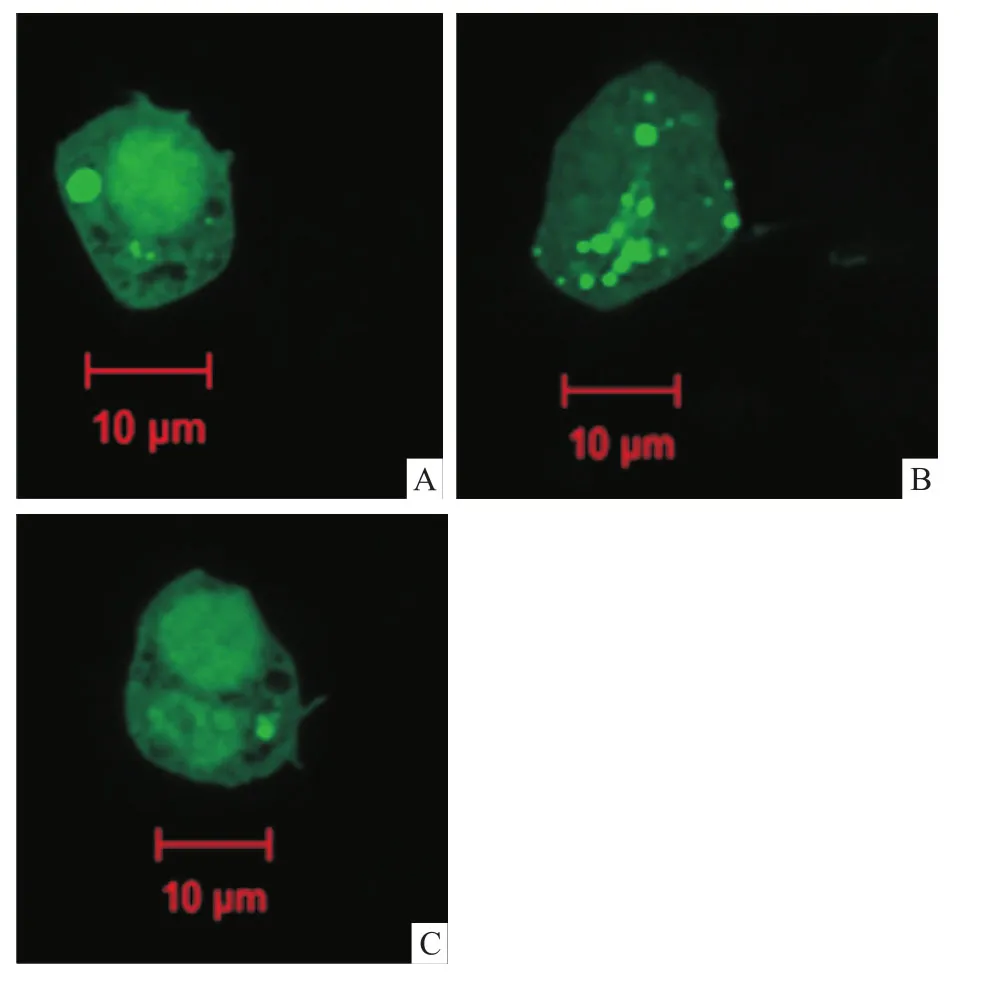
图3 激光共聚焦下观察RAW264.7细胞自噬现象×630A:对照组;B:实验组;C:抑制组
2.4 抑制PI3K活性下调了RAW264.7吞噬相关蛋白的表达和吞噬金葡菌的数目3-MA预处理RAW264.7后,用约1×108/ml金葡菌感染细胞后,Western blot检测Rac1蛋白表达量。对照组与实验组Rac1表达量差异有统计学意义(P=0.000 1);实验组与抑制组Rac1表达量差异有统计意义(P=0.047 3),见图4。同时,激光共聚焦观察RAW264.7吞噬金葡菌的数目。圆形或椭圆形表面有突起的是RAW264.7,细胞上吞噬的圆点为金葡菌,抑制组(8.37±0.397)RAW264.7吞噬金葡菌比实验组(11.90±0.601)显著减少,差异有统计学意义(P<0.01),见图5。
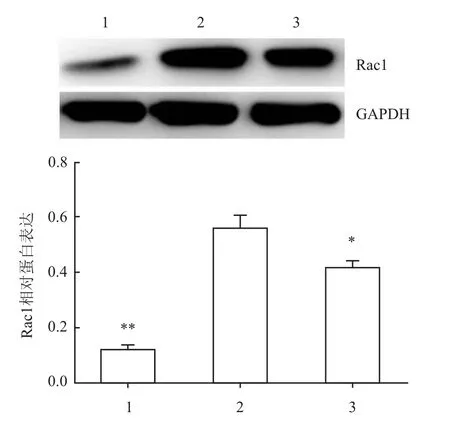
图4 金葡菌感染后RAW264.7 Rac1表达量1:对照组;2:实验组;3:抑制组;与实验组比较:*P<0.05,**P<0.01

图5 激光共聚焦下观察RAW64.7吞噬现象 ×630A:实验组;B:抑制组
3 讨论
金葡菌与过敏性疾病如哮喘相关,近期研究[5]表明哮喘患者血清中常含有特异性金葡菌外毒素抗体IgE,而且IgE浓度与哮喘严重程度呈正相关。金葡菌外空泡可以诱导气道中性粒细胞Th1和Th17反应,同时可以增强气道高反应性[6]。因此,有效清除气道内金葡菌可能减轻哮喘症状及其发作。
肺泡巨噬细胞(alveolar macrophages,AMs)是气道先天性免疫的第一道屏障,能监测和清除病原体并启动早期宿主免疫反应,激素依赖性哮喘患者AMs吞噬凋亡细胞的能力明显降低[7]。Simpson et al[8]也发现非嗜酸粒细胞性哮喘患者痰中巨噬细胞吞噬凋亡细胞的能力也明显降低。临床上激素治疗非嗜酸性粒细胞性哮喘不理想。因此,调控AMs对病原体的吞噬可能是哮喘治疗一个潜在策略。Rac1是Rho家族蛋白之一,活化Rac1引起细胞骨架结构和细胞形态改变,进而膜褶皱形成吞噬杯调节吞噬[9]。Tanaka et al[10]在肺炎小鼠AMs中显示激活Rac1后上调对凋亡细胞的吞噬。本实验显示金葡菌感染RAW264.7 1 h后,PI3K蛋白表达量明显升高。3-MA抑制PI3K活性后,Rac1蛋白表达量显著降低,吞噬率显著降低,提示激活PI3K可能参与了吞噬。同时,本实验显示抑制Rac1表达后,RAW264.7吞噬金葡菌能力降低,与Shen et al[11]认为抑制Rac1活性减弱了肌动蛋白的聚集,降低了小鼠巨噬细胞对李斯特菌的吞噬的研究一致。以上结果提示RAW264.7 Rac1的活化是依赖PI3K的。
自噬蛋白Beclin1是Atg6的哺乳动物同源类似物,参与Ⅲ类PI3K复合物的形成同时招募其他蛋白促进自噬吞噬体膜形成[12]。LC3是Atg8的哺乳动物同源物,通过Atg4水解C端形成胞质LC3Ⅰ,之后与磷脂酰乙醇胺共价结合形成膜LC3Ⅱ。LC3Ⅱ持续存在于自噬体膜,是目前自噬吞噬体最可靠的标志蛋白[13]。研究[14]显示,在中重度哮喘患者上皮细胞和成纤维细胞内发现了大量自噬颗粒聚集,也显示自噬基因Atg5固有单核苷酸多态性(single nucleotide polymorphisms,SNPs)rs 2212740序列与哮喘相关,而且此序列与哮喘患者一秒用力呼气容积(forced expiratory volume in one second,FEV1)相关,因此推测自噬可能是参与气道重塑和肺功能降低的细胞机制。Mestre et al[12]研究发现,金葡菌能够通过降低细胞内cAMP水平诱导宿主细胞自噬,本研究发现金葡菌感染1 h后,PI3K蛋白表达量最高,Beclin1和LC3Ⅱ蛋白表达显著升高,而且细胞GFPLC3颗粒聚集显著升高,提示PI3K参与了金葡菌诱导的RAW264.7自噬;抑制PI3K活性后,自噬蛋白表达显著降低,GFP-LC3颗粒聚集也显著降低,进一步提示金葡菌通过PI3K介导了RAW264.7的自噬。
本实验以小鼠单核巨噬细胞系RAW264.7为研究对象,在金葡菌感染的情况下,抑制PI3K活性为手段,探讨RAW264.7自噬吞噬过程。该实验示金葡菌诱导了RAW264.7自噬,且感染1 h时自噬蛋白表达量达到最高。3-MA抑制PI3K活性后,RAW264.7自噬蛋白表达和自噬颗粒聚集显著降低,且对金葡菌吞噬黏附也显著降低。总之,PI3K介导的巨噬细胞自噬可能是调节其吞噬作用的机制。
综上所述,虽然本研究显示PI3K在金葡菌感染的小鼠单核巨噬细胞系诱导的自噬过程中起着很重要的作用,抑制PI3K活性下调了自噬和吞噬,此结果可能为研究金葡菌与AMs在哮喘中的作用提供理论基础,但此过程只局限于体外研究,小鼠巨噬细胞系并不能等同于AMs。因此,本实验需要更进一步的研究去探索金葡菌诱导小鼠哮喘模型AMs自噬对吞噬的影响。
[1] Bozzaro S,Bucci C,Steinert M.Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages[J].Int Rev Cell Mol Biol,2008,271:253-300.
[2] Kuballa P,Nolte W M,Castoreno A B,et al.Autophagy and the immune system[J].Annu Rev Immunol,2012,30:611-46.
[3] Lin Y C,Kuo H C,Wang J S,et al.Regulation of inflammatory response by 3-methyladenine involves the coordinative actions on Akt and glycogen synthase kinase 3beta rather than autophagy[J].J Immunol,2012,189(8):4154-64.
[4] Sanjuan M A,Dillon C P,Tait S W,et al.Toll-like receptor signalling in macrophages links the autophagy pathway to phagocytosis[J].Nature,2007,450(7173):1253-7.
[5] Bachert C,Gevaert P,Howarth P,et al.IgE to Staphylococcus aureus enterotoxins in serum is related to severity of asthma[J].J Allergy Clin Immunol,2003,111(5):1131-2.
[6] Kim M R,Hong S W,Choi E B,et al.Staphylococcus aureus-derived extracellular vesicles induce neutrophilic pulmonary inflammation via both Th1 and Th17 cell responses[J].Allergy,2012,67(10):1271-81.
[7] Huynh M L,Malcolm K C,Kotaru C,et al.Defective apoptotic cell phagocytosis attenuates prostaglandin E2 and 15-hydroxyeicosatetraenoic acid in severe asthma alveolar macrophages[J].Am J Respir Crit Care Med,2005,172(8):972-9.
[8] Simpson J L,Gibson P G,Yang I A,et al.Impaired macrophage phagocytosis in non-eosinophilic asthma[J].Clin Exp Allergy,2013,43(1):29-35.
[9] Wang Q Q,Li H,Oliver T,et al.Integrin beta 1 regulates phagosome maturation in macrophages through Rac expression[J].J Immunol,2008,180(4):2419-28.
[10]Tanaka T,Terada M,Ariyoshi K,et al.Monocyte chemoattractant protein-1/CC chemokine ligand 2 enhances apoptotic cell removal by macrophages through Rac1 activation[J].Biochem Biophys Res Communl,2010,399(4):677-82.
[11]Shen Y,Kawamura I,Nomura T,et al.Toll-like receptor 2 and MyD88-dependent phosphatidylinositol 3-kinase and Rac1 activation facilitates the phagocytosis of Listeria monocytogenes by murine macrophages[J].Infect Immun,2010,78(6):2857-67.
[12]Mestre M B,Colombo M I.Staphylococcus aureus promotes autophagy by decreasing intracellular cAMP levels[J].Autophagy,2012,8(12):1865-7.
[13]Tanida I,Sou Y S,Ezaki J,et al.HsAtg4B/HsApg4B/autophagin-1 cleaves the carboxyl termini of three human Atg8 homologues and delipidates microtubule-associated protein light chain 3-and GABAA receptor-associated protein-phospholipid conjugates[J].J Biol Chem,2004,279(35):36268-76.
[14]Poon A,Eidelman D,Laprise C,et al.ATG5,autophagy and lung function in asthma[J].Autophagy,2012,8(4):694-5.
The effect of autophay on the Staphylococcus aureus phagocytosized by macrophages
Lü Yunxiang,Wu Huimei,Fang Lei,et al
(Dept of Geriatrics Respiratory,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo study the effect of Staphylococcus aureus on autophagy in macrophages and the role of autophagy in the pathogens phagocytosis by macrophages.MethodsMouse monocyte-macrophage cell line RAW264.7 was used,before infecting by Staphylococcus aureus,RAW264.7 cells were pretreated by phosphatidylinositol3-kinase(PI3K)inhibitor,3-MA.Blank treatment was served as control group,infected by Staphylococcus aureus was served as experimental group and pretreated by 3-MA was served as inhibited group.The protein expression levels of LC3,Beclin1 and Rac1 were measured by Western blot,the process of autophagy and phagocytosis were viewed by Confocal Scanning Laser Microscope.ResultsThe protein expression levels of LC3Ⅱand PI3K were increased after infected by Staphylococcus aureus for 1 h(P<0.05).Compared to that in experimental group,the protein expression levels of LC3Ⅱand Beclin1(P<0.05),the aggregation of autophagy puncta were significantly decreased in inhibited group(P<0.05).Similarly,the protein level of Rac1(P<0.05)and the phagocytosis of Staphylococcus aureus in RAW264.7 were significantly reduced in inhibited group(P<0.05).ConclusionAutophagy induced by Staphylococcus aureus strengthens the phagocytosis of macrophages,and autophagy and phagocytosis in macrophages are down-regulated via inhibiting PI3K activity by 3-MA.
phagocytosis;autophagy;macrophage;phosphatidylinositol-3-kinase;Staphylococcus aureus
R 378.1
A
1000-1492(2014)06-0706-05
2014-02-17接收
国家自然科学基金面上项目(编号:81270082、81170030);教育部高等学校博士学科点专项科研基金(编号:20113420110006);安徽省科技攻关项目(编号:12010402135);重点实验室计划项目(编号:1206c0805028)
安徽医科大学第一附属医院老年呼吸内科,合肥
230022
吕允相,男,硕士研究生;刘荣玉,女,教授,主任医师,博士生导师,责任作者,E-mail:rongyuliu@gmail.com
