脂肪乳对内毒素诱导急性肺损伤大鼠肺组织白介素6分泌及肺泡上皮细胞凋亡的影响
2014-02-08石计朋黄丽密
石计朋,黄丽密,尚 云
急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)指由心源性以外的各种肺内外致病因素导致的急性进行性、缺氧性呼吸衰竭,已成为医院患者死亡的重要原因之一。虽然抗生素能有效杀灭细菌,但不能阻止已经被激活的全身炎性反应。白介素6(IL-6)是急性炎性反应中的一种多功能细胞因子,具有广泛的生物活性和免疫调节作用,近年来,其在ALI/ARDS发病过程中的作用一直为学者们所关注。IL-6主要由肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)刺激巨噬细胞分泌,与TNF-α、IL-1β一起被称作“前炎性细胞因子”。
脂肪乳已普遍应用于危重症患者的肠外营养,多不饱和脂肪酸(PUFAs)是免疫营养的重要组成部分,可以通过多种分子机制调控机体炎症和免疫功能,在多种感染疾病的治疗中具有良好的前景。目前临床上常用的脂肪乳有:(1)ω-3鱼油脂肪乳注射液(尤文),属于ω-3系列,主要有α-亚麻酸、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等;(2)脂肪乳注射液(C14~24)(英脱利匹特),属于ω-6系列,主要包括亚油酸、γ-亚麻酸和花生四烯酸(AA);(3)长链脂肪乳注射液(OO)(克林诺),含橄榄油80%、豆油20%,特点是富含ω-9单不饱和脂肪酸(ω-9MUFAs)、低饱和脂肪酸、天然抗氧化剂维生素E等。本研究以ALI大鼠为模型,比较英脱利匹特、克林诺和尤文3种脂肪乳对肺组织IL-6分泌及肺泡上皮细胞凋亡的影响,以期为临床合理使用脂肪乳提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级幼年雄性Sprague-Dawley(SD)大鼠100只,体质量在160~180 g,由上海斯莱克动物有限责任公司提供,许可证号:SCXK(沪)2003-0003。大鼠于新乡医学院实验动物中心清洁级实验室内饲养,昼夜照明12 h/12 h,相对湿度70%,饲养温度25 ℃。
1.1.2 脂肪乳 英脱利匹特和尤文均购自上海华瑞制药有限公司,克林诺购自美国Baxter公司。
1.1.3 主要试剂和仪器 原位细胞凋亡试剂盒(德国Roche公司),苏木素染色液(福州迈新生物技术开发有限公司),脂多糖(LPS,大肠埃希菌O111:B4,美国Sigma-Aldrich 公司),总RNA提取试剂(Trizol,上海英骏生物技术有限公司),反转录聚合酶链反应(RT-PCR)试剂盒〔大连宝生物(TaKaRa)公司〕,琼脂糖(上海生工生物工程有限公司);LKB-V2088型超薄切片机(瑞典GERMAN),酶联免疫吸附试验(ELISA)试剂盒(上海西唐生物科技有限公司),Wellscan MK3全自动多功能酶标仪(芬兰Thermo公司),PCR仪(德国Biometra公司)。
1.2 方法
1.2.1 动物分组及动物模型制备 将100只SD大鼠按随机数字表法分为5组,每组20只:对照组、模型组、英脱利匹特组、克林诺组和尤文组。采用静脉留置针在大鼠尾静脉穿刺并固定,连续7 d分别向对照组和模型组大鼠注射0.9%氯化钠注射液(生理盐水)、英脱利匹特组注射英脱利匹特、克林诺组注射20%克林诺、尤文组注射尤文,剂量均为30 ml·kg-1·d-1。在取血和支气管肺泡灌洗之前8 h,对照组大鼠气管内滴入生理盐水0.25 ml/kg,后4组大鼠均喷洒LPS溶液制备ALI大鼠模型,剂量均为0.5 mg/kg。模型制备成功与否主要根据大鼠有无肺损伤的表现,并通过肺系数和ALI评分来判断。
1.2.2 标本制备 大鼠气管内滴入LPS溶液8 h后,将大鼠麻醉,然后打开胸腔。收集肺泡灌洗液(BALF)于EP管中,于-80 ℃保存待行ELISA。左肺:标本离体后,于Eppendorf管内-80 ℃冰箱保存,待测IL-6 mRNA表达水平;右肺:标本置于4%甲醛液中保存,待常规苏木素-伊红(HE)染色及脱氧核糖核酸转移酶介导的细胞凋亡标记技术(TUNEL)检测。
1.2.3 观察指标 (1)采用HE染色在光镜下观察肺组织上皮细胞的病理变化;(2)RT-PCR法检测肺组织IL-6 mRNA的表达;(3)采用ELISA法检测各组BALF中IL-6水平;(4)采用TUNEL检测细胞凋亡,并计算凋亡指数(apoptosis index,AI),AI=凋亡细胞数/细胞总数×100%。
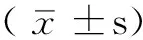
2 结果
2.1 ALI大鼠模型制备结果 应用脂肪乳静脉营养期间,英脱利匹特组、克林诺组和尤文组各死亡2只,对照组死亡1只。气管内喷洒LPS溶液后,大鼠均出现呼吸急促,精神较差,蜷缩成团,毛发竖起、蓬乱,少数伴有头部颤动,拒食,2 h左右模型组和英脱利匹特组各死亡3只,克林诺组和尤文组各死亡2只。存活大鼠状态逐渐好转,活动可,摄食、饮水,毛发光亮整齐。
各组大鼠光镜下肺组织的病理变化:除了对照组,其余4组大鼠气管内喷洒LPS溶液后肺组织均可见明显的炎性反应。大鼠肺泡结构被破坏;肺泡隔变厚;肺泡腔及间质内可见炎性细胞浸润;肺泡腔内有较多渗出液,部分肺泡塌陷、不张,甚至有透明膜形成(见图1)。模型制备后各组大鼠肺系数及ALI评分比较,差异有统计学意义(P<0.05);其中模型组、英脱利匹特组、克林诺组和尤文组大鼠的肺系数和ALI评分均高于对照组,差异有统计学意义(P<0.01,见表1),提示ALI大鼠模型建立。

Table1 The lung coefficients and the ALI scores in different groups of rats after LPS treatment
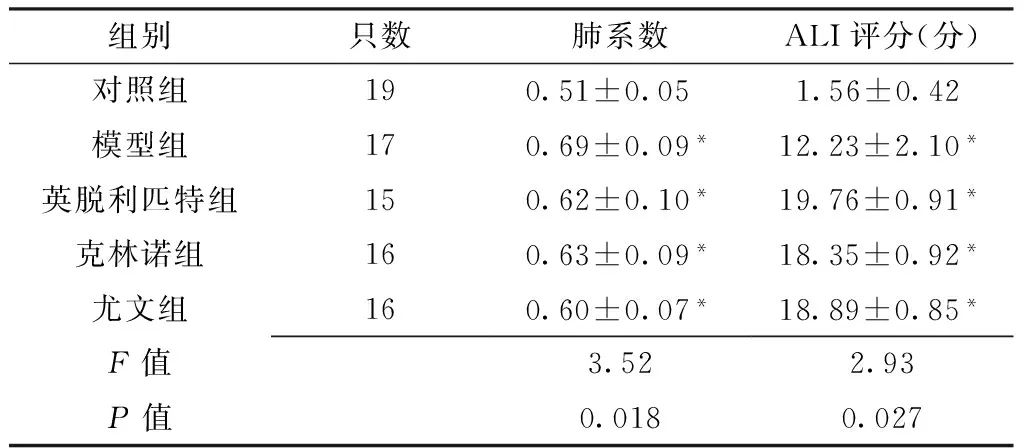
组别只数肺系数ALI评分(分)对照组190.51±0.05 1.56±0.42 模型组170.69±0.09*12.23±2.10*英脱利匹特组150.62±0.10*19.76±0.91*克林诺组160.63±0.09*18.35±0.92*尤文组160.60±0.07*18.89±0.85*F值3.522.93P值0.0180.027
注:ALI=急性肺损伤;与对照组比较,*P<0.01
2.2 各组大鼠肺组织IL-6 mRNA表达水平 5组大鼠肺组织IL-6 mRNA表达水平比较,差异有统计学意义(P<0.05);其中对照组大鼠肺组织IL-6 mRNA表达水平均低于其他4组,英脱利匹特组IL-6 mRNA表达水平高于模型组、克林诺组和尤文组,林诺组、尤文组IL-6 mRNA表达水平低于模型组,差异均有统计学意义(P<0.05);而克林诺组和尤文组间差异无统计学意义(P>0.05,见图2、表2)。
2.3 各组大鼠BALF中IL-6水平比较 5组大鼠BALF中IL-6水平比较,差异有统计学意义(P<0.05);其中对照组大鼠BALF中IL-6水平均低于其他4组,英脱利匹特组IL-6水平高于模型组、克林诺组及尤文组,克林诺组、尤文组IL-6水平低于模型组,差异均有统计学意义(P<0.05);而克林诺组和尤文组间差异无统计学意义(P>0.05,见表2)。

Table2 Comparison of IL-6 mRNA expression levels of lung tissues and IL-6 levels of BALF in different groups of rats
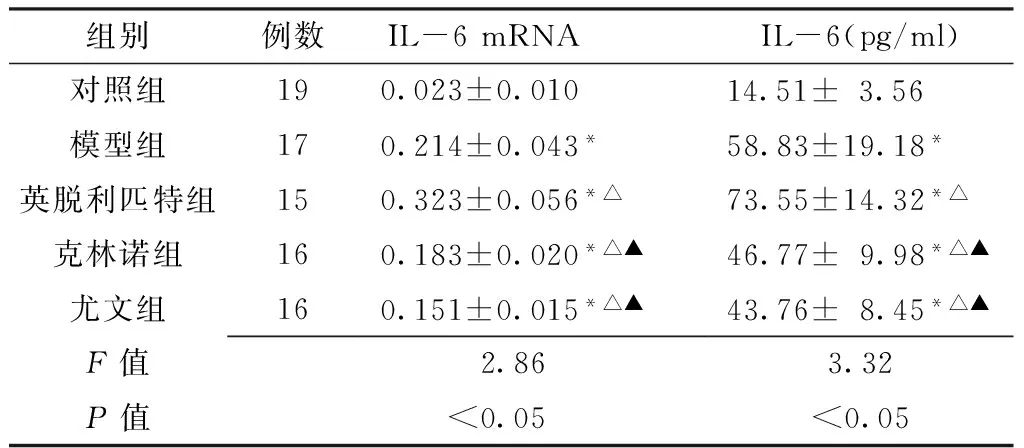
组别例数IL-6mRNA IL-6(pg/ml)对照组190.023±0.01014.51±3.56 模型组170.214±0.043*58.83±19.18* 英脱利匹特组150.323±0.056*△73.55±14.32*△ 克林诺组160.183±0.020*△▲46.77±9.98*△▲尤文组160.151±0.015*△▲43.76±8.45*△▲F值 2.863.32P值 <0.05<0.05
注:IL-6=白介素6;与对照组比较,*P<0.05;与模型组比较,△P<0.05;与英脱利匹特组比较,▲P<0.05
2.4 各组大鼠肺泡上皮细胞凋亡情况比较 5组大鼠肺组织均可见不同程度的凋亡细胞,凋亡细胞以肺泡上皮细胞为主。各组大鼠肺泡上皮细胞AI比较,差异有统计学意义(P<0.05);其中对照组AI均低于其他4组,克林诺组、尤文组AI均低于模型组和英脱利匹特组,差异有统计学意义(P<0.05,见表3)。

Table3 Comparison of apoptosis index of alveolar epithelial cells in different groups of rats

组别例数AI 对照组19 3.3±2.0 模型组1719.7±4.9* 英脱利匹特组1518.2±3.0* 克林诺组1612.8±3.9*△▲尤文组1611.8±3.2*△▲F值12.34P值<0.05
注:AI=凋亡指数;与对照组比较,*P<0.05;与模型组比较,△P<0.05;与英脱利匹特组比较,▲P<0.05

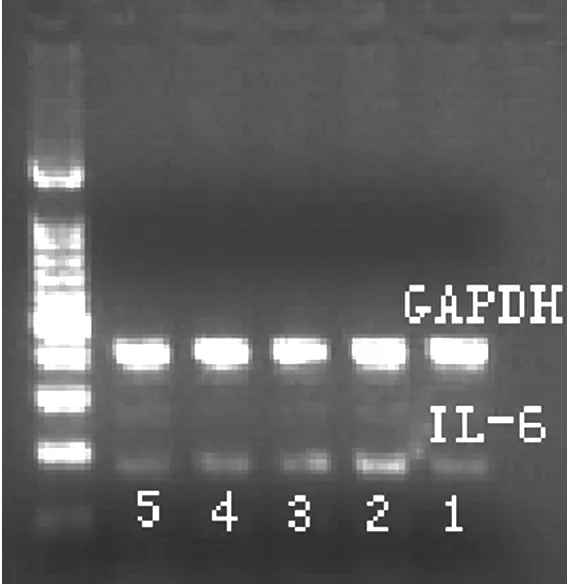
注:1为对照组,2为模型组,3为英脱利匹特组,4为克林诺组,5为尤文组
图1 各组大鼠肺组织HE染色结果(×200)
Figure1 The HE staining of lung tissues in different groups of rats
注:1为对照组,2为模型组,3为英脱利匹特组,4为克林诺组,5为尤文组
图2 各组大鼠肺组织IL-6 mRNA的表达
Figure2 Expression of IL-6 mRNA of lung tissues in different groups of rats
3 讨论
ALI/ARDS的发病机制错综复杂,目前认为严重创伤和脓毒血症等引起的过度炎性反应经启动并失去控制,导致全身炎症反应综合征,而肺脏是全身炎性反应失控最容易受到打击的器官,SIRS失控在肺部表现为ALI/ARDS。在这个过程中,多种效应细胞和炎性递质参与了ALI/ARDS的发生或发展。IL-6是启动全身炎性反应最强的内源性炎性递质,能够催化和放大炎性反应,是机体炎症与疾病严重程度的重要指标[1]。在参与ALI/ARDS的众多前炎性细胞因子中,IL-6是ALI/ARDS发生、发展中起重要作用的炎性递质。Hierholzer等[2]给正常小鼠气管内吸入IL-6可导致多形核白细胞(PMN)渗透、积聚以及以肺水肿为特征的ALI,认为IL-6可致肺损伤。其转录由核因子κB(NF-κB)所介导,而NF-κB可被活性氧等上游信号分子诱导活化,从而激活IL-6信号途径。LPS预处理后,年轻和衰老小鼠腹腔巨噬细胞分泌IL-6的能力普遍增加[3]。
英脱利匹特是在临床上最常使用的富含ω-6长链PUFAs,以豆油为主要来源,其中亚油酸被分解产生的AA是脂质炎性递质的前体,通过环氧化酶、脂氧化酶、细胞色素-P450途径可以产生多种炎性递质,如前列腺素E2、白三烯B4(LTB4)等,进而调节炎性反应和免疫。在欧洲国家,一种富含ω-9MUFAs、以橄榄油为主的脂肪乳——克林诺,被推荐用于静脉营养(含橄榄油80%、豆油20%)。此外,一种富含ω-3PUFAs、以鱼油为主的脂肪乳——尤文,对炎症的影响也是最近比较热门的研究课题,其主要成分为EPA和DHA,二者可增加细胞膜磷脂ω-3PUFAs成分,减少炎性二十烷类产生;同时增加了非炎性二十烷,以竞争AA至二十烷类合成的途径,从而调节机体内一系列细胞因子的水平及免疫功能。
ω-3PUFAs在脂氧合酶和环氧合酶的作用下产生前列腺素3(PGE3)和白三烯B5(LTB5),对中性粒细胞的趋化、聚集和释放溶菌酶等的作用大约是LTB4的十分之一;同时ω-3PUFAs与AA竞争结合细胞膜磷脂,降低细胞膜磷脂中AA含量,进而减少高效炎性递质的产生;ω-3PUFA还可通过抑制磷脂酶A2(PLA2)的活性,减少膜磷脂AA的释放,从而减少来源于AA的类花生酸;EPA和DHA还能抑制细菌LPS诱导NF-κB的活化和环氧酶2的表达[4]。本研究结果显示,英脱利匹特的代谢产物AA作为脂质炎性递质的前体,可显著上调肺组织IL-6 mRNA的表达,使BALF中IL-6水平升高;而克林诺组和尤文组肺组织IL-6 mRNA的表达和BALF中IL-6水平则较英脱利匹特组降低。由于克林诺富含天然抗氧化剂维生素E,后者能够减少氧自由基和脂质过氧化物的损害;而NF-κB可被活性氧等上游信号分子诱导活化,从而激活IL-6信号途径。通过研究推测克林诺可能通过减少NF-κB的活化而下调IL-6的表达。尤文能降低IL-6的表达,推测其机制可能与其主要成分EPA和DHA减少炎性递质的产生,并能抑制细菌LPS诱导NF-κB的活化有关。在降低炎性递质IL-6分泌方面,克林诺与尤文作用相似,均优于豆油来源的英脱利匹特。
细胞凋亡又称为程序性细胞死亡,指体内外生理或病理因素触发细胞内预存的死亡程序而导致的细胞主动死亡过程,在炎症、损伤、组织修复等过程中具有重要的作用。研究发现,活性氧[5]、LPS[6]均可诱导肺泡上皮细胞的主要组成细胞——肺泡Ⅱ上皮细胞(AT-Ⅱ)的凋亡。英脱利匹特所引起高氧化状态致使氧自由基大量增加和脂质过氧化加重,从而影响细胞黏附,介导细胞凋亡。故本研究发现英脱利匹特组大鼠肺泡上皮细胞凋亡增加。克林诺所含PUFAs较少,脂质过氧化反应小,故可通过减少氧自由基及脂质过氧化物的生成而降低肺泡上皮细胞的凋亡。尤文也能通过抑制氧自由基形成和脂质过氧化来减少细胞凋亡[7]。有文献报道,克林诺和尤文都能通过降低炎性递质而减少肺泡上皮细胞凋亡[8]。在本实验中,英脱利匹特对肺泡上皮细胞的凋亡有促进作用,而克林诺和尤文则能减少细胞凋亡。
以往对脂肪乳的研究多集中于细胞培养方面,本实验是在活体大鼠内进行的,与以往实验相比,对临床工作更有参考价值。今后可进一步研究3种脂肪乳对LPS所致肺损伤的影响,以探讨其对炎性递质的深层调节机制。
1 de Gonzalo-Calvo D,Neitzert K,Fernández M,et al.Differential inflammatory responses in aging and disease:TNF-alpha and IL-6 as possible biomarkers[J].Free Radio Biol Med,2010,49(5):733-737.
2 Hierholzer C,Kalff JC,Omert L,et al.Interleukin-6 production in hemorrhagic shock is accompanied by neutrophil recruitment and lung injury[J].Am J Physiol,1998,275(3 Pt 1):L611-621.
3 黄智云,宋琳.脂多糖体内外诱导年轻和衰老小鼠腹腔巨噬细胞表达IL-6的差异研究[J].国际免疫学杂志,2011,34(6):393-396.
4 Lee JY,Plakidas A,Lee WH.Differential modulation of Toll-like receptors by fatty acids:preferential inhibition by n-3 polyunsaturated fatty acids[J].J Lipid Res,2003,44(3):479-486.
5 Husari AW,Dbaibo GS,Bitar H,et al.Apoptosis and the activity of ceramide,Bax and Bcl-2 in the lungs of neonatal rats exposed to limited and prolonged hyperoxia[J].Respir Res,2006(7):100.
6 宋勇,施毅,Alden HH,等.内毒素诱导小鼠肺泡Ⅱ型上皮细胞凋亡不依赖TNF-α的研究[J].医学研究生学报,2003,16(6):420-423.
7 Li YH,Chen M,Brauner A,et al.Ureaplasma urealyticum induces apoptosis in human lung epithelial cells and macrophages[J].Biol Neonate,2002,82(3):166-173.
8 Glatzle J,Beckert S,Kasparek MS,et al.Olive oil is more potent than fish oil to reduce septic pulmonary dysfunctions in rats[J].Langenbecks Arch Surg,2007,392(3):323-329.
