星形胶质细胞上调基因1和基质金属蛋白酶9在人脑胶质瘤中的表达及其相关性研究
2014-02-08吴建珩李晓辉李培栋
吴建珩,李晓辉,单 峤,李培栋
脑胶质瘤细胞的侵袭性增长包括细胞黏附、运动及细胞外基质(extracellular matrix,ECM)降解等诸多过程,所涉及的分子机制十分复杂。星形胶质细胞上调基因1 (astrocyte elevated gene-1,AEG-1)是2002年用改良的快速减数杂交(rapid subtraction hybridization,RaSH)法首次发现1型人类免疫缺陷病毒(HIV-1)感染后星形胶质细胞中表达增高的新基因,该区域也是与人类脑胶质瘤发生高度相关的地带[1]。近些年研究表明,AEG-1与胃癌、乳腺癌、卵巢癌、前列腺癌等肿瘤的发生发展密切相关,能够促进肿瘤的侵袭和转移[2]。基质金属蛋白酶(matrix metalloproteinase,MMPs)是ECM降解过程中最重要的一类酶,其中MMP-9与脑胶质瘤的侵袭性生长密切相关。目前,国内外对AEG-1和MMP-9在脑胶质瘤中的表达及作用的研究报道较少。本研究通过反转录聚合酶链式反应(RT-PCR)和Western blotting检测AEG-1与MMP-9在不同级别脑胶质瘤组织中的表达情况,分析两者的相关性,并探讨其与脑胶质瘤病理分级的关系。
1 资料与方法
1.1 临床资料 收集2009年5月—2012年6月郑州大学第五附属医院住院的具有明确病理分级的脑胶质瘤标本72例为脑胶质瘤组,患者术前均未行放化疗。按照《2007年WHO中枢神经系统肿瘤组织学分类》[3]标准分级,其中低级别组(Ⅰ~Ⅱ级)32例,男17例、女15例,年龄31~85岁,平均(58.7±5.9)岁;高级别组(Ⅲ~Ⅳ级)40例,男22例、女18例,年龄33~87岁,平均(60.2±6.7)岁。另收集脑创伤行内减压去除的脑组织36例作为对照组。每份标本都分为2份,一份经10%福尔马林固定,另一份取下后立即用液氮冷冻保存。
1.2 RT-PCR 采用Primer premier 6.0软件设计引物,由上海生工生物工程有限公司合成,AEG-1上游引物:5′-GGCAATTGGGTAGACGAAGA-3′,下游引物:5′-TTGAATTTGGAGGGATCTCG-3′,引物长度426 bp;MMP-9上游引物:5′-TTCCCTGGAGACCTGAGAACC-3′,下游引物:5′-CGACACCAAACTGGATGACGC-3′,引物长度:339 bp;β-actin上游引物:5′-AAGGAAGGCTGGAAGAGTGC-3′,下游引物:5′-CTGGGACGACATGGAGAAAA-3′,引物长度:150 bp。应用RT-PCR试剂盒(上海生工生物工程有限公司)按照说明书完成试验。反应产物经1.5%琼脂糖凝胶电泳,应用美国Eagle EyeⅡ型凝胶图像软件测定目的基因的吸光度值。
1.3 Western blotting 裂解组织提取蛋白,BCA法进行蛋白定量。AEG-1、MMP-9蛋白分别于10%、7%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转至聚偏氟乙烯(PVDF)膜上,5%的脱脂牛奶室温封闭1 h,分别加入一抗(Santa公司)兔抗人AEG-1和MMP-9抗体(均为1∶500)孵育,4 ℃过夜。洗膜后分别加入辣根过氧化物酶标记的羊抗兔二抗(1∶2 000,Santa公司),室温孵育1 h,增强化学发光法(ECL)转至X光胶片。采用美国Eagle EyeⅡ型凝胶图像分析系统测定目标蛋白和标准对照的吸光度,取两者比值作为目标蛋白半定量相对值。
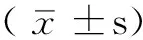
2 结果
2.1 AEG-1的表达 与对照组比较,低级别组和高级别组AEG-1 mRNA及蛋白表达水平上调,差异有统计学意义(P<0.05);与低级别组比较,高级别组AEG-1 mRNA及蛋白表达水平上调,差异有统计学意义(P<0.05,见表1、图1和图2)。
2.2 MMP-9的表达 与对照组比较,低级别组和高级别组MMP-9 mRNA及蛋白表达水平上调,差异有统计学意义(P<0.05);与低级别组比较,高级别组MMP-9 mRNA及蛋白表达水平上调,差异有统计学意义(P<0.05,见表2、图3和图4)。

Table1 Comparison of mRNA and protein expression levels of AEG-1 between human glioma group and control group

组别例数AEG-1/β-actinmRNAAEG-1/β-actin蛋白对照组360.204±0.078 0.309±0.074 低级别组320.523±0.116* 0.556±0.108* 高级别组400.817±0.142*△0.790±0.155*△F值67.82542.013P值 0.000 0.000
注:AEG-1=星形胶质细胞上调基因1;与对照组比较,*P<0.05;与低级别组比较,△P<0.05
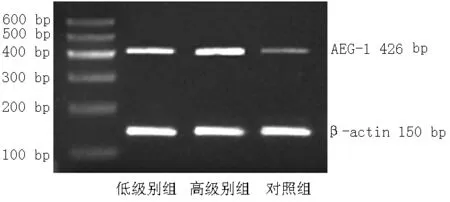
注:AEG-1=星形胶质细胞上调基因1
图1 RT-PCR检测AEG-1 mRNA表达水平
Figure1 The expression level of AEG-1 mRNA detected by RT-PCR
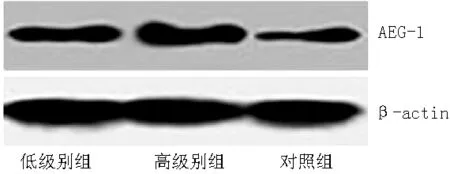
图2 Western blotting检测AEG-1蛋白表达水平
Figure2 The expression level of AEG-1 protein detected by Western blotting
Table2 脑胶质瘤组与对照组MMP-9 mRNA及蛋白表达水平比较

Table2 Comparison of mRNA and protein expression levels of MMP-9 between human glioma group and control group
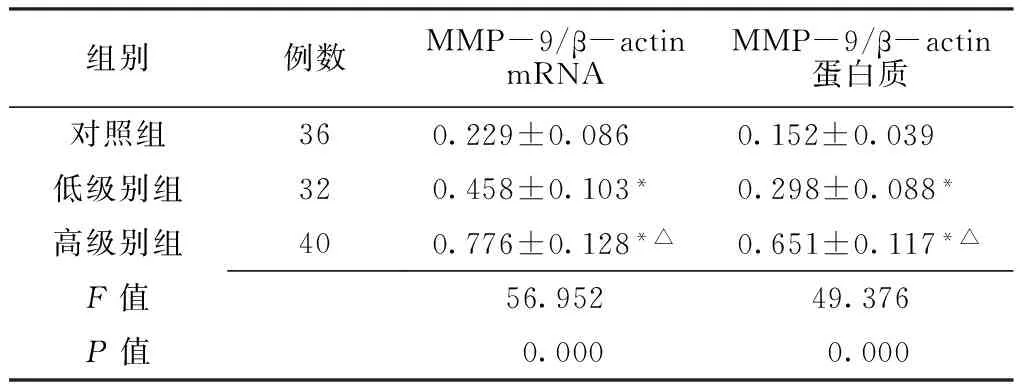
组别例数MMP-9/β-actinmRNAMMP-9/β-actin蛋白质对照组360.229±0.086 0.152±0.039 低级别组320.458±0.103* 0.298±0.088* 高级别组400.776±0.128*△0.651±0.117*△F值56.95249.376P值 0.000 0.000
注:MMP-9=基质金属蛋白酶9;与对照组比较,*P<0.05;与低级别组比较,△P<0.05
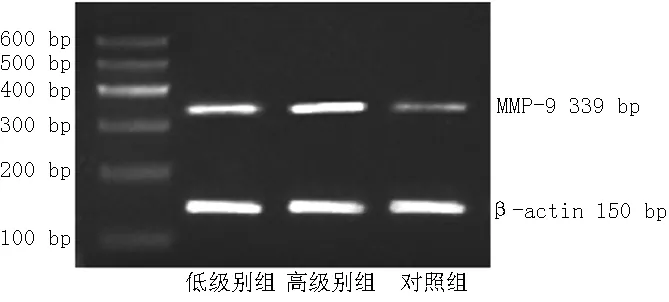
注:MMP-9=基质金属蛋白酶9
图3 RT-PCR检测MMP-9 mRNA表达水平
Figure3 The expression level of MMP-9 mRNA detected by RT-PCR
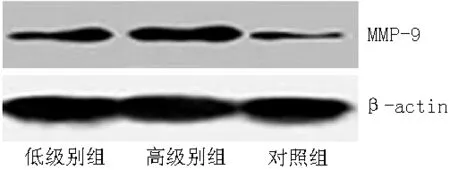
图4 Western blotting检测MMP-9蛋白表达水平
Figure4 The expression level of MMP-9 protein detected by Western blotting
2.3 MMP-9与AEG-1表达的相关性 Spearman相关分析显示,MMP-9与AEG-1表达呈正相关(r=0.693,P<0.01,见图5)。
3 讨论
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,其发生是相关基因共同参与、相互作用的结果。AEG-1是近年发现的新基因,位于8q22,由12个外显子和11个内含子组成,其编码蛋白的异常表达可以通过多种信号途径调节细胞的致癌性转化,提高肿瘤细胞的增殖和抗凋亡能力,增加肿瘤细胞的侵袭和转移,加速肿瘤新生血管生成[4]。Jeon等[5]于2009 年进一步证实AEG-1是一种新的癌基因。本研究发现,无论在基因水平还是蛋白水平,脑胶质瘤内AEG-1的表达均高于对照组,
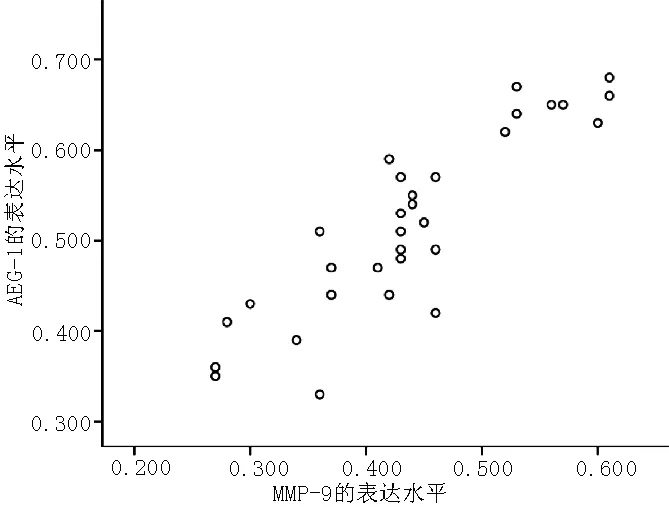
图5 MMP-9与AEG-1表达水平的相关性
这与Yang等[6]的研究结果一致,提示AEG-1在脑胶质瘤的发生过程中起重要作用。本研究结果还显示,AEG-1基因和蛋白在高级别脑胶质瘤中的表达高于在低级别脑胶质瘤中的表达。可见,脑胶质瘤的恶性程度越高,AEG-1表达就越高,提示AEG-1在脑胶质瘤的进展过程中起重要的促进作用。AEG-1可激活PI3K/Akt信号通路,调节PI3K/Akt信号通路的下游基因P53、FOXO1、FOXO3a、AP-1等转录因子的表达,从而介导脑胶质瘤细胞的异常增殖和抗凋亡能力。此外,Lee等[7]研究表明,AEG-1激活PI3K/Akt信号途径还可以诱导转录因子——低氧诱导因子1(HIF1)的表达,后者能够增加血管内皮生长因子(VEGF)的转录水平,从而导致脑胶质瘤内血管生成增多。Emdad等[8]发现RNA干扰(RNAi)沉默AEG-1基因后能够降低脑胶质瘤细胞的侵袭和转移能力。虽然AEG-1促进脑胶质瘤生长、侵袭及转移的具体机制尚不明了,但AEG-1仍可作为一项有意义的评估脑胶质瘤恶性程度的指标。
MMPs是一类Zn2+依赖性蛋白酶,与肿瘤的浸润和转移密切相关,MMP-9是MMPs中分子量最大且最重要的酶,可以降解ECM中的多种蛋白成分,能够破坏防止肿瘤细胞侵袭的组织学屏障,从而造成肿瘤细胞的侵袭和转移[9-10]。本研究发现MMP-9 mRNA及蛋白在脑胶质瘤中的表达显著高于在正常脑组织中的表达,而且MMP-9在高级别级脑胶质瘤中的表达显著高于在低级别脑胶质瘤中的表达,这与Ponnala等[11]的研究结果一致。在脑胶质瘤发生发展过程中,MMP-9通过降解脑胶质瘤ECM为肿瘤向正常脑组织侵袭提供通路和空间,对脑胶质瘤的侵袭性生长具有重要意义。研究发现,具有侵袭能力的脑胶质瘤细胞能够分泌大量的MMP-9,同时其侵袭力与MMP-9的表达水平密切相关[12]。
本研究发现,MMP-9在脑胶质瘤中的表达与AEG-1的表达呈正相关,说明AEG-1能够通过调控MMP-9的表达而促进脑胶质瘤细胞的增殖和转移。Liu等[13]研究表明,AEG-1能够通过增强MMP-9的表达而促进脑胶质瘤的侵袭和进展。最近研究表明,采用RNAi技术下调脑胶质瘤中AEG-1 mRNA的表达后,MMP-9的表达也显著下调[14]。AEG-1能够激活核因子кB(NF-кB)分子通路,而MMP-9是NF-кB的下游基因,其表达受NF-кB的调控,由此推测,AEG-1可能通过NF-кB信号通路调控MMP-9的表达。这些研究结果提示两者具有协同促进脑胶质瘤侵袭的作用,从而为进一步阐明二者在脑胶质瘤中的相互调控关系提供了可靠的理论依据。
总之,AEG-1和MMP-9参与了脑胶质瘤的增殖和侵袭,脑胶质瘤的病理分级越高,恶性程度越高,AEG-1和MMP-9的表达就越高,且二者的表达具有相关性。AEG-1和MMP-9协同促进脑胶质瘤的增殖和侵袭,但二者在脑胶质瘤中具体相互作用机制尚待进一步研究,这将是下一阶段研究的重点。本研究丰富了人们对脑胶质瘤基因治疗的探索,为脑胶质瘤的分子治疗提供了新的靶点和理论基础。
1 Yoo BK,Emdad L,Lee SG,et al.Astrocyte elevated gene-1(AEG-1):A multifunctional regulator of normal and abnormal physiology[J].Pharmacology & Therapeutics,2011,130(1):1-8.
2 Gnosa S,Shen YM,Wang CJ,et al.Expression of AEG-1 mRNA and protein in colorectal cancer patients and colon cancer cell lines[J].J Transl Med,2012,11(10):105-109.
3 Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathologica,2007,114(2):97-109.
4 Srivastava J,Siddiq A,Emdad L,et al.Astrocyte elevated gene-1 promotes hepatocarcinogenesis:novel insights from a mouse model[J].Hepatology,2012,56(5):1782-1791.
5 Jeon HY,Choi M,Howlett EL,et al.Expression patterns of astrocyte elevated gene-1(AEG-1) during development of the mouse embryo[J].Gene Expression Patterns,2010,10(7/8):361-367.
6 Yang Y,Wu J,Guan H,et al.MiR-136 promotes apoptosis of glioma cells by targeting AEG-1 and Bcl-2[J].FEBS Letters,2012,586(20):3608-3612.
7 Lee SG,Kim K,Kegelman TP,et al.Oncogene AEG-1 promotes glioma-induced neurodegeneration by increasing glutamate excitotoxicity[J].Cancer Research,2011,71(20):6514-6523.
8 Emdad L,Sarkar D,Lee SG,et al.Astrocyte elevated gene-1:a novel target for human glioma therapy[J].Mol Cancer Ther,2010,9(1):79-88.
9 马顺茂,贾漪涛,刘红磊,等.基质金属蛋白酶7及基质金属蛋白酶9的表达与结直肠癌侵袭转移的相关性研究[J].中国全科医学,2011,14(4):1324.
10 周少飞,毛伟征,苗蕾,等.基质金属蛋白酶9及其抑制剂与甲状腺乳头状癌的关系[J].疑难病杂志,2012,11(9):676.
11 Ponnala S,Chetty C,Veeravalli KK,et al.MMP-9 silencing regulates hTERT expression via β1 integrin-mediated FAK signaling and induces senescence in glioma xenograft cells[J].Cellular Signalling,2011,23(12):2065-2075.
12 Asuthkar S,Velpula KK,Chetty C,et al.Epigenetic regulation of miRNA-211 by MMP-9 governs glioma cell apoptosis chemosensitivity and radiosensitivity [J].Oncotarget,2012,3(11):1439-1454.
13 Liu L,Wu J,Ying Z,et al.Astrocyte elevated gene-1 upregulates matrix metalloproteinase-9 and induces human glioma invasion[J].Cancer Research,2010,70(9):3750-3759.
14 刘海燕,张新颖,王立俊,等.siRNA下调AEG-1表达对神经母细胞瘤细胞MMP-9的表达及侵袭能力的影响[J].中华小儿外科杂志,2011,32(6):456-460.
