高脂饲养结合腹主动脉球囊损伤制作兔腹主动脉粥样硬化模型的研究*
2014-02-08岳增辉胡岗珠
杨 俊 岳增辉 谢 涛 胡岗珠
(湖南中医药大学,湖南 长沙 410000)
兔是食草动物,对高脂饲料敏感,是较易建立动脉粥样硬化的动物之一。此模型特点是复制简单、建模时间短、成活率高、损伤条件可控性好、易于评判,适用于预防治疗等研究。本课题组曾采用高脂加免疫损伤的方法造模,但存在造模周期长、兔死亡率较高的缺点[1-2]。现在多采用高脂喂养结合球囊损伤术建立腹主动脉粥样硬化(AS)模型的方法,比之于以前的高脂结合免疫损伤的方法缩短了造模时间,且造模成功率更高、更稳定,但还是存在动物死亡率较高的问题[3]。为缩短造模时间及降低死亡率,本实验采用高脂喂养结合球囊损伤的方法,但调整了高脂饲料的配方,同时更加注重实验兔的饮食、卫生及术后感染预防,以此缩短造模时间及控制死亡率,为研究AS提供最佳的实验模型。现报告如下。
1 材料与方法
1.1 试剂与仪器 TGL16M台式高速冷冻离心机(长沙科威实业有限公司);全自动生化分析仪Roche Hitachi917型(日本日立公司);瑞典产LKB-Ш型超薄切片机;LEICADM LB2型双目显微镜 (德国LEICA公司)等;球囊导管与附件(2.5~3.0 mm×20 mm普通球囊导管,美国Cordis公司;0.018/300 cm导引导丝,美国Cordis公司;球囊扩张压力泵,美国Cordis公司);胆固醇(sigma公司);蛋黄粉(安徽亳州市众意蛋业有限责任公司);猪油(市售)。
1.2 实验动物 雄性新西兰大耳白兔(普通级)20只,体质量1.5~2.0 kg,月龄2~3个月,由长沙市天勤生物技术有限公司提供 [许可证号:SCXK (湘)2009-0012]。20只兔全部采用高脂喂养加球囊损伤法造模,喂含2%胆固醇、15%蛋黄粉、0.5%胆酸钠和5%猪油的颗粒饲料,每次50 g,每日早晚2次。普通饲养1周、高脂喂养2周后实施腹主动脉球囊损伤术,术后继续高脂饲料喂养。所有动物均单笼喂饲,饮水不限,自由摄食,每日每只进食120 g饲料,术后喂养8周。每只分笼圈养于动物中心实验室。于第10周末处死前颈静脉采血,取损伤段腹主动脉固定、切片、HE染色。
1.3 球囊损伤腹主动脉内膜的方法 实验兔术前12 h禁食,不禁水。手术器械术前消毒30 min,称体质量,3%戊巴比妥钠(1 mL/kg)耳缘静脉麻醉。出现呼吸深慢、四肢瘫软、角膜反射迟钝标志麻醉成功。球囊损伤方法:麻醉后经耳缘静脉注射肝素钠200 U/kg,固定,将兔右侧大腿内侧毛发剪去。常规消毒皮肤,铺巾。在股动脉搏动明显处沿右股动脉走行方向纵行逐层切开皮肤,钝性分离肌肉,暴露股动静脉并游离股动脉约2~3 cm。将股动脉近心端穿线提起,远心端结扎。用剪刀斜向将股动脉剪一小口,送入软头导丝,沿导丝导入球囊导管深度约20 cm。向球囊内注入肝素,保持压力为6~8标准大气压(atm),抗阻力牵拉球囊至髂动脉,抽空球囊。重复上述过程2次后退出导管,结扎股动脉,逐层缝合,碘伏擦拭创口。视出血量补充生理盐水。术后连续3 d肌注青霉素40 U并用碘伏擦拭伤口预防感染。放回兔笼,自行苏醒。
1.4 标本采集与检测 高脂喂养10周,经兔耳缘静脉麻醉后取颈静脉血离心,取血清进行血脂检测。解剖实验动物,根据球囊损伤术中球囊导管进入的深度及损伤长度,截取损伤段腹主动脉约1.5~2.0 cm,用生理盐水稍冲洗后以4%多聚甲醛保存,用于拍照和HE染色,光镜观察。
1.5 统计学处理 应用SPSS17.0统计软件。计量资料以表示,采用t检验。 P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 部分兔因用笼具喂养时间长出现足癣,用10 g/L克霉唑液进行局部喷洒并定期消毒笼具后消失。无实验兔出现腹泻情况,2只兔麻醉意外死亡,3只死于术后感染。
2.2 造模前后体质量变化 兔实验的体质量(2.10±0.12) kg,造模 10 周后为(2.90±0.35) kg,有明显增加(P<0.05)。
2.3 造模前后血脂水平变化 见表1。血脂检测结果示,造模后TC、TG、LDL显著升高,HDL显著降低(P<0.05或 P< 0.01)。
表1 造模前后兔的血脂情况(mmol/L

表1 造模前后兔的血脂情况(mmol/L
与造模前比较,△P<0.05,△△P<0.01。
?
2.4 病理形态学结果 (1)肉眼观察。见图1。造模前兔主动脉形态正常,活体状态下柔软而有弹性,取材后见管腔内膜光滑且管腔壁较薄,颜色粉红均匀,未见脂质沉积。造模后家兔主动脉管腔壁增厚,可见突起于内膜表面的散在、大片、大小不等的黄白色脂质条纹及隆起的脂质斑块形成;解剖见肝脏明显脂肪肝改变。(2)光镜观察。见图2。造模前可见主动脉内膜完整,内皮细胞单层紧贴内弹力板,中层平滑肌细胞排列有序,内膜无淋巴细胞、泡沫细胞聚集;弹力纤维无断裂及溶解现象,无增生现象;胞浆呈嗜酸红染,无明显脂质沉积。造模后可见主动脉内皮细胞脱落,斑块厚度与内中膜厚度比值显著增加,内膜下可见大量泡沫细胞和淋巴细胞聚集,呈圆形或长形,可见“纤维帽”现象,斑块中可见新生血管;中层平滑细胞排列紊乱,弹力纤维断裂、溶解,斑块向管腔凸出,胶原增生。
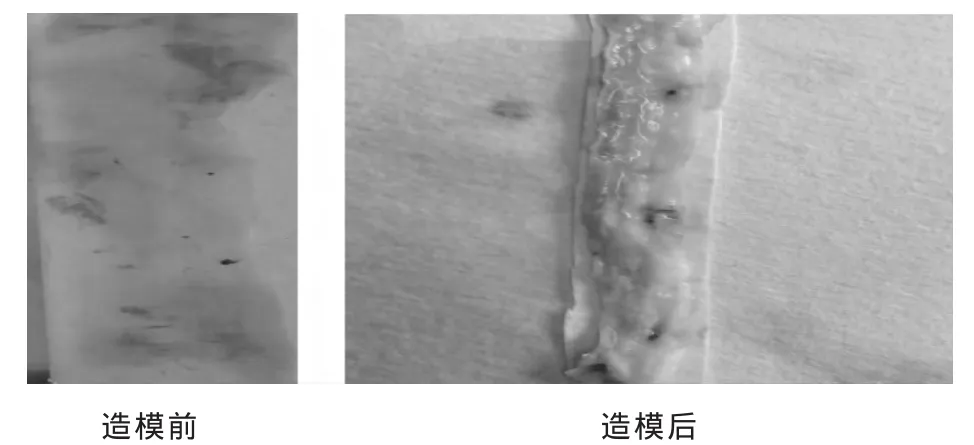
图1 肉眼观察

图2 光镜观察
3 讨 论
目前有研究表明,制作AS模型较为理想的动物当属小型猪[4],但存在来源困难、饲料昂贵等缺点,而家兔来源广泛、饲料便宜,形成的斑块与人类相似性也较高,是AS的易感动物,因此常选兔作为AS的模型[5]。 内皮损伤是 AS 形成的基础[6],脂质沉积是粥样硬化病变的基本表现[7]。所以,在复制粥样硬化动物模型时应在损伤内皮的基础上高脂喂养。故笔者采用腹主动脉球囊损伤加高脂喂养的方法制作AS模型。此方法的优点是操作简单、死亡率低、损伤较小,且所制作的模型与人类接近,易于确定病变部位,方便取材。
本模型制作与业者[3]造模比较,明显缩短了造模时间(2周),且未出现实验兔因腹泻而死亡的情况,成功降低了死亡率。分析主要原因是:(1)加大了高脂饲料中胆固醇、蛋黄粉、猪油的比例;(2)动物房环境潮湿,定期对动物房及笼具进行清洗、消毒,可避免因感染导致腹泻而死亡;(3)术后在青霉素抗感染的同时每日擦拭碘伏,控制术后伤口感染。
[1] 岳增辉,何新群,常小荣,等.隔药饼灸对动脉粥样硬化兔血脂的调节作用[J].中国中医药现代远程教育,2011,9(5):47-48.
[2] 何新群,岳增辉,常小荣,等.动脉粥样硬化兔模型的建立及评价[J].湖南中医药大学学报,2010,30(9):27-29.
[3] 吴同启,顾宁.宁心痛颗粒干预模型兔动脉粥样硬化易损斑块机制研究[J].中华中医药杂志,2011,26(5):1042-1046.
[4] 刘录山,杨永宗,冯大明,等.小型猪动脉粥样硬化斑块稳定性模型研究[J].生物化学与生物物理进展,2006,33(2):196-200.
[5] Rafael A,Nalkov,Donald C,et al.Carbohydrate and lipid metabolismin farmanimals[J].The Journal of Nutrition,2007,137(3):702-705.
[6] 周晓峰,王佐.内皮祖细胞在动脉粥样硬化进程中的作用[J].中国动脉硬化杂志,2007,15(12):940-942.
[7] 张运.动脉粥样硬化研究的当前问题[J].中华心血管病杂志,2011,39(9):785-788.
[8] 常小荣,严洁,岳增辉,等.隔药饼灸对高脂血症兔高低密度脂蛋白含量及比值的影响[J].中国中医药信息杂志,2004,11(12):1054-1055.
