20(S)-原人参二醇诱导U87细胞凋亡的机理研究*
2014-02-06南一楠李澎涛
南一楠 李 娇 李澎涛 华 茜△
(1.北京中医药大学基础医学院,北京 100029;2.北京中医药大学东直门医院,北京 100700)
脑恶性胶质瘤是中枢神经系统中常见的原发性肿瘤,约占原发性中枢神经系统肿瘤的40%~53%[1]。原人参二醇(PPD)是存在于人参和三七中的达玛烷型四环萜烯皂角苷[2-3]。 20(S)-原人参二醇(aPPD)是人参皂苷经过胃肠道菌群去糖代谢活化后产生的活性成分,具有广谱抗肿瘤作用。本研究观察aPPD对人胶质瘤细胞U87的抑制杀伤作用,探寻其作用机制。现报告如下。
1 材料与方法
1.1 细胞培养 人脑胶质瘤细胞U87购置于ATCC,培养在含有 10%胎牛血清(FBS,Gibco,NY)的 DMEM(Sigma)中,并加入青霉素和链霉素(Gibco-BRL,NY)防治细菌感染。于5%CO2培养箱内培养,温度为37℃。细胞达到80%密度时传代,约3~4 d传1代,40代之前的细胞用于实验。
1.2 药物与试剂 原人参二醇受赠于Pegasus制药公司(Vancouver,BC),存储液用纯乙醇配制,浓度为80mmol/L,于4℃避光保存。使用时溶解于完全培养基内,配制成所需终浓度。一抗anti-pro-caspase3(ab cam,ab47131,US)和 anti-PARP (Proteintech,13371-1-AP,US)均按 1∶1000稀释, 溶解于 3%BSA的TBST中,4℃孵育过夜。
1.3 细胞活力检测(MTS法) U87细胞接种于96孔板上,接种密度为每孔 2.5×104个,100 μL 每孔。 接种24 h后吸去培养基,重新添加新的含药培养基。作用指定时间后,向每孔中加入20μLCellTiter 96 AQueous One Solution Reagent(Promega),于 5%CO2,37 ℃培养箱中孵育1~4 h,之后于490 nm处测量吸光度值,数值越大说明细胞活力越强。
1.4 蛋白提取与免疫印迹 药物作用到指定药物作用时间后,吸去培养基,用预冷的PBS轻轻清洗细胞表面1次,之后加入上样缓冲液 [62.5mmol/L Tris-HCl,2%SDS,10%甘油,50mmol/LDTT,0.01%(w/v)溴酚蓝],用细胞刮轻轻将裂解产物刮下,转入离心管内99℃加热5min,之后离心,待蛋白冷却后即可上样。等量的蛋白上样于SDS-PAGE胶上,待蛋白根据分子量大小分离开后进行转膜 (BIO-RAD),采用NC膜,100 V转1.5 h后将膜取出,于5%脱脂牛奶中封闭1 h后加入一抗4℃孵育过夜。次日吸走一抗,将膜用TBST洗3遍,每遍15min。之后选择相应二抗进行孵育,室温在摇床上孵育1 h,同样用TBST清洗3遍,15 min每次。采用 ECL显影液 (Perkin-Elmer Life Sciences,Boston,MA)进行检测,拍摄图像后用 Image J进行分析。
1.5 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,采用 One-way ANOVA 比较。 P<0.05为差异有统计学意义。
2 结 果
2.1 MTS法检测结果 见表1。用不同浓度的aPPD处理U87细胞,24 h后用MTS法检测细胞活力,结果发现10μmol/L浓度的aPPD即对U87细胞有显著的抑制作用,且随aPPD浓度升高抑制作用愈明显(P<0.05或 P<0.01)。
表1 不同浓度aPPD作用U87细胞24h后的MTS测定结果(±s)

表1 不同浓度aPPD作用U87细胞24h后的MTS测定结果(±s)
与对照组比较,*P<0.05,**P<0.01。 下同。
aPPD剂量 n 0μmol/L(对照组) 3 10μmol/L 3 20μmol/L 3吸光度值2.32±0.12 1.84±0.08**1.47±0.06**40 μmol/L 3 1.04±0.07**60 μmol/L 3 1.05±0.16**80 μmol/L 3 0.72±0.10**
2.2 免疫印迹检测结果 不同浓度的aPPD作用于U87细胞后8 h,免疫印迹结果显示pro-caspase3随aPPD浓度升高呈逐渐减少趋势 (图1)。利用Image J进行定量分析其条带光密度与β-actin的比值,结果可知40μmol/L以上浓度的aPPD会使pro-caspase3含量明显下降(表2)。免疫印迹结果也发现PARP有切割条带的产生(图2),说明当U87收到aPPD作用时,其细胞内部的caspase3被激活。

图1 不同浓度aPPD作用于U87细胞8h后pro-caspase3的变化
3 讨 论
大量研究发现,PPD及其衍生物对多种肿瘤细胞具有杀伤性,并且对正常组织细胞无害[4-6]。aPPD对肝癌、肺癌以及黑色素瘤细胞具有明显的生长抑制和杀伤作用[7],并且能够诱导骨髓瘤细胞的凋亡,治疗白血病[8]。
表2 aPPD作用于U87细胞8 h后pro-caspase3的变化情况(±s)

表2 aPPD作用于U87细胞8 h后pro-caspase3的变化情况(±s)
aPPD剂量 n 0μmol/L(对照组) 3 10μmol/L 3 20μmol/L 3 pro-caspase3/actin 1.00±0.00 0.95±0.13 0.90±0.10 40 μmol/L 3 0.74±0.12*60 μmol/L 3 0.64±0.17**80 μmol/L 3 0.51±0.04**
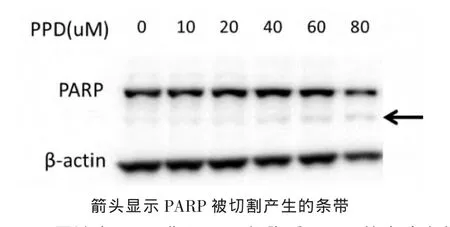
图2 不同浓度aPPD作用U87细胞后PARP的表达变化
关于其机制研究也广泛展开,一项在体研究表明,20(S)-PPD对肝癌大鼠模型具有显著疗效,能够抑制肿瘤内部新生血管形成,降低微血管密度,并促进其凋亡[9],其分子机制可能与抑制肿瘤组织血管内皮生长因子的表达有关[10];另一方面,它还能提高小鼠特异性和非特异性免疫功能[11]。有研究表明,Rh2的作用机制主要为 caspase 家族的激活[6,12],Rh2 还与活性氧生成和 p21 活力有关[13-14]。
20(S)-PPD具有与Rh2相似的化学结构,其杀伤肿瘤的作用机制尚未完全明确,因此笔者猜想其也有可能与caspase3的激活有关。caspase家族是一类存在于细胞内的半胱氨酸蛋白酶,可以切割肽链上天冬氨酸之后的肽键,具有高度的特异性[15]。它们广泛参与细胞凋亡的各个过程,因此越来越多地在肿瘤治疗领域受到关注。包含凋亡起始者(caspase2、8、10)和凋亡执行者(caspase3、6、7),caspase3 和 caspase7 具有相似的底物[16],会降解 PARP、DFF-45 等,导致 DNA 修复抑制以及降解,进而导致细胞凋亡[17]。
细胞活力实验结果显示,aPPD对胶质瘤细胞具有较好的杀伤作用,免疫印迹结果证明caspase3前体随aPPD浓度增高而减少,具有明显的相关性。而caspase3常见的底物PARP也被切割,说明U87细胞内caspase3被aPPD诱导激活,从而进入凋亡状态。
本研究发现aPPD诱导U87细胞凋亡的途径可能与caspase3的激活有关,然而天然提取物往往具有多靶点、多通道的作用机制,aPPD是否还具有其他杀伤肿瘤细胞的作用途径,其如何激活caspase3等问题,尚待进一步深入研究。
[1] 陈志刚,卢亦成,丁学华,等.恶性胶质瘤化疗新进展[J].中华神经外科杂志,2003,19(1):70-72.
[2] Shibata S,Tanaka O,Sado M,etal.The genuine sapogenin of ginseng[J].Tetrahedron Letters,1963,4(12):795-800.
[3] Tanaka O,Nagai M,Shibata, S.Stereochemistry of protopanaxadiol,a genuine sapogenin ofginseng[J].Tetrahedron Letters,1964,5(33-34):2291-2297.
[4] JiaWWG,Bu X,Philips D,etal.Rh2,a compound extracted from ginseng,hypersensitizes multidrug-resistant tumor cells to chemotherapy[J].Canadian journalofphysiology and pharmacology,2004,82(7):431-437.
[5] Kim YS,Jin.Ginsenoside Rh2 induces apoptosis independently ofBcl-2, Bcl-xL or Bax in C6Bu-1 cells[J].Archives ofpharmacal research, 1999,22(5): 448-453.
[6] FeiXF,Wang, etal.(2002).Apoptotic effectsofginsenoside Rh2 on humanmalignantmelanoma A375-S2 cells[J].Acta Pharmacologica Sinica,2002,23(4):315-322.
[7] 辛颖,倪劲松,王心蕊,等.20(S)-人参皂苷 Rg3抗 B16黑色素瘤转移的作用[J].吉林大学学报:医学版,2004,30(4):540-543.
[8] Tanious FA,LaineW,Peixoto P,etal.Unusually strong binding to the DNA minor groove by a highly twisted benzimidazole diphenylether:induced fitand bound water[J].Biochemistry,2007,46(23):6944-6956.
[9] 秦俊杰,杨艳秋,李颖新,等.20(S)2原人参二醇对肝癌间质血管密度和肿瘤细胞增殖活性的影响[J].临床肝胆病杂志,2006,22(4):260-261.
[10]张国成,秦俊杰,冷吉燕.20(S)2原人参二醇抑制肝癌血管内皮生长因子及其基因的表达[J].中国老年学杂志,2006,26(7):945-946.
[11]王庭富,孟正木.人参皂苷Rg3对免疫功能的影响[J].中国医科大学学报,1999,30(2):133-135.
[12] Park J.Activation of caspase-3 protease via a Bcl-2-insensitive pathway during the process of ginsenoside Rh2-induced apoptosis[J].Cancer Letters,1997,121(1):73-81.
[13] Kim HE.Ginsenoside RH-2 induces apoptotic cell death in rat C6 glioma via a reactive oxygen-and caspase-dependent but Bcl-X<sub>L</sub>-independentpathway[J].Life sciences,1999,65(3):33-40.
[14] Oh M.Anti-proliferating effects ofginsenoside Rh2 on MCF-7 human breast cancer cells[J].International journal of oncology,1999,14(5):869.
[15] Fan, TJ, Han.Caspase family proteases and apoptosis[J].Acta biochimica etbiophysica Sinica,2005, 37 (11): 719-727.
[16] Talanian RV,Quinlan.Substrate specificitiesof caspase family proteases[J].Journal of Biological Chemistry,1997,272(15):9677-9682.
[17] Porter AG,Jnicke RU.Emerging roles of caspase-3 in apoptosis[J].Celldeath and differentiation,1999,6(2):99.
