骨髓间充质干细胞对Ⅰ型糖尿病大鼠淋巴细胞增殖的调节作用
2014-02-05郑贵星李翊泉魏小平广州医科大学附属第一医院输血科广州510120
郑贵星 李翊泉 魏小平 吴 颉 黄 俊 (广州医科大学附属第一医院输血科,广州510120)
骨髓间充质干细胞对Ⅰ型糖尿病大鼠淋巴细胞增殖的调节作用
郑贵星 李翊泉 魏小平①吴 颉①黄 俊②(广州医科大学附属第一医院输血科,广州510120)
目的:探讨骨髓间充质干细胞抑制Ⅰ型糖尿病大鼠淋巴细胞增殖的免疫调节相关机制。方法:分离、培养并鉴定大鼠的骨髓间充质干细胞,采用MTT法观察其对Ⅰ型糖尿病大鼠淋巴细胞增殖能力的影响,采用流式细胞仪分析骨髓间充质干细胞对Ⅰ型糖尿病大鼠CD4+CD25+调节性T细胞比例、细胞周期和细胞凋亡的影响。结果:B组和C组的吸光度值明显低于A组,数据之间比较差异均有统计学意义(P<0.05),C组吸光度值明显低于B组,数据之间比较差异有统计学意义(P<0.05);B组和C组的CD4+CD25+调节性T细胞比例均明显高于A组,数据比较差异均有统计学意义(P<0.05),C组CD4+CD25+调节性T细胞比例明显高于B组,数据比较差异有统计学意义(P<0.05);B组和C组的细胞凋亡水平明显高于A组,数据比较差异有统计学意义(P<0.05),C组细胞凋亡水平明显高于B组,数据比较差异有统计学意义(P<0.05)。结论:骨髓间充质干细胞可以显著抑制Ⅰ型糖尿病大鼠淋巴细胞增殖,其机制可能通过调节CD4+CD25+调节性T细胞比例,促进细胞凋亡,继而影响T淋巴细胞的免疫功能,发挥其抑制能力。
骨髓间充质干细胞;Ⅰ型糖尿病;大鼠;淋巴细胞
Ⅰ型糖尿病属于特异性自身免疫病,该疾病的发生是通过一种尚不完全清楚的机制介导T淋巴细胞调节发生破坏胰岛素β细胞的过程[1]。骨髓间充质干细胞可参与T淋巴细胞的调节,并通过多种免疫抑制介质参与炎性反应的控制过程[2]。此外,最新的研究表明骨髓间充质干细胞可降低糖尿病动物的血糖水平,但其具体机制尚不明确[3]。CD4+CD25+调节性T细胞是骨髓间充质干细胞的免疫调节的效应细胞也得到了证实。因此,其之间是否存在某种联系,值得深思。为了探讨骨髓间充质干细胞抑制Ⅰ型糖尿病大鼠淋巴细胞增殖的免疫调节相关机制以及可能途径,我们采取一系列的技术研究,取得一定成果,现将相关内容报道如下。
1 材料与方法
1.1 材料、试剂和仪器 本研究采用SD大鼠,共20只,年龄2~8周龄,购买于湖南中医药大学实验动物中心,所需的各种培养基、链脲佐菌素、丝裂霉素以及胎牛血清等购买于美国Sigma公司,淋巴细胞分离液由上海義森生物科技有限公司提供。FACS Calibur流式细胞仪为BD公司生产,血糖仪购自三诺生物传感技术股份有限公司。1.2 实验方法
1.2.1 Ⅰ型糖尿病大鼠模型的建立 (1)选取10只体重为300g左右的SD大鼠,于标准SPF级别饲养环境饲养7 d后开始制作Ⅰ型糖尿病大鼠模型。(2)模型建立前,SD大鼠禁食6个小时,并采集鼠尾静脉血一滴,测量SD大鼠血糖浓度,按照体重预先配制好链脲佐菌素溶液。(3)按每千克50 mg的标准,在SD大鼠腹腔注射10 g/L的链脲佐菌素,1次/d,连续注射5 d。(4)SD大鼠给予正常饮食,每周检查一次SD大鼠的空腹静脉血血糖水平。当大鼠出现I型糖尿病相关症状,包括多饮多食,体重下降等症状,并且血糖水平连续4周超过1.4 mmol/L时确定建模成功[4]。所有实验动物均参照美国糖尿病并发症动物模型协会相关标准进行饲养。
1.2.2 细胞培养方法 (1)选取约2周龄的健康SD大鼠,脱颈处死后于75%酒精浸泡消毒约10 min后。(2)于超净工作台取出股骨和胫骨,置于含有PBS的培养皿中,剪断股骨和胫骨两端,并使用含有10%FBS的DMEM培养液冲洗骨髓腔。(3)将所得液体离心收集细胞,用无菌吸管反复吹打,并去除杂质,制成细胞悬液。(4)将细胞悬液移入无菌离心管中,4℃,1 000 r/min离心 5 min,去除上清液,在离心管内加入含有胎牛血清的 DMEM培养液,混匀。(5)调整细胞浓度,接种于含抗生素的DMEM培养基中,置于37℃培养箱内进行培养。(6)每隔3 d换液一次。当细胞生长至约80%融合后,用相应浓度的胰蛋白酶消化传代,取第三代骨髓间充质干细胞用于实验。
选取上述Ⅰ型糖尿病大鼠,脱颈处死,75%酒精消毒10 min后,无菌条件下取出脾脏,置于含有5 ml的淋巴细胞分离液的培养皿中,研磨充分,转移分离液于离心管内,加入1640培养基约400 μl,室温下3 000 r/min离心30 min。并按照实验淋巴细胞分离液操作说明书分离获得淋巴细胞,DMEM培养基洗涤后,调整细胞浓度约为 1×108个/ml,备用。
1.2.3 组别设置 取生长良好的第三代骨髓间充质干细胞,使用丝裂霉素C(终止细胞分裂能力)处理1 h后,弃上清,并使用DMEM培养基洗涤3次,胰蛋白酶消化细胞,分别制成1×106和1×107两组不同浓度的细胞悬液,然后按每孔100 μl的体积加入到24孔板中,并根据分组加入不同数量的淋巴细胞,以培养液补足体系。本研究根据骨髓间充质干细胞和淋巴细胞的比例分为3组,分别为A组(空白对照组,不加骨髓间充质细胞)、B组(淋巴细胞∶骨髓间充质干细胞=1∶0.1)和C组(淋巴细胞∶骨髓间充质干细胞=1∶1)。每组各设5个复孔,培养3 d后进行实验,共进行5次实验。
1.2.4 检测方法 培养结束前6 h,向培养孔内加入20 μl的5 g/L的MTT,培养结束后,吸取悬浮的细胞,离心,分离并重悬细胞,每孔加100 μl二甲基亚砜,震荡溶解结晶,酶标仪检测波长490 nm的吸光度值。以吸光度A值为纵坐标,各组为横坐标,绘制淋巴细胞增殖能力柱形图。
收集上清液至流式管中,每组使用3个流式管,离心,并用PBS重悬细胞,调整细胞浓度为107个/ ml,其中一个管加入PE anti-rat CD4和FITC anti-rat CD25,余下两管中一管加同型对照剂,另一管作空白对照,震荡后,4℃孵育30 min,加入PBS混匀,洗涤2次,4℃条件下,1 000 r/min离心5 min,去上清,收集底层细胞,加入500 μl PBS,悬浮细胞,进行流式细胞仪检测,结果采用CellQuest软件分析。
收集每组孔内上清液于流式管中,4℃条件下,1 000 r/min离心5 min,去上清,并用 PBS重悬细胞,AnnexinV/PI双染,使用流式细胞仪检测细胞凋亡和周期情况,双阳性细胞为凋亡细胞。用CellQuest软件对检测结果进行数据分析。
1.3 统计学方法 利用 CellQuest软件对流式细胞仪检测结果进行数据分析,采用SPSS 17.0统计软件对三组数据结果进行统计学分析,计数资料以绝对数和百分率表示,计量资料采用±s来表示,组间比较采用方差分析加q检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠的骨髓间充质干细胞形态观察 本研究,大鼠的骨髓间充质干细胞原代培养到5 d左右可见部分细胞呈长梭形或者三角形,呈散在分布,第三代细胞成长多呈梭形,比例约为90%生长均匀。如图1所示。
2.2 光镜下三组T淋巴细胞增殖情况观察 在光
镜下,可见B组的T淋巴细胞的增殖情况明显低A组仅为T淋巴细胞增殖,而C组的T淋巴细胞的增殖情况明显低于A组和B组的T淋巴细胞的增殖,表明骨髓间充质干细胞的存在抑制了T淋巴细胞的增殖,且随着骨髓间充质干细胞的浓度增高,抑制程度增加,如图2所示。
2.3 骨髓间充质干细胞对Ⅰ型糖尿病大鼠淋巴细胞增殖能力影响 采用MTT法考察骨髓间充质干细胞对Ⅰ型糖尿病大鼠淋巴细胞增殖能力影响,其中A组的吸光度值为0.64±0.055,B组的吸光度值为 0.52 ±0.044,C 组的吸光度值为 0.38 ± 0.052。B组和C组的吸光度值明显低于A组,数据之间比较差异均有统计学意义(P<0.05),C组吸光度值明显低于B组,数据之间比较差异有统计学意义(P<0.05),详细情况见表1,图3。
图1 骨髓间充质干细胞体外培养形态Fig.1 Bone marrow mesenchymal stem cells cultured in vitro morphologicalNote:A.Primary culture of bone marrow mesenchymal stem cells in 5 days;B.The third generation culture of bone marrow mesenchymal stem cells in 3 days.

图2 三组T淋巴细胞体系在光镜下的增殖情况观察Fig.2 Proliferation of T lymphocyte system in the light microscope between three groups

表1 三组细胞吸光度值比较Tab.1 Comparison of cell absorbance value between three groups
2.4 骨髓间充质干细胞对Ⅰ型糖尿病大鼠CD4+CD25+调节性T细胞表达比例的影响 分析三组共培养体系的CD4+CD25+调节性T细胞表达比例发现,A组CD4+CD25+调节性T细胞比例为6.21± 0.72,B组 CD4+CD25+调节性 T细胞比例为14.32±0.89,C 组 CD4+CD25+调节性 T 细胞比例为23.67±1.26。B 组和C 组的CD4+CD25+调节性T细胞比例均明显高于A组,数据比较差异均有统计学意义(P<0.05),C组CD4+CD25+调节性T细胞比例明显高于B组,数据比较差异有统计学意义(P<0.05)。详细情况见表2。
2.5 骨髓间充质干细胞对Ⅰ型糖尿病大鼠细胞周期和细胞凋亡的影响 经检测,三组共培养体系中,发现A组G0/G1期细胞比例为(97.33±1.22)%,细胞凋亡比例为(44.01±1.01)%;B组G0/G1期细胞比例为(97.45±1.32)%,细胞凋亡比例为(48.92±1.12)%;C组 G0/G1期细胞比例为(97.56 ±1.02)%,细胞凋亡比例为(58.87 ± 1.65)%。B组和C组的细胞凋亡水平明显高于A组,数据比较差异均有统计学意义(P<0.05),C组细胞凋亡水平明显高于B组,数据比较差异有统计学意义(P<0.05)。三组共培养体系的细胞周期比较差异无统计学意义(P>0.05)。详细情况见表3。

图3 骨髓间充质干细胞对Ⅰ型糖尿病大鼠淋巴细胞增殖能力的影响Fig.3 Influence of lymphocyte proliferation of bone marrow mesenchymal stem cells on typeⅠdiabetic rats

表2 三组共培养体系的CD4+CD25+调节性T细胞表达比例情况Tab.2 Expression ratio of CD4+CD25+regulatory T cells in three groups of co-culture system
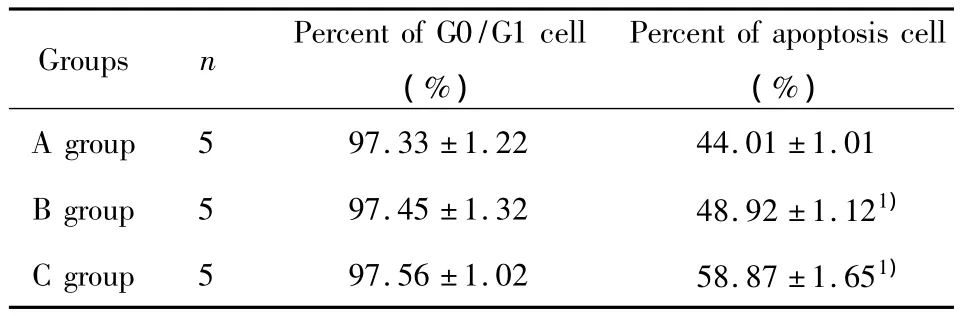
表3 三组共培养体系的细胞周期和细胞凋亡情况Tab.3 Cell cycle and apoptosis in three groups of co-culture system
3 讨论
骨髓间充质干细胞,具有多种功能,对骨髓中的造血干细胞具有机械支持作用,同时还能够多向分化,参与多种组织损伤的修复[5]。此外,还可以通过特定的机制参与免疫调节。最新的研究还表明骨髓间充质干细胞的移植可以逆转Ⅰ型糖尿病动物的血糖水平,但其机制尚不明确[3]。本研究发现,骨髓间充质干细胞能够明显抑制Ⅰ型糖尿病大鼠淋巴细胞的增殖。
CD4+CD25+调节性T细胞,参与机体的免疫调节以及机体免疫损伤的控制[6]。相关文献报道,CD4+CD25+调节性T细胞的缺失或者功能异常可导致机体免疫平衡的丧失,甚至自身免疫疾病的发生,如Ⅰ型糖尿病的发生和发展均可能与机体内CD4+CD25+调节性 T细胞功能紊乱相关[7],而CD4+CD25+调节性T细胞的移植可阻止动物模型Ⅰ型糖尿病的病情的进一步发展[8]。最新的研究也表明,CD4+CD25+调节性T细胞是骨髓间充质干细胞参与免疫调节的重要效应细胞[9]。因此,CD4+CD25+调节性T细胞与骨髓间充质干细胞在调节Ⅰ型糖尿病病情发展中可能存在某种联系。本研究发现在骨髓间充质干细胞与Ⅰ型糖尿病大鼠淋巴细胞的共培养体系中,淋巴细胞增殖能力受到明显抑制,而CD4+CD25+调节性T细胞比例增高,且随着骨髓间充质干细胞的增多,CD4+CD25+调节性T细胞比例升高。此外,共培养体系中的淋巴细胞凋亡水平升高,且随着骨髓间充质干细胞比例增高凋亡水平也增高。表明骨髓间充质干细胞可能通过提高CD4+CD25+调节性T细胞比例促进细胞凋亡而抑制淋巴细胞的增殖。相关学者也证实,骨髓间充质干细胞可使T淋巴细胞周期停滞在G0/G1期,进而抑制其增殖,相关研究证实,下调活化的T淋巴细胞CD25和 CD69的表达,能够抑制 IL-2和IFN-γ 的分泌[10]。
目前,骨髓间充质干细胞与淋巴细胞间的相互作用机制尚未完全清楚。而相关研究表明,骨髓间充质干细胞还可以分泌多种细胞因子,如IL-6、IL-11、LIF、M-CSF及SCF等,并且他们也参与了骨髓间充质干细胞的免疫调节过程[11],而这些细胞因子在免疫调节过程中具体扮演什么样的角色尚不清楚,还有待进一步研究。
综上所述,骨髓间充质干细胞可以显著抑制Ⅰ型糖尿病大鼠淋巴细胞增殖,其机制可能通过调节CD4+CD25+调节性T细胞比例,促进细胞凋亡,继而影响T淋巴细胞的免疫功能,发挥其抑制能力。
[1]黄 盛,郑 伟,范志勇,等.不同微环境对骨髓间充质干细胞分化为产胰岛素细胞的影响[J].中华实验外科杂志,2008,25 (3):368-370.
[2]江小霞,张 毅,李秀森,等.间充质干细胞对T淋巴细胞转化的影响[J].解放军医学杂志,2005,30(2):130-132.
[3]东 波,张福琴,宋振顺,等.骨髓间质干细胞及其来源的产胰岛素细胞移植对受体胰岛和新生血管的影响[J].中华实验外科杂志,2009,26(7):865-867.
[4]李煜环,宋振顺,范子扬.骨髓间充质干细胞体外对1型糖尿病大鼠淋巴细胞的免疫调节作用[J].中华实验外科杂志,2011,28(2):209-211.
[5]Liotta F,Angeli R,Cosmi L,et al.Toll-like receptors 3 and 4 are expressed by human bone marrow-derived mesenchymal stem cells and can inhibit their T-cell modulatory activity by impairing Notch signaling[J].Stem Cells,2008,26(1):279-289.
[6]Glennie S,Soeiro I,Dyson PJ,et al.Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells[J].Blood,2005,105(7):2821-2827.
[7]Tiritt M,Sgouroudis E D,Hennezel E,et al.Functional waning of naturally occurring CIM+regulatory T-cells contributes to the onset of autoimmune diabetes[J].Diabetes,2008,57(1):113-123.
[8]Elmani Z,Naji A,Zidi I,et al.Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD4+CD25+highFOXP3+regulatory T cells[J].Stem Cells,2008,26(1): 212-222.
[9]Fontenot,Gavin,Rudensky.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[10]Nicola MD,Carlo-Stella C,Magni M,et al.Human bone marrowstromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99(10): 3838-3843.
[11]张清军,高 毅,潘明新,等.输注受者骨髓间充质干细胞对肝移植大鼠免疫功能的影响[J].中华实验外科杂志,2007,24(12):1499-1501.
[收稿2013-11-20 修回2013-12-12]
(编辑 张晓舟)
Regulation of bone marrow mesenchymal stem cells on lymphocyte proliferation of typeⅠdiabetic rats
ZHENG Gui-Xing,LI Yi-Quan,WEI Xiao-Ping,WU Jie,HUANG Jun.Department of Blood Transfusion,First Affiliated Hospital of Guangzhou Medical University,Guangzhou 510120,China
Objective:To investigate the regulation mechanisms of the bone marrow mesenchymal stem cells on lymphocyte proliferation of type I diabetic rats.MethodsThe rat bone marrow mesenchymal stem cells were isolated,cultured and identified and the effect on lymphocyte proliferation of typeⅠ diabetic rat was observed by MTT assay,and analyze the CD4+CD25+regulatory T cell ratio,cell cycle and apoptosis of type I diabetes rat by flow cytometric.ResultsB and C groups was significantly lower than the absorbance values of group A,the differences between the data were statistically significant(P <0.05),C group was significantly lower than group B absorbance values,the difference was significant(P <0.05);the CD4+CD25+regulatory T cells of B and C groups were significantly higher than group A,the differences of the data were statistically significant(P <0.05),the CD4+CD25+regulatory T cell ratio of C group significantly higher than that group B,the differences were statistically significant(P <0.05);the apoptosis levels of B and C groups were significantly higher than group A,the differences were statistically significant(P <0.05),the apoptosis levels of C group were significantly higher in group B,the differences were statistically significant(P<0.05).ConclusionBone marrow mesenchymal stem cells can significantly inhibit lymphocyte proliferation of typeⅠ diabetic rats,and it may regulate CD4+CD25+regulatory T cells,promote apoptosis,thereby affecting the immune function of T lymphocytes,and play its rejection.
Bone marrow mesenchymal stem cells;Type Ⅰ diabetic;Rat;Lymphocytes
R392
A
1000-484X(2014)05-0677-04
10.3969/j.issn.1000-484X.2014.05.024
①广州医科大学附属第一医院检验科,广州510120。
②广州医科大学病原生物学与免疫学教研室,广州510180。
郑贵星(1984年-),男,技师,主要从事免疫学方面的研究。
及指导教师:黄 俊(1976年-),男,博士,副教授,主要从事病原生物学与免疫学方面的研究。
