大花罗布麻不同部位酚类物质含量及其抗氧化活性比较研究
2014-01-30韩爱芝黄军海孟庆艳白红进
韩爱芝,黄军海,孟庆艳,刘 文,白红进,*
(1.新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室,塔里木大学生命科学学院,新疆 阿拉尔 843300;2.上海医药工业研究院张江研发中心,上海 200040)
大花白麻为夹竹桃科(Apocynaceae)白麻属大花罗布麻(Poacynum hendersonii(Hook.F.)Woodson),新疆维吾尔族称其为“野务其干”“陶格其干”等[1]。它在我国北方部分省区都有分布,如新疆、青海和甘肃等,新疆有丰富的野生罗布麻资源,主要分布在罗布泊、塔里木河、孔雀河畔及阿克苏地区。罗布麻为多年生宿根草本植物,是荒漠绿化与防风沙的优良种植物[2]。《本草纲目》中记载,罗布麻的药用价值极高,其根、茎、叶、花、全草入药,能平肝安神、清热利水,用于治疗肝阳眩晕、心悸失眠、浮肿尿少、高血压、神经衰弱、肾炎浮肿,1977年罗布麻被正式录入《中华人民共和国药典》[3-4]。现代文献研究证明,罗布麻含有多糖、酚类与鞣质、黄酮、有机酸、生物碱、蒽醌、氨基酸和人体所需的微量元素等多种药物成分,进一步研究黄酮类物质的化学结构,为槲皮素和异槲皮素苷、芦丁、山萘酚等,对头晕症状、改善睡眠质量有明显效果,尤其对高血压、高血脂、有较好的疗效,同时具有增强免疫、预防感冒、平喘止咳、消除抑郁、活血养颜、解酒护肝、降解烟毒、软化血管、通便利尿等生理保健功效[5-7]。
多酚在植物体中的存在形式有3种:游离态、酯化态和结合态,有的文献也将游离态和可溶性的酯化态合称为游离态[8]。据Bonolim[9]、Holtekjolen[10]等报道,植物中游离酚多以原花青素、类黄酮类为主,酯化酚、结合酚多为酚酸类为主,结合酚与葡萄糖、纤维素、木质素、类黄酮、蛋白质、酒石酸等结合的形式存在于植物组织的初生壁和次生壁中。各植物组织中,酚的存在形式和含量都不尽相同,而且在不同的发育阶段,各植物组织中酚的存在形式和含量也会发生相应的变化。
目前人们对罗布麻的有效成分及生理功能研究较多[11-12],但对其各部位中的多酚存在形式、组分含量及抗氧化活性的研究较少。本实验以塔里木盆地大花白麻全株为试材,分别对其根、茎、叶、花中多酚存在形式及其抗氧化活性进行对比研究,揭示不同部位大花白麻多酚物质的分布、存在特点,以期为该植物的品种选育、人工栽培与产品加工质量控制提供理论依据。
1 材料与方法
1.1 材料与试剂
新疆罗布麻全株,于2012年7月上旬采自新疆阿拉尔,由塔里木大学植物科学学院邱爱军副教授鉴定为白麻属大花罗布麻(Poacynum hendersonii(Hook.F.)Woodson),按照根、茎、叶、花分开后阴干,粉碎置于4℃贮藏备用。
芦丁对照品(批号:60922) 德国Dr.Ehrdnstorfer公司;Trolox 美国Sigma公司;福林酚 北京九州天瑞科技有限公司;没食子酸 上海山浦化工有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RE-50B旋转蒸发仪 上海申生科技有限公司;LXT-ⅡB大容量离心机 上海安亭科学仪器厂;KQ-400KDE台式通用超声波清洗器 昆山市超声仪器有限公司; BS124S电子天平 北京赛多利斯仪器系统有限公司;水浴锅 上海申生科技有限公司;CARY-100紫外-可见分光光度计 澳大利亚Varian公司;FW-100高速万能粉碎机 北京市永光明医疗仪器厂。
1.3 方法
1.3.1 游离态酚类物质提取
参照徐元元等[13]的方法提取游离态酚类物质,得游离态酚类提取液(简称游离酚),于-18℃保存备用,每个样品平行提取3次。
1.3.2 结合态酚类物质提取
参照徐元元等[13]的方法提取结合态酚类物质,得结合态酚类提取液(简称结合酚),在-18℃保存备用,每个样品平行提取3次。
1.3.3 多酚的定性实验
三氯化铁-铁氰化钾反应、三氯化铁反应、香草醛-盐酸反应。
1.3.4 黄酮的定性实验
盐酸-镁粉反应、三氯化铝反应、氨熏实验。
1.3.5 总酚含量的测定
1.3.5.1 没食子酸标准曲线的绘制
参照Chiremba等[14]的方法,采用Folin-Ciocalteu比色法测定吸光度。拟合的回归方程为:y=0.011 5x-0.005 6(R2=0.999 1),式中:y为吸光度,x为没食子酸质量浓度/(μg/mL),样品检测质量浓度在10~100 μg/mL范围内与吸光度线性关系良好。
1.3.5.2 样品总多酚含量测定
各取大花罗布麻根、茎、叶与花的提取液1 mL,按照1.3.5.1节的方法测其相应吸光度,计算总多酚含量,结果以100 g干样品中所含没食子酸当量(gallic acid equivalent,GAE)表示,简写为mg GAE/100 g干质量。重复3次测定。
1.3.6 总黄酮含量的测定
1.3.6.1 芦丁标准曲线的绘制
1.3.6.2 样品总黄酮含量测定
各取大花罗布麻根、茎、叶与花的提取液1 mL,按照1.3.6.1节的方法测其吸光度,计算总黄酮含量,结果以100 g干样品中所含芦丁当量(rutin equivalent,RE)表示,简写为mg RE/100 g。重复3次测定。
1.3.7 DPPH自由基清除能力
各样品对DPPH自由基清除能力参照Li Wu等[15]的方法,略有改动。将1 mL 提取液与3 mL 0.052 mg/mL DPPH自由基的甲醇溶液反应,用力振摇混匀后置暗室中静置30 min,测定反应液在517 nm波长处的吸光度。以甲醇代替样品作为空白对照,实验以Trolox作为标样制作标准曲线,得回归方程:y=-0.001 7x+0.856 5(R2=0.999 7),式中:y为吸光度,x为Trolox质量浓度/(μg/mL)。样品清除DPPH自由基能力以100 g干样中所含Trolox的当量微摩尔数表示(μmol Trolox/100 g)。重复3次测定。
1.3.8 ABTS+•清除能力
参照Shahwar等[16]方法,制备ABTS+•储备液,测定样品对ABTS+•清除能力。于734 nm波长处测其吸光度,以甲醇作为空白。实验以Trolox作为标样制作标准曲线,得回归方程:y=-0.002 5x+0.683 4 (R2=0.999 6),式中:y为吸光度,x为Trolox质量浓度/(μg/mL)。样品清除ABTS+•的能力结果以100 g干样中所含Trolox的当量微摩尔数表示(μmol Trolox/100 g)。重复3次测定。
1.3.9 总还原力测定
本研究涉及体院排球队5名最高水平男运动员(接应、副攻、2名主攻、二传),运动员在比赛中的场上位置及需要采集分析的相关参数见表1。自由人不在其中,因为其在比赛中不参与发球、进攻与拦网。
参照Kumarl等[17]的方法,略有改动。取样品稀释液1 mL与pH 6.6、0.2 mol/L的磷酸缓冲溶液2.5 mL和1 g/100 mL铁氰化钾溶液2.5 mL混匀,50℃水浴保温20 min,加入10 g/100 mL的三氯乙酸2 mL终止反应。摇匀,5 000 r/min离心5 min。吸取上清液2.5 mL,加入2.5 mL蒸馏水和0.1 g/100 mL三氯化铁溶液0.5 mL避光反应30 min后在700 nm波长处测定吸光度,以蒸馏水代替样品作为空白。实验以L-抗坏血酸作为标样制作标准曲线,得回归方程:y= 0.004 7x+0.177 5(R2=0.999 5),式中:y为吸光度,x为VC质量浓度/(μg/mL)。样品结果以100 g干物质中所含VC的当量微摩尔数表示(μmol VC/100 g)。重复3次测定。
1.4 统计方法
2 结果与分析
2.1 大花罗布麻不同部位总多酚与总黄酮的定性实验结果
2.1.1 总多酚定性实验结果根据植物化学成分系统预试,由表1可知,大花罗布麻叶、根、花、茎含有多酚类化合物。
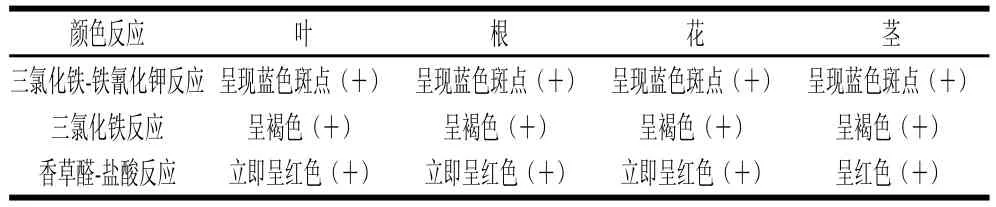
表1 总多酚类定性实验Table1 Qualitative tests of phenolics
2.1.2 总黄酮定性实验结果根据植物化学成分系统预试,由表2可知,大花罗布麻叶、根、花、茎含有黄酮类化合物。
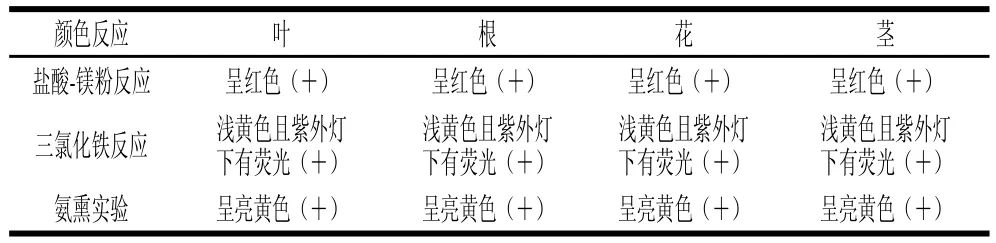
表2 总黄酮类定性实验Table2 Qualitative tests of flavonoids
2.2 大花罗布麻不同部位总多酚含量的测定结果
表3 不同部位游离态多酚、结合态多酚和总酚的含量(±s,n==33)Table3 Cntennts of free, bound and total phenolics in different parts(±s,, n == 33))
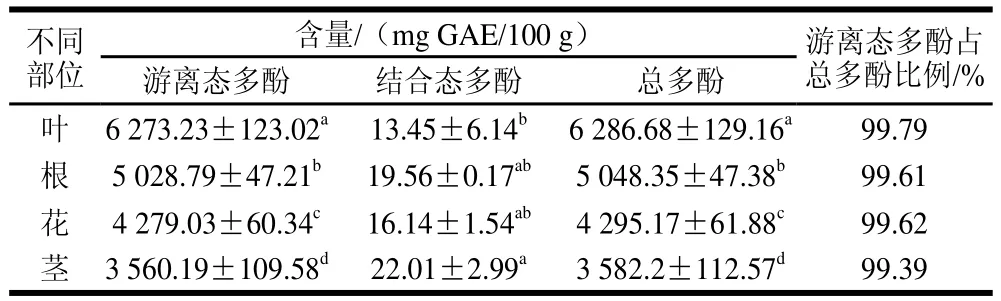
表3 不同部位游离态多酚、结合态多酚和总酚的含量(±s,n==33)Table3 Cntennts of free, bound and total phenolics in different parts(±s,, n == 33))
注:以干质量计;同列字母不同表示差异显著(P<0.05)。下同。
含量/(mg GAE/100 g) 游离态多酚占总多酚比例/%游离态多酚 结合态多酚 总多酚叶 6 273.23±123.02a 13.45±6.14b 6 286.68±129.16a 99.79根 5 028.79±47.21b 19.56±0.17ab 5 048.35±47.38b 99.61花 4 279.03±60.34c 16.14±1.54ab 4 295.17±61.88c 99.62茎 3 560.19±109.58d 22.01±2.99a 3 582.2±112.57d 99.39不同部位
由表3可知,罗布麻不同部位的游离态多酚和总酚含量有显著差异。样品中游离态多酚含量远大于结合态多酚含量,且游离态多酚含量介于(3 560.19±109.58)~(6 273.23±123.02)mg GAE/100 g之间。游离态多酚占总酚比例为99.39%~99.79%。其中游离态多酚含量最高的是罗布麻叶,高达(6 273.23±123.02)mg GAE/100 g,结合态多酚含量最高的是罗布麻茎,达(22.01±2.99)mg GAE/100 g。总酚含量从大到小的顺序依次为:叶>根>花>茎,可见叶中总酚含量显著高于其他部位。总酚含量的降低趋势与游离态多酚的一致,这是由于游离态多酚占总酚含量的99%以上,即罗布麻不同部位多酚主要以游离态多酚为主。
2.3 大花罗布麻不同部位总黄酮含量的测定结果
由表4可知,罗布麻不同部位的游离态黄酮、结合态黄酮和总黄酮含量有显著差异,提取的酚类化合物中总黄酮含量在(1 106.81±5.54)~(2 516.80±296.02)mg RE/100 g,不同部位的游离态黄酮、结合态黄酮和总黄酮含量有显著差异。样品中游离态黄酮含量远大于结合态黄酮含量,并且游离态黄酮含量介于(1 080.30±4.94)~(2 488.21±295.56)mg RE/100 g之间。游离态黄酮占总黄酮比例为97.61%~99.52%。其中游离态黄酮含量最高的是罗布麻根,高达(2 488.21±295.56)mg RE/100 g,结合态黄酮含量最高的是根,达(28.59±0.46)mg RE/100 g。总黄酮含量从大到小的顺序依次为:根>叶>花>茎,且提取物中的黄酮类物质以游离态为主要存在形式。
表4 不同部位的游离态黄酮、结合态黄酮和总黄酮的含量(±s,n==33)Table4 Contents of free, bound and total flavonoids in different parts(±s,, n == 33))
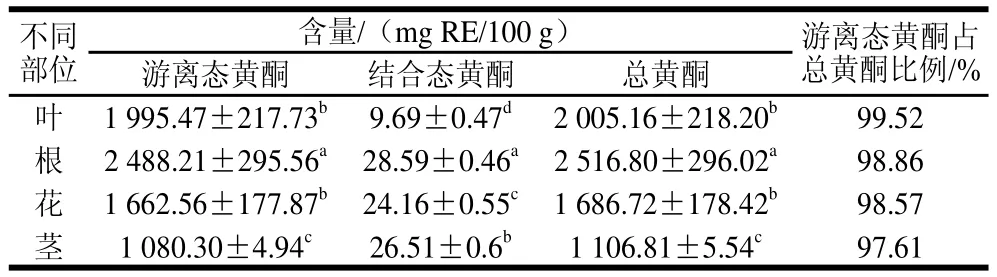
表4 不同部位的游离态黄酮、结合态黄酮和总黄酮的含量(±s,n==33)Table4 Contents of free, bound and total flavonoids in different parts(±s,, n == 33))
不同部位含量/(mg RE/100 g) 游离态黄酮占总黄酮比例/%游离态黄酮 结合态黄酮 总黄酮叶 1 995.47±217.73b 9.69±0.47d 2 005.16±218.20b 99.52根 2 488.21±295.56a 28.59±0.46a 2 516.80±296.02a 98.86花 1 662.56±177.87b 24.16±0.55c 1 686.72±178.42b 98.57茎 1 080.30±4.94c 26.51±0.6b 1 106.81±5.54c 97.61
2.4 大花罗布麻各部位清除DPPH自由基的能力
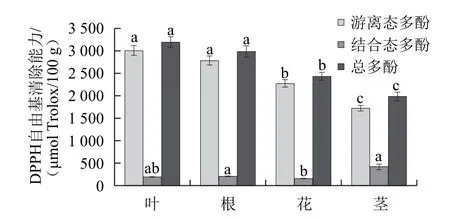
图1 各部位对DPPH自由基的清除能力Fig.1 DPPH free radical scavenging activities of different parts
由图1可知,大花罗布麻叶的游离态多酚提取物清除DPPH自由基能力最强,达3 004.24 μmol Trolox/100 g,花与茎的总清除能力较低,在1 730.47~2 270.48 μmol Trolox/100 g范围之间。不同部位游离态多酚对DPPH自由基清除能力存在显著差异(P<0.05)。游离态多酚的清除能力占总酚的86.79%~94.13%,结合态多酚占总酚的5.87%~13.21%。总之,各部位清除DPPH自由基的能力是以游离态多酚起主要作用,且与其相应含量呈正相关关系。
2.5 大花罗布麻各部位清除ABTS+•的能力
由图2可知,大花罗布麻不同部位游离态多酚对ABTS+•清除能力存在显著差异(P<0.05),其中叶中游离态多酚提取物清除能力最强,高达1 876.01 μmol Trolox/100 g,叶的清除能力显著高于其他部位。在结合态多酚提取物中,根的结合态多酚提取物清除能力最强,为308.18 μmol Trolox/100 g,是茎的4倍多。其中茎的总清除能力最低,为 1 688.25 μmol Trolox/100 g。此外,游离态多酚的清除能力占总多酚的86.57%~95.60%,结合态多酚占总酚的4.40%~13.43%。因此,各部位清除ABTS+•的能力都是以游离态多酚起主要作用。
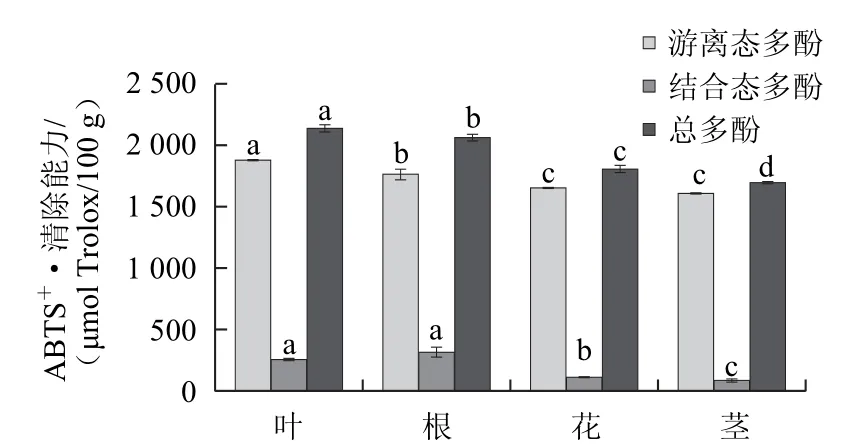
图2 各部位对ABBTTSS+•的清除能力Fig.2 ABTS free radical scavenging activities of different parts
2.6 大花罗布麻各部位的总还原能力
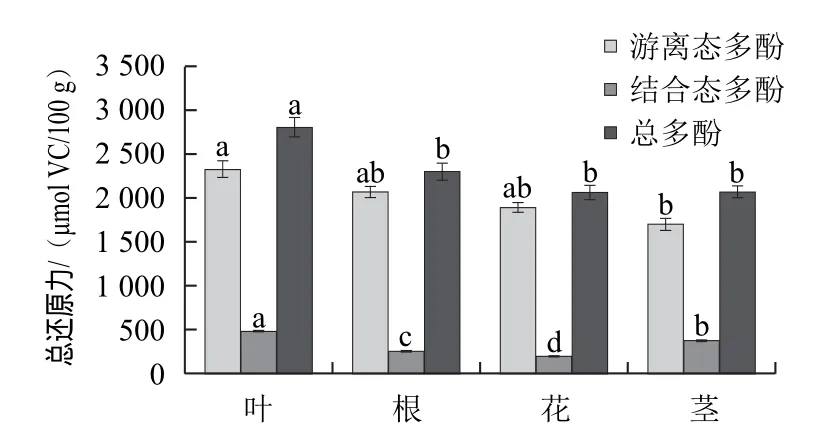
图3 各部位的总还原力比较Fig.3 Comparison of total reducing power of different parts
由图3可知,大花罗布麻各部位提取物的还原能力存在显著性差异(P<0.05),其中叶的游离态多酚还原能力最强,高达2 320.58 μmol VC/100 g,叶的总还原力显著高于其他部位。在结合态多酚提取物中,叶的结合态多酚提取物清除能力最强,为476.16 μmol VC/100 g,是花的2倍多。花和茎的总还原能力相当。游离态多酚的还原能力占总多酚的82.17%以上。因此各部位的还原能力都是以游离态多酚起主要作用。
2.7 大花罗布麻各部位提取液中总多酚、总黄酮含量与抗氧化能力之间的相关性
将大花罗布麻各个部位提取物对DPPH自由基、ABTS+•清除能力和总还原力分别与相应部位总酚含量、总黄酮含量进行统计学回归分析,得到各相关系数见表5。

表5 总多酚、总黄酮含量与抗氧化能力之间的相关性Table5 Linear corelations between antioxidant properties and total phenolics or flavonoid contents
由表5可知,大花罗布麻各部位提取物总多酚含量与抗氧化能力之间具有良好的线性关系,在0.05水平上,各提取液对DPPH自由基、ABTS+•清除能力和还原能力与总酚含量的相关系数分别为0.955 2、0.959 8与0.952 8,都大于0.950 0,为显著性相关。但各提取物总黄酮含量与抗氧化能力之间的相关系数均小于0.950 0(P<0.05),为相关性不显著[18]。
3 讨 论
游离态和结合态是植物体中酚类化合物的两种主要存在形式,本实验针对这两种存在形式进行研究,以往研究主要集中对游离态酚类化合物的探讨,因此其测定结果未包括结合态的部分。实验样品中酚类化合物的存在状态研究表明:大花罗布麻不同部位中多酚和黄酮的存在形式主要以游离态存在(所占比例均大于90%),即在此大花罗布麻中,游离态多酚和游离态黄酮含量大致可表示其总多酚和总黄酮的含量。
大花罗布麻多酚含量的研究结果表明,植株不同部位之间多酚含量存在显著差异。其叶中总多酚含量((6286.68±129.16)mg GAE/100 g)比Liang Taigang等[19]报道的总多酚含量((50.61±1.19)mg GAE/g)高;叶中总黄酮含量测定结果((2 005.16±218.20)mg RE/100 g)与薛华茂等[20]研究的结果相一致,比Liang Taigang等[19]测定的总黄酮含量((18.16±1.04)mg RE/g)高,但比石秋梅等[21]测定的总黄酮含量(3.54%)低些。不同部位总黄酮的含量顺序:根(2.52%)>叶(2.01%)>花(1.69%)>茎(1.11%)与石秋梅等[22]报道的大花罗布麻叶(3.54%)>茎(0.56%)>花(0.44%)>根(0.33%)略有差异,主要原因可能是样品采集时间、地点及栽培环境等因素不同所致。Adom等[22]研究发现小麦、大米、燕麦及玉米中多酚主要以结合态多酚形式存在,Sun Jie等[23]发现水果中多酚以游离多酚为主。本实验中大花罗布麻游离态多酚占总酚的99%以上,表明该植物中多酚的存在形式与小麦、玉米等谷物不同,而与水果中的多酚存在形式相似,主要以游离态多酚形式存在。
抗氧化活性研究表明,供试样品均具有较强的清除DPPH自由基、ABTS+•的能力和总还原能力。多酚提取物的总多酚含量与对DPPH自由基、ABTS+•清除能力和总还原能力之间有显著的正相关关系(P<0.05)。在清除DPPH自由基、ABTS+•和还原力模型中,游离态多酚的清除能力分别占总多酚的86.79%~94.13%、86.57%~95.60%和82.97%~91.02%。相关性分析也显示其多酚含量与抗氧化能力呈良好的线性关系,说明在抗氧化体系中发挥清除能力的主要化合物可能是游离态多酚类物质。叶中多酚含量与抗氧化活性明显高于其他部位,说明商品化的罗布麻茶的降血压功效可能与其多酚与黄酮含量高密切相关[24]。因此,大花罗布麻叶可以作为一种保健食品和药品的天然抗氧化剂资源进行深层次的开发与利用。
[1]阿斯娅·曼力克, 孙韬, 塞里克·都曼, 等.新疆大叶白麻资源及其开发利用前景[J].中国农业资源与区划, 2003, 24(3): 27-33.
[2]PENG Xuemei, ZHAO Jinfeng, ZHANG Weiming.Genetic diversity in wild populations of Poacynum hendersonii from inland arid regions of Northwest China[J].Agricultural Science & Technology, 2008,9(4): 39-43.
[3]曾斌芳, 田莉, 燕雪花.新疆罗布麻的药理作用和现代应用研究进展[J].中国民族民间医药, 2009, 17(2): 11-13.
[4]TAGAWA C, KAGAWA T, NAKAZAWA Y.Studies on antihypertensive effect of luobuma (Apocynum venetum L.) leaf extract(3)[J].Journal of the Pharmaceutical Society of Japan, 2004, 124(11):851-856.
[5]IRIE K, SATO T, TANAKA I, et al.Cardiotonic effect of Apocynum venetum L.extracts on isolated guinea pig atrium[J].Journal of Natural Medicines, 2009, 63(2): 111-116.
[6]ZHENG Meizhu, LIU Chunming, PAN Fengguang, et al.Antidepressant-like effect of hyperoside isolated from Apocynum venetum leaves: possible cellular mechanisms[J].Phytomedicine,2012, 19(2): 145-149.
[7]BUTTERWECK V, SIMBREY K, SEO S, et al.Long-term effects of an Apocynum venetum extract on brain monoamine levels and β-AR density in rats[J].Pharmacology Biochemistry and Behavior, 2003,75(3): 557-564.
[8]石壁, 狄莹.植物多酚[M].北京: 科学出版社, 2000.
[9]BONOLI M, VERARDO V, MARCONI E, et al.Antioxidant phenols in barley (Hordeum vulgare L.) flour: comparative spectrophotometric study among extraction methods of free and bound phenolic compounds[J].Journal of Agricultural and Food Chemistry, 2004,52(16): 5195-5200.
[10]HOLTEKJOLEN A K, KINITZ C, KNUTSEN S H.Flavanol and bound phenolic acid contents in different barley varieties[J].Journal of Agricultural and Food Chemistry, 2006, 54(6): 2253-2260.
[11]张云峰, 魏东, 郭祀远, 等.大花罗布麻的化学成分研究[J].天然产物研究与开发, 2006, 18(6): 954-957.
[12]XIANG Jun, LAN Rui, TANG Yuping, et al.Apocoynum venetum leaf extract attenuates disruption of the blood-brain barrier and upregulation of matrix metalloproteinase-9/-2 in a rat model of cerebral ischemiareperfusion injury[J].Neurochemical Research, 2012, 37(8): 1820-1828.
[13]徐元元, 国旭丹, 贺丽霞, 等.常见6种杂粮与2种主粮的抗氧化活性比较研究[J].食品科学, 2012, 33(7): 20-25.
[14]CHIREMBA C, TAYLOR J R N, ROONEY L W, et al.Phenolic acid content of sorghum and maize cultivars varying in hardness[J].Food Chemistry, 2012, 134(1): 81-88.
[15]LI Wu, LIANG Hong, ZHANG Mingwei, et al.Phenolic profiles and antioxidant activity of Litchi (Litchi Chinensis Sonn.) fruit pericarp from different commercially available cultivars[J].Molecules, 2012,17(12): 14954-14967.
[16]SHAHWAR D, REHMAN S, AHMAD N, et al.Antioxidant activities of the selected plants from the family euphorbiaceae, lauraceae,malvaceae and balsaminaceae[J].African Journal of Biotechnology,2010, 9(7): 1086-1096.
[17]KUMARL P S, SUDHA S.Evaluation of antioxidant activity and total phenolic content of padina boergesenii from Gulf of Mannar[J].Drug Invention Today, 2012, 4(12): 635-639.
[18]SHEN Yun, LIANG Jin, PENG Xiao, et al.Total phenolics,flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J].Journal of Cereal Science, 2009, 49(1):106-111.
[19]LIANG Taigang, YUE Wenyan, Li Qingshan.Comparison of the phenolic content and antioxidant activities of Apoynum venetum L.(Luo-Bu-Ma) and two of its alternative species[J].International Journal of Molecular Sciences, 2010, 11(11): 4452-4464.
[20]薛华茂, 钱学射, 张卫明, 等.罗布麻的化学成分研究进展[J].中国野生植物资源, 2005, 24(4): 6-12.
[21]石秋梅, 帕孜来提·吐鲁洪, 阿不都拉·阿巴斯.大叶白麻不同部位总黄酮和金丝桃苷含量研究[J].食品科学, 2009, 30(8): 263-266.
[22]ADOM K K, SORRELLS M E, LIU R H.Phytochemicals and antioxidant activity of milled fractions of different wheat varieties[J].Journal of Agricultural and Food Chemistry, 2005, 53(6): 2297-2306.
[23]SUN Jie, CHU Yifang, WU Xianzhong, et al.Antioxidant and antiproliferative activities of common fruits[J].Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454.
[24]虞颖映, 邵健忠, 王海明.罗布麻茶对心血管系统的生物学效应研究[J].同济大学学报: 医学版, 2006, 27(4): 40-43.
