铁蛋白:一种新型矿质元素营养强化剂载体
2014-01-30李美良赵广华
李美良,蒲 彪*,赵广华
(1.四川农业大学食品学院,四川 雅安 625014;2.中国农业大学食品科学与营养工程学院,北京 100083)
人和动物每天都需要一定量的矿物质营养元素来满足身体各项活动的代谢需要,矿物质元素摄入量长期不足,就会导致各种疾病的发生。体内容易缺乏的矿物质营养元素既有常量元素,如钙(Ca)元素,也有微量元素,如铁(Fe)、锌(Zn)以及硒(Se)等。这些元素对于维持身体正常机能具有重要作用。
铁是人体必需的半微量元素,可以形成血红素、铁硫原子簇以及非血红素铁化合物,这使得它在光合作用、呼吸作用、氮的固定、蛋白质和核酸的合成等诸多生理代谢过程扮演着举足轻重的角色。其在人和动物体内具有重要的生物学功能,如铁参与血红蛋白、肌红蛋白在的合成,使氧和养分在体内正常运输、储存;它能构成细胞色素酶及过氧化氢酶等,参与机体电子传递,对呼吸和能量代谢都产生重要影响[1-3]。铁在体内过少或者过多都会对机体产生不良影响,缺铁导致的病变有:缺铁性贫血;缺铁可诱发糖尿病[4];缺铁可导致功能性甲状腺素低下、温度调节紊乱、儿茶酚胺代谢改变;缺铁可引起转铁蛋白水平升高,抑制半乳糖脑苷脂的表达,导致神经系统髓鞘化不足,影响脑的发育[5-6];缺铁可导致机体淋巴细胞数量下降,影响免疫球蛋白和B细胞免疫球蛋白亚类及其抗体和局部体液免疫功能,使机体免疫能力下降,诱发各种疾病[7]。铁 过多时,会导致铁中毒,主要机制是过量的二价铁离子会诱发Haber-Weiss反应,产生自由基[8]:

钙是人体不可或缺的一种常量元素,是构成人体骨架的基本成分之一,对人体的生长与发育、疾病与健康、衰老与死亡起着重要作用[9-11]。人体内约99%的钙分布于骨和牙组织中,成为人体的钙库,其余1%则主要存在于人体细胞周围的细胞间液中。被吸收的钙可以通过消化道、肾脏、皮肤代谢出体外,也可以通过骨形成机制形成骨骼(图1)[12]。其生理功能主要体现在以下几个方面:钙含量能调节细胞表面的膜电位变化,导致兴奋性传递的改变;钙在血小板凝集和止血中起重要作用;钙-钙调素结合体能够参与细胞内钙调蛋白的调控功能;钙在细胞内通过第二信使和偶联作用调节细胞内的多种反应[13]。另外,钙还参与人体其他生理过程,如降低毛细血管和细胞膜的通透性[14];维持体内酸碱平衡;钙与肠道内胆汁酸和脂肪酸结合生成钙皂,能缓和肠道刺激作用,防止结肠癌的发生;控制新陈代谢、细胞黏附和分裂等[15]。

图1 钙在人体内的代谢途径[[1122]]Fig.1 Schematic diagram of the flow of calcium through the body[[1122]]
一直以来,很多人错误地认为钙这种常量元素广泛存在,能从食物中得到充足供应而不缺乏,但医学研究的结果表明这是一种误解。事实上人体容易缺钙,缺钙对人的健康有很大的影响,其中以儿童和老年人最甚。据国务院新闻部发布的第4次中国居民营养与健康现状调查显示[16],由于我国居民有经常喝饮料、咖啡、浓茶等饮食习惯及消费植物性来源食物的原因[17-19],居民膳食钙的摄人量较低,只达到我国营养学会推荐供给量标准的一半,有些地区儿童只达到推荐摄入量的20%~50%,因此儿童中佝偻病仍较为常见。在农村,多数人钙摄入量为400 mg/d,低于推荐摄入量800 mg/d,缺钙已成为影响我国人民健康的严重问题。缺钙最严重的人群包括:婴幼儿及生长发育期的儿童,若摄入钙不足,将影响孩子的身高、骨密度、牙密度和肌肉强度,使儿童出现骨痛、牙齿发育不良、生长迟缓,出现佝偻病等症状;妊娠、哺乳期的妇女[20-21],如果钙补充不足,会导致在怀孕期间出现肌肉痉挛、小腿抽筋、腰酸背痛等钙缺乏症状;老年人,尤其是绝经以后的老年妇女,其机体对钙的吸收率呈直线下降,骨溶解也相应加速,机体脱钙加剧,极易发生骨质疏松症;在特殊环境下工作的人群,如在高真空、强辐射、超重、失重环境下在太空进行空间作业的宇航员[22],他们在这种特因环境下生理系统会失衡,钙流失最严重,且在返回地面后,生理系统需要一段时间才能恢复,但是骨钙的丢失却会持续进行,会严重危害航天员生命安全和飞行任务的顺利执行。
锌对于维持体内糖、蛋白质和核酸等生物大分子的体内调控代谢具有重要作用,对视神经也具有重要调节作用,能够显著改善视力[23],除此之外,锌对于人体免疫系统、生殖功能系统、人体生长发育、脑细胞的成熟分化以及食欲等都有重要影响[24]。锌的缺乏也会对上述方面产生不良影响。
硒是人和动物所必需的微量元素,具有提高机体免疫力、抗癌、抗自由基、延缓衰老、拮抗有毒元素、防治某些地方性流行病等多种功能,因此硒的补充也是至关重要的[25-26]。此外,还有其他的一些微量矿质元素,人体若缺乏,也会导致各种病变。
然而,目前市场上常见的矿质元素补充制剂以铁、钙和锌的偏多。对于铁元素来说,主要有如下三代补铁制剂:
以亚铁离子的无机盐为代表的第一代补铁制剂。这些无机盐包括:硫酸亚铁、氯化亚铁、磷酸铁钠、焦磷酸亚铁、氨基磷酸肽等[27]。由于这些化合物易与硫化物及多酚结合引起食品变色变质,而且服用过多Fe2+会诱发Fenton反应产生自由基,对胃肠道刺激严重,甚至会造成疾病的风险[8];另外,亚铁离子会受到食物中一些如植酸、单宁等小分子螯合剂的干扰,也可能会与糖、DNA等分子结合,导致亚铁离子的吸收利用率低下[28-30]。
以非血红素铁——乳酸亚铁、葡萄糖酸亚铁、柠檬酸亚铁等可溶的有机小分子为代表的第二代补铁制剂[31]。与第一代补铁制剂相比,第二代补铁制剂铁的吸收利用率普遍提高,但是由于它们会引起胃肠道的不良反应,如恶心、呕吐等,使得其推广受到一定的限制。
以乙二胺四乙酸铁钠盐、甘氨酸铁、苏氨酸铁等小分子螯合物为代表的第三代补铁制剂[1]。这些螯合铁制剂吸收效率高、性质稳定、口感好,关键的是其不会刺激胃肠道,也不会影响食品品质。但由于成本高,目前还难以普及。
而对于钙来说,市场上钙制剂品种繁多,主要分为无机钙、天然生物钙、有机酸钙制剂和氨基酸螯合钙制剂。无机钙主要指以动物或鱼类磷骨、珍珠、贝壳或碳酸钙矿石等为原料加工而成的无机钙盐,如碳酸钙、碳酸氢钙、磷酸氢钙、氧化钙、磷酸氢钙和氯化钙[16];天然生物钙也叫活性钙,是将天然贝壳或珍珠粉经高温煅烧制成,有的另辅以中药,除含钙外,还含有人体所需的磷、锌、锶、锰等微量元素,如盖天力、珍珠钙胶囊、活性钙胶囊、益钙灵、龙牡壮骨冲剂等;有机钙主要有醋酸钙、柠檬酸钙、乳酸钙、苏糖酸钙和葡萄糖酸钙等;氨基酸螯合钙主要有苏氨酸钙/乐力胶囊等[9]。
锌的制剂方面,和钙制剂产品类似,也主要分为无机锌、有机合成锌、氨基酸或蛋白质螯合锌制剂等,主要由无机型、普通有机型发展至蛋白质型、小肽型、氨基酸型,推动了新的补锌制剂的开发进展。而对于硒来说,当前广泛使用的补硒方法是在日粮中添加亚硒酸钠,鉴于其结合率低、毒性大、而且会对环境造成潜在的污染,因此已被限量使用[26]。
综上所述,当前的矿质元素营养强化剂均存在不同的弊病,如铁、钙、锌等营养强化剂普遍存在水溶性较差、吸收率低、易受膳食中其他因子的影响,如易与柠檬酸、植酸等形成不溶物,影响这些矿质元素营养强化剂的吸收效率[9,26,32],因此,开发高效、安全的矿质元素营养强化剂势在必行。
而铁蛋白作为一种自然界广泛存在的天然蛋白,具有开发新型矿质元素营养强化剂的潜力。铁蛋白广泛存在于动物、植物和细菌体内,由于其具有储存铁元素及调节体内铁平衡的功能,铁蛋白能够使机体内的铁保持可溶、无毒且生物可利用的形式[33]。动物和植物铁蛋白在结构和功能上有很大的不同。动物铁蛋白通常包括H和L亚基,而植物铁蛋白只含有H亚基,但通常由H-1和H-2两种不同的亚基组成。另外,植物铁蛋白每个亚基的N端还含有独特的Extension Peptide(EP)肽段,因此每个铁蛋白分子24个亚基含有24个EP肽段[34-37]。
同时,由于铁蛋白中空的特殊结构,越来越多的研究者利用脱铁铁蛋白的蛋白质外壳作为载体装载其它可供利用的金属离子来制备新型生物纳米运载体系[38]。将铁蛋白内部的铁核在无氧条件下通过还原反应使Fe(Ⅲ)还原为Fe(Ⅱ)而被去除,最后得到中空的脱铁铁蛋白,然后利用各种物理化学方法将其他矿物质离子加入到脱铁铁蛋白当中,制备成新型的功能性生物纳米颗粒。本篇综述主要阐明了铁蛋白在结构及功能方面的研究新进展,其作为矿质元素营养强化剂载体方面的应用以及铁蛋白在功能性食品方面的应用前景。
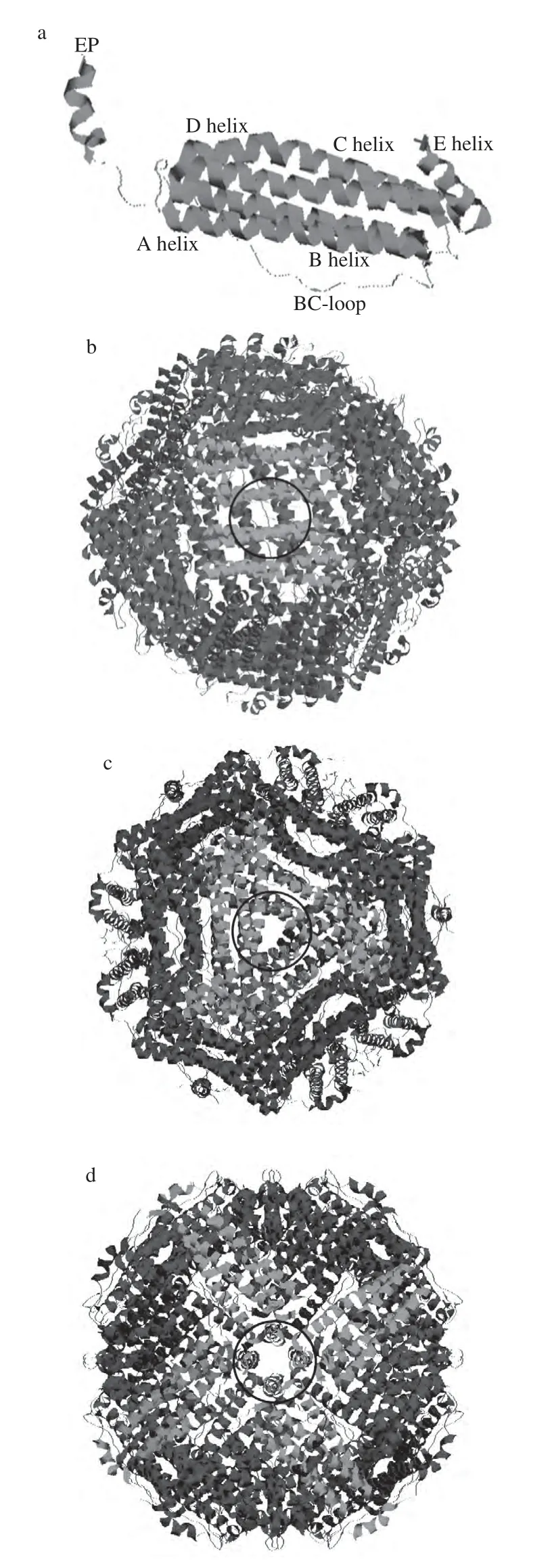
图2 重组大豆铁蛋白分子结构[[99]]Fig.2 Graphic representations of the SFER4 structure[9]
1 铁蛋白分子的结构
1.1 铁蛋白分子的保守结构
铁蛋白是一个由24个亚基组成的中空球状分子(图2),内外直径分别约为8、12 nm,每分子铁蛋白空腔内最多可以贮存4 500个铁原子。从细菌铁蛋白到植物铁蛋白再到人体铁蛋白,其结构都非常保守。铁蛋白亚基长约5 nm,宽约2.5 nm,外形近似圆柱体,且每个亚基由一个两两成反向平行的α螺旋簇(A、B和C、D)和一个较短α螺旋(E)组成,B螺旋和C螺旋之间由一段含18个氨基酸的链连接(BC-loop),E螺旋位于α螺旋簇尾端并与之成60°夹角(图2a);这24个亚基形成4-3-2重轴对称,一分子铁蛋白包括12个2重轴通道(图2b,黑色的圆所示位置),8个3重轴通道(图2c,黑色的圆所示位置)和6个4重轴通道(图2,黑色的圆所示位置),这些通道负责铁蛋白与外部环境中物质的交换,是铁离子与氧气分子以及其他分子或离子进出铁蛋白的桥梁,起着沟通铁蛋白内部空腔与外部环境的作用[39]。
其中,3个亚基形成一个3重轴通道,它是铁离子进入蛋白质的主要途径。铁蛋白的3重轴通道高度对称,这8个孔道是控制还原剂和螯合剂进入铁蛋白内部空腔的通道。每4个亚基及位于铁蛋白亚基C端的4个亚基上的E螺旋参4重轴通道的形成,但是到目前为止,铁蛋白4重轴通道的生物学功能还不清楚,所以铁蛋白的4重轴通道以及E螺旋的生物学功能还有待进一步研究[2,39]。
1.2 动物铁蛋白分子的结构
动物铁蛋白分子是由H(即重链,heavy)和L(即轻链,light)两种类型的亚基组成,其分子质量分别约为21 kD和19.5 kD,具有55%的同源性。二者在铁蛋白中所起的作用是不一样的,H型亚基具有亚铁氧化中心[40],该中心是由Glu27、Tyr34、Glu62、His65、Glu107和Gln141等氨基酸组成的,主要功能是负责Fe(Ⅱ)的快速氧化。每个亚铁氧化中心可以结合两个Fe(Ⅱ)离子,并把Fe(Ⅱ)离子快速氧化成Fe(Ⅲ)送入蛋白质空腔内部形成铁核。而与H型亚基不同,L型亚基没有亚铁氧化中心,但有一个假定成核中心。它由Glu53、Glu56和Glu57组成,其在亚铁的慢速氧化和矿化作用中有重要意义。动物铁蛋白中两种亚基总数也为24,但是H/L的比例随不同的器官而变化,从而满足各种细胞对铁的不同需求。例如:富含L型亚基铁蛋白的器官偏向于贮存铁的功能,其空腔中的铁原子含量就较高,代表性的器官有肝和脾;而富含H型亚基铁蛋白的器官,其每个铁蛋白分子含有的铁原子就较少,但却具有铁代谢旺盛的特点,代表性的器官是心脏和脑[9,39]。
1.3 植物铁蛋白分子的结构
与动物铁蛋白相比,植物铁蛋白和动物铁蛋白的起源是相同的,结构基本一样,但是植物铁蛋白有一个显著的不同点,即具有EP肽段。它是成熟的植物铁蛋白亚基N端特有的重要组成部分,H-1和H-2亚基来源于不同的前体蛋白,前体蛋白的N端包含两个植物铁蛋白所特有的结构域-TP(transit peptide)和EP。TP主要负责将前体蛋白转运到质体中,一旦前体蛋白进入质体,TP就会被切除掉,然后亚基在质体中组装成成熟的铁蛋白。早期的研究认为EP与铁蛋白的稳定性有关,最新的研究表明,EP肽段包含植物铁蛋白的第二个亚铁氧化中心,负责Fe2+的表面氧化及促进植物铁蛋白的聚合[41],并且具有丝氨酸蛋白酶的活性,会导致铁蛋白降解并促进铁的释放,与降解这一过程相伴随的是快速的铁释放以满足种子生长的需要,即植物铁蛋白通过EP来调节铁释放从而起到补充铁的作用[9,35-36,42]。
尽管动物铁蛋白和植物铁蛋白的起源相同,但是它们在生物进化的过程中,存在着诸多差异。动物铁蛋白受控于翻译水平即mRNA水平调控,而植物铁蛋白受调控于转录水平即DNA水平;前者存在于细胞质中[9,39],而后者存在于细胞质体中;从铁蛋白存在的环境来看,前者周围的磷酸根浓度低,约1 mmol/L,而后者周围的磷酸根浓度高,约12 mmol/L;从亚基的组成上来看,前者同时含有H型和L型,而后者只含有H型亚基,且到目前为止,发现的植物铁蛋白亚基均由H-1和H-2两种亚基组成,亚基大小分别为26.5 kD和28.0 kD[41]。同时也克隆得到了大豆铁蛋白H-1和H-2亚基的编码基因分别为SferH-1和SferH-2,充分证实植物铁蛋白是多基因编码的。同样的例子还有黑豆、蚕豆、玉米、苜蓿以及拟南芥等植物种子中分离得到的铁蛋白都是由这两种H型亚基组成[35,43]。
2 铁蛋白的功能
铁蛋白在生物体内具有两种主要功能:一是维持生物体内铁的代谢平衡。铁蛋白是普遍存在于生物体内的一种储存铁的蛋白质,其储存铁的过程主要包括Fe(Ⅱ)的氧化、Fe(Ⅲ)的转移、矿质铁核的形成和生长,从而能够将铁贮存在铁蛋白内部;二是能够通过清除铁介导的自由基而抑制Fenton反应,防止过量铁导致的氧化性胁迫。这是由于二价铁能活化过氧化氢,形成羟自由基,后者具有很强的氧化能力,能损伤细胞,导致细胞完整性的丧失,甚至引起细胞死亡。而铁蛋白通过截获细胞间的铁,从而阻止铁参与Fenton反应产生的羟自由基,而保护细胞免受因各种环境胁迫而导致的细胞氧化性损伤[44]。
2.1 铁蛋白的3条铁吸收途径
铁蛋白贮存铁的过程,又被成为铁吸收或者铁氧化沉淀过程。而铁蛋白铁吸收反应具体是指当细胞内Fe(Ⅱ)浓度高时,在氧化剂(氧分子或过氧化氢)存在的情况下Fe(Ⅱ)被铁蛋白催化氧化,并把生成的Fe(Ⅲ)储藏于其内部空腔的过程。理论上,每分子铁蛋白最多可储存4 500个Fe(Ⅲ)。关于Fe(Ⅱ)在铁蛋白中的氧化沉淀机理也成为国际生物无机化学领域的研究热点[45]。研究主要集中于重组的人重链铁蛋白、马脾铁蛋白、重组的牛蛙M铁蛋白。对以上铁蛋白铁氧化沉淀机理的研究发现了如下3条途径[35,46]。
第一条途径:当加入Fe(Ⅱ)的量≤2 Fe(Ⅱ)/H-chain时,反应机理如下:

P代表未结合铁的亚铁氧化中心,它位于H型亚基中。从方程式(4)可以看出,反应形成了三价双铁中间体,该中间体在可见区650 nm左右有最大吸收,该化合物不稳定,迅速分解为氧桥连的三价双铁配合物;并最终分解为单核的Fe(Ⅲ)化合物,从亚铁氧化中心转移至铁蛋白空腔内,形成矿化核FeOOH(core)。
第二条途径:当加入Fe(Ⅱ)的量>10 Fe(Ⅱ)/H-chain时,铁的氧化主要在铁核上进行,这时矿化机理扮演主要角色,反应方程式如下:

Zhao Guanghua等[47-48]利用停流技术并结合紫外光谱手段对人重链铁蛋白的研究表明:当一次加入的Fe(Ⅱ)的量>48 Fe(Ⅱ)/铁蛋白时,过氧桥连的三价双铁中间体也可形成,但随着一次性加入的铁量从100增加到800 Fe(Ⅱ)/铁蛋白时,过氧桥连的三价双铁中间体在650 nm呈现出非凡的生成和分解动力学曲线。当加入Fe(Ⅱ)的量多时,蛋白催化与矿化机理同时并存,但是随着加入量的逐渐增加,矿化机理所作用所占比重增大。
第三条途径:当加入Fe(Ⅱ)的量多时,除了上述这两条铁氧化途径外还存在另一个去毒反应[46],即铁氧化沉淀的第3条途径,如反应方程式(6)所示:
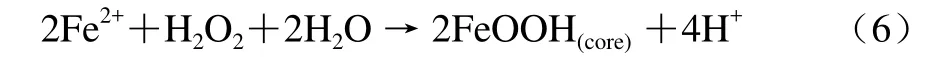
从反应方程式(6)可以看出,虽然它的反应物与Fenton反应相同,但产物却大不相同,没有羟自由基的产生,因此,通过这个反应,铁蛋白不但可以去除Fe(Ⅱ)的毒性,同时还可以消除过氧化氢的毒性,更加证实了铁蛋白在细胞内具有去毒功能。有报道利用EPR顺磁旋诱捕技术在无氧条件下监测Fe(Ⅱ)与过氧化氢反应有无羟自由基的生成,发现当人重组H型亚基铁蛋白存在时,羟自由基生成得到极大抑制,即人重组H型亚基铁蛋白可以抑制Fenton反应的发生,而且这项功能与亚铁氧化中心密切相关[9,49],上述结果与铁蛋白的去毒功能是一致的。
2.2 植物铁蛋白新的铁吸收途径
Li Chaorui等[41]近期发现在植物铁蛋白中存在一条新的铁吸收途径——表面氧化途径。植物铁蛋白与动物铁蛋白最大的区别在于前者的N端上存在EP肽段,它存在于铁蛋白的表面,而动物铁蛋白不具有此肽段[39]。研究发现在植物铁蛋白中,当加入Fe(Ⅱ)过量情况下,铁蛋白空腔内铁矿核较小(<200 Fe/shell)时,除了上述这3条铁氧化途径外还存在第4条途径,即植物铁蛋白的表面氧化途径,见图3。
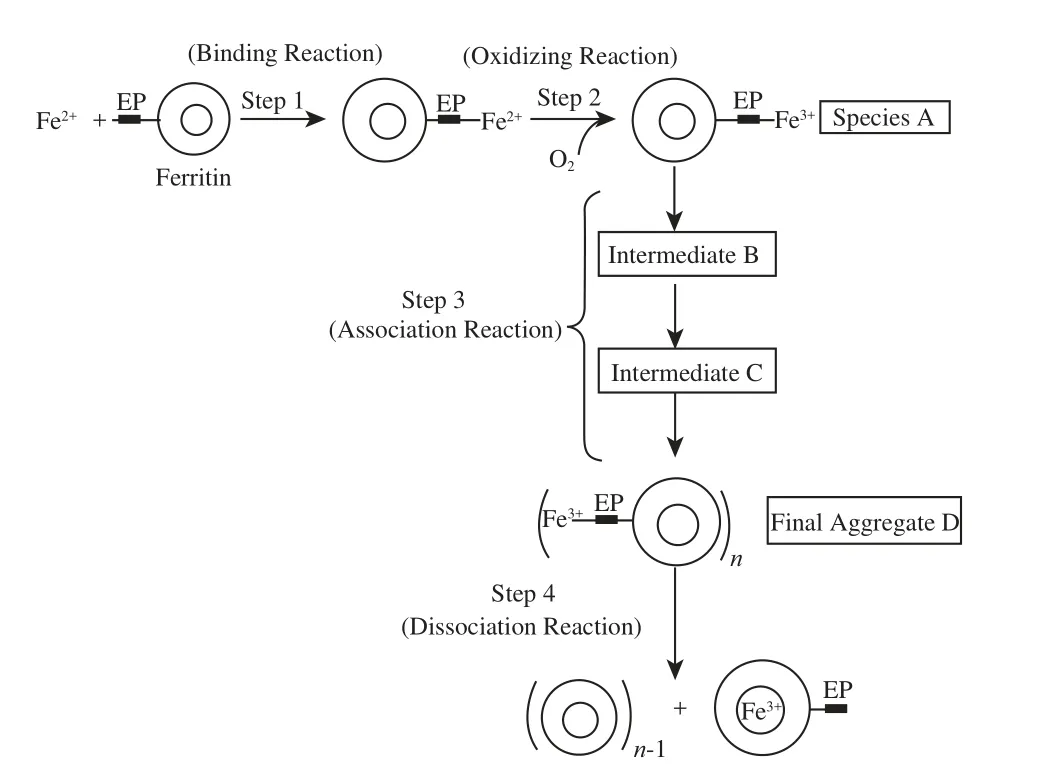
图3 豌豆铁蛋白亚铁离子表面氧化过程示意图(≥48 Fe(Ⅱ)时发生)[[4411]]Fig.3 A proposed pathway of Fe(II) oxidative deposition in PSF through protein association at high Fe(Ⅱ) flux (more than 48 Fe(Ⅱ)/protein) [[4411]]
如图3所示,植物铁蛋白表面氧化途径的步骤是:首先是结合反应,即当Fe(Ⅱ)过量情况下(>2 Fe(Ⅱ)/H-chain),铁蛋白空腔内铁矿核较小(<200 Fe(Ⅲ)/H-chain)时,Fe(Ⅱ)结合到位于植物铁蛋白N-末端的EP肽段上;其次是氧化反应,Fe(Ⅱ)被氧化为Fe(Ⅲ)(即Species A);再次是聚合反应,Fe(Ⅲ)单体聚合形成中间体B和C,再到形成终产物D;最后是解聚反应,即Fe(Ⅲ)转移至植物铁蛋白空腔内部,终产物D解聚,然后EP再重复下一个同样的过程[41]。这被认为是铁蛋白的第4条氧化途径,这与植物铁蛋白的特殊结构有关。
2.3 铁蛋白的铁释放途径
铁释放是指储存于铁蛋白内部空腔内的Fe(Ⅲ)被还原为Fe(Ⅱ),并转移到铁蛋白外部供机体利用的过程称为铁蛋白的铁释放或者叫铁还原。目前,对于铁蛋白的铁吸收途径研究比较清楚,由于研究手段的限制及铁蛋白释放的复杂性等原因,对于铁释放途径相关的研究还比较少。然而,铁蛋白的铁还原释放具有重大的意义,该过程与动植物细胞的生长、发育中铁元素的供给有着密切的关系。在动物体内铁蛋白还原释放铁供机体利用的研究还很少,但是在大豆中发现其铁蛋白的EP具有丝氨酸蛋白酶活性,可以导致自身降解[36,50-52],与之相伴的是铁的快速释放来满足机体发育的需求,这代表一种新的铁释放供机体利用的途径。
3 铁蛋白作为矿质元素营养强化剂载体的研究进展
铁蛋白除了上述体内的生物学功能以外,越来越多的研究表明,铁蛋白具有第3个新的功能,其特殊的中空结构和笼形的蛋白质外壳具备作为开发为天然、形态均一的矿质元素营养强化剂的载体,通过铁蛋白作为载体的生物纳米运载体系,可以克服金属离子溶解度低、易受胃肠道环境影响的缺点,从而大大提高矿质元素的生物利用率。到目前为止,应用脱铁铁蛋白作为纳米载体的研究主要集中在运载金属离子和有机小分子方面,在脱铁铁蛋白内部储存矿质元素的方法主要有如下几种。
3.1 矿化成核储存矿质元素
铁蛋白内部空腔表面因具有大量酸性氨基酸残基而带负电,所以利用这一特点,铁蛋白壳内部形成金属氧化物或氢氧化物的矿化核(图4)[53]。已报道的金属盐离子矿化核主要有:Co(O)OH、Co3O4[54]、CdS[55]、CdSe[56]、Cr(OH)、Ni(OH)[57]、Mn(O)OH、MnO[58-59]、3334In2O3[60]、FeS[61]、ZnSe[62]、CuS[63]等。这些金属纳米颗粒可以用于单电子晶体管和浮闸内存[38]。金属核的形成过程分为两种。一种是Zn、Fe、Ca等金属离子,采用脱铁铁蛋白与金属盐溶液在一定的pH值和温度条件下发生反应,可在铁蛋白内部形成对应的金属氧化物的矿化核,透射电镜显示在铁蛋白内部形成的金属矿化核大小为约为8 nm[64],因为铁蛋白上有这些金属离子的结合位点或者氧化还原位点。另一种如CdS、ZnSe等,由于铁蛋白上没有这些金属离子的结合位点,要在其内部形成矿化核需要采用一些其他方法,利用一种缓慢释放体系,使得在外界环境中结合形成复合物的两种组分,在马脾铁蛋白内腔中形成复合物以形成金属核。以CdS的制备为例,在充入氮气的无氧环境中,向脱铁马脾铁蛋白中加入Cd2+,反应1 h后加入HS-,再反应45 min后,继续加入HS-,反应1 h,最后用缓冲液透析除去游离的Cd2+或HS-。重复此过程,使CdS颗粒在脱铁的马脾铁蛋白的空腔内成长[9,65]。

图4 脱铁铁蛋白内储存矿质元素的过程[[5533]]Fig.4 Synthetic pathways that are possible using ferritin as a constrained reaction environment[53]
3.2 肽段序列修饰或基因改造铁蛋白储存金属元素
通过这个方法使铁蛋白的蛋白壳具备结合金属离子的能力,从而在铁蛋白内部成核。以Ag[66]为例,铁蛋白自身的氨基酸序列及其三维结构中没有Ag的结合位点,利用常规方法难以制备含Ag的铁蛋白纳米颗粒。但是通过在铁蛋白亚基C末端的氨基酸序列上添加可以结合Ag+的小肽,不但不影响铁蛋白的自身组装,而且还能增加修饰后的铁蛋白对Ag+的亲和力。使得Ag+更容易结合在铁蛋白的内表面,此时再通过氧化还原手段将Ag+还原成Ag,使其在铁蛋白内部形成Ag金属,达到制备含Ag的蛋白纳米颗粒。
3.3 还原成金属单质沉积储存金属元素
主要是通过扩散的方式使金属阳离子扩散进入铁蛋白内部空腔,再利用还原剂将其还原成金属单质,从而在脱铁铁蛋白内部沉积。采用这种方法在铁蛋白内部形成的金属核主要有:Cu[67]、Pd[68]等。例如Gálvez等[67]在脱铁马脾铁蛋白内部合成金属Cu:反应体系在4℃条件下进行,pH值稳定在8.0左右,向马脾铁蛋白溶液中加入CuSO4溶液,使得Cu与马脾铁蛋白的物质的量比为2 000。二者形成的复合物通过分子筛层析色谱柱分离纯化后,向溶液中加入还原剂NaBH4,反应24 h,将铁蛋白内的Cu2+还原为铜单质。
4 铁蛋白作为矿质元素营养强化剂载体在体内的吸收途径
天然存在于动植物体内的铁蛋白由于其丰富的铁元素,因此可以作为良好的铁营养补充剂,最近的研究表明,目前铁蛋白中的铁元素在体内的吸收途径存在如下3种情况(图5)[69]:第1种情况是铁蛋白的蛋白质外壳在胃肠道中因胃酸及胃蛋白酶的水解作用,导致蛋白壳降解破坏,释放出的铁核被还原剂(如VC)还原成Fe2+,Fe2+被二价金属受体(DMT1)转运到小肠上皮细胞中,此途径是已被广泛认可;第2种情况是携带铁核的铁蛋白在胃里仍然完全被酶降解,铁核作为一个整体释放出来,达到小肠后,可能存在铁核的转运载体,直接将铁核进行吸收,此途径仅是一种假设,尚待验证;第3种情况是铁蛋白在胃里未完全降解,仍有部分完整外壳的铁蛋白,它们达到小肠后,经铁蛋白的专一受体而被吸收,铁核由于在其内部就一道被机体吸收,这个机制已越来越被大家广泛认同。Zhang Tuo等[70]的最新研究表明,装载有花青素的植物铁蛋白能够直接被小肠上的Caco-2细胞吸收,并且提高了花青素的稳定性和吸收量;Li Meiliang等[64]的最新研究也表明,装载有钙核的红小豆植物铁蛋白能够通过转铁蛋白受体(TfR1)被Caco-2细胞吸收,而且该途径钙的吸收率明显高于Caco-2细胞对游离钙离子的吸收。

图5 铁蛋白中的铁可能的吸收机制[[6699]]Fig.5 Possible mechanisms for iron uptake from ferritin[69]
铁蛋白不仅可以储存铁、钙、锌等矿质营养元素,还可以储存一些有机小分子物质[70-71],如Chen Lingli等[71]的最新研究表明,将β-胡萝卜素装载进入铁蛋白后,可以显著提高其水溶性和热稳定性。因此铁蛋白作为一个可食生物纳米载体是完全可行,其作为载体开发矿质元素营养强化剂具有现实可行性。
5 结 语
铁蛋白独特的笼形结构,使得其作为矿质元素营养强化剂的载体具有广阔的应用前景,铁、钙、锌等已被成功地装载到其内部空腔已得到验证,同时它也可以作为各种维生素的良好载体,利用其作为载体开发各种类型的营养强化剂。由于铁蛋白本身具有较好的水溶性,且将矿质元素包裹在内部空腔,因此它可以克服金属离子溶解度低、易受体系外环境或物质干扰的缺点,进而大大提高生物利用率;铁蛋白在小肠上皮细胞中具有其特有的吸收载体能被完整吸收,免受膳食因子的影响,存在于其内部空腔的营养强化剂即可不受干扰直接进入而被吸收,从而大大提高生物利用率;由于铁蛋白也是来自于可食的动植物中,其本身富含人体所需的多种必需氨基酸,具有丰富的营养,同时对矿质元素的吸收也可以起到辅助作用,因此,铁蛋白在食品领域具有广阔的应用前景。
[1]邓建军.大豆铁蛋白铁吸收和释放机理及其体外抗蛋白酶降解研究[D].北京: 中国农业大学, 2010.
[2]CHASTEEN N D, HARRISON P M.Mineralization in ferritin: an efficient means of iron storage[J].Journal of Structural Biology, 1999,126(3): 182-194.
[3]付晓苹.大豆铁蛋白的自降解机理及其生理学功能研究[D].北京:中国农业大学, 2010.
[4]陈璐璐.微量元素与糖尿病[J].中国临床营养杂志, 2002, 10(3):220-224.
[5]徐静.质子激发X线发射法分析精神异常儿童血液中的微量元素[J].国外医学地理分册, 2003, 24(2): 74-75.
[6]刘中国, 王艳燕.儿童贫血与学习能力关系的研究[J].山西医科大学学报, 2001, 32(1): 22-23.
[7]林晓明, 龙珠.维生素A与铁缺乏对小鼠免疫功能的影响[J].营养学报, 2001, 23(1): 36-38.
[8]GRADY J K, CHEN Y, CHASTEEN N D, et al.Hydroxyl radical production during oxidative deposition of iron in ferritin[J].Journal of Biological Chemistry, 1989, 264: 20224-20229.
[9]李美良.单亚基植物铁蛋白的制备、性质及铁蛋白钙复合物吸收特性研究[D].北京: 中国农业大学, 2013.
[10]NORDIN B E C.Calcium, phosphate and magnesium metabolism[M].Edinburgh: Churchill Livingston, 1976.
[11]BROWN E M.Extracellular Ca2+sensing, regulation of parathyroid cell function, and role of Ca2+and other ions as extracellular (first)messengers[J].Physiological Reviews.1991, 71(2): 371-411.
[12]BRONNER F, PANSU D.Nutritional aspects of calcium absorption[J].Journal of Nutrition, 1999, 129(1): 9-12.
[13]FULLER K E, CASPARIAN J M.Vitamin D: balancing cutaneous and systemic considerations[J].Southern Medical Journal, 2001, 94(1): 58-64.
[14]WALKER-BONE K, DENNISON E, COOPER C.Epidemiology of osteoporosis[J].Rheumatic Disease Clinics of North America, 2001,27(1): 1-18.
[15]SCHMIDT H H, LOHMANN S M, WALTER U.The nitricoxide and cGMP signal transduction system: regulation and mechanism of action[J].Biochimica et Biophysica Acta, 1993, 1178(2): 153-175.
[16]刘洪玲, 刘建军, 赵祥颖.果酸钙的研究现状及展望[J].中国食品添加剂, 2007(1): 105-113.
[17]HEANEY R P, WEAVER C M, RECKER R R.Calcium absorbability from spinach[J].Journal of the American College of Nutrition, 1988,47: 707-709.
[18]PANKAJA N, PRAKASH J.Availability of calcium from kilkeerai(Amaranthus tricolor) and drumstick (Moringa oleifera) greens in weanling rats[J].Nahrung, 1994, 38: 199-203.
[19]LI Meiliang, JIA Xiaoling, YANG Jingyun, et al.Effect of tannic acid on properties of soybean (Glycine max) seed ferritin: a model for interaction between naturally-occurring components in foodstuffs[J].Food Chemistry, 2012, 133: 410-415.
[20]刘绍军, 刘丽娜.孕妇妊娠期缺钙的原因及对策探讨[J].中国医药科学, 2011, 10(1): 53-54.
[21]王英, 胡素兰.娠期补钙补铁预防妊娠高血压疾病发生的临床分析[J].中国保健营养, 2012(4): 1-3.
[22]陆丽燕, 何明, 王伟, 等.41Ca-AMS-生物示踪的有力工具[J].生命科学, 2010, 22(2): 197-201.
[23]DEBJIT B, CHIRANJIB K P, SAMPATH K.A potential medicinal importance of zinc in human health and chronic disease[J].Journal of Pharmaceutical and Biomedical Analysis, 2010, 1: 5-11.
[24]杨晓伟.牡蛎中锌高结合量肌动蛋白的制备及其与Zn2+相互作用研究[D].北京: 中国农业大学, 2013.
[25]杜明, 赵镭, 李朝睿, 等.富硒灵芝中一种新含硒蛋白的纯化、性质及其自由基清除活性研究[J].高等化学学报, 2007, 28(1): 75-78.
[26]杨家军.富硒益生菌制剂工业化生产条件及其抑制致病性大肠杆菌的研究[D].南京: 南京农业大学, 2008.
[27]周章张, 赵国华, 周才琼, 等.铁强化剂的研究应用现状[J].中国食品添加剂, 2005(1): 95-98.
[28]HALLBERG L.Bioavailability of dietary iron in man[J].Annual Review of Nutrition, 1981, 1: 123-147.
[29]YANG Rui, YANG Senpei, LIAO Xiayun, et al.The interaction of DNA with phytoferritin during iron oxidation[J].Food Chemistry,2014, 153: 292-297.
[30]LIAO Xiayun, LÜ Chenyan, ZHANG Xiuqing, et al.A novel strategy of natural plant ferritin to protect DNA from oxidative damage during iron oxidation[J].Free Radical Biology and Medicine, 2012, 53(2):375-382.
[31]刘娅, 韩新年.天然补铁剂: 血红素铁的研究进展[J].中国食品添加剂, 2005(4): 5-8.
[32]YANG Senpei, BAI Guangling, CHEN Lingli, et al.The interaction of phenolic acids with Fe(III) in the presence of citrate as studied by isothermal titration calorimetry[J].Food Chemistry, 2014, 157: 302-309.
[33]MASUDA T, GOTO F, YOSHIHARA T, et al.Crystal structure of plant ferritin reveals a novel metal binding site that functions as a transit site for metal transfer in ferritin[J].The Journal of Biological Chemistry, 2010, 285: 4049-4059.
[34]赵广华, 云少君.植物铁蛋白结构、性质及其在纳米材料制备中的应用[J].山西大学学报, 2012, 35(2): 285-292.
[35]ZHAO Guanghua.Phytoferritin and its implications for human health and nutrition[J].Biochimica et Biophysica Acta, 2010, 1800(8): 815-823.
[36]FU Xiaoping, DENG Jianjun, YANG Haixia, et al.A novel EP-involved pathway for iron release from soybean seed ferritin[J].Biochemical Journal, 2010, 427: 313-321.
[37]陈盈盈, 黄琳, 季雪涛, 等.用圆二色性和荧光光谱技术研究纳米吡啰红G核-铁蛋白的构建机理[J].高等化学学报, 2010, 13(5): 896-904.
[38]YAMASHITA I, IWAHORI K, KUMAGAI S, et al.Ferritin in the field of nanodevices[J].Biochimica et Biophysica Acta, 2010, 1800(8):846-857.
[39]HARRISON P M, AROSIO P.Ferritins: Molecular properties, iron storage function and cellular regulation[J].Biochimica et Biophysica Acta, 1996, 1275: 161-203.
[40]BOU-ABDALLAH F, ZHAO Guanghua, BIASIOTTO G.Facilitated diffusion of iron(II) and dioxygen substrates into human H-chain ferritin.A fluorescence and absorbance study employing the ferroxidase center substitution Y34W[J].Journal of the American Chemical Society, 2008, 130: 17801-17811.
[41]LI Chaorui, FU Xiaoping, QI Xin, et al.Protein association and disassociation regulated by ferric ion.A novel pathway for oxidative deposition of iron in pea seed ferritin[J].The Journal of Biological Chemistry, 2009, 284: 16743-16751.
[42]LI Meiliang, YUN Shaojun, YANG Xiuli, et al.Stability and iron oxidation properties of a novel homopolymeric plant ferritin from adzuki bean seeds: a comparative analysis with recombinant soybean seed H-1 chain ferritin[J].Biochimica et Biophysica Acta, 2013, 1830:2946-2953.
[43]YUN Shaojun, YANG Senpei, HUANG Luyao, et al.Isolation and characterization of a new phytoferritin fro m broad bean (Vicia faba)seed with higher stability compared to pea seed ferritin[J].Food Research International, 2012, 48: 271-276.
[44]RAVET K, TOURAINE B, BOUCHEREZ J, et al.Ferritins control interaction between iron homeostasis and oxidative stress in Arabidopsis[J].The Plant Journal, 2009, 57: 400-412.
[45]胡菊, 廖夏云, 邓建军, 等.黄豆铁蛋白提取新方法及其与豌豆铁蛋白活性比较[J].高等学校化学学报, 2009, 30(10): 2003-2008.
[46]ZHAO Guanghua, BOU-ABDALLAH F, AROSIO P, et al.Multiple pathways for mineral core formation in mammalian apoferritin: the role of hydrogen peroxide[J].Biochemistry, 2003, 42: 3142-3150.
[47]ZHAO Guanghua, SU Meihong, CHASTEEN N D.μ-1,2-Peroxo diferric complex formation in horse spleen ferritin: a mixed H/L-subunit heteropolymer[J].Journal of Molecular Biology, 2005, 352: 467-477.
[48]BOU-ABDALLAH F, ZHAO Guanghua, MAYNE H R, et al.Origin of the unusual kinetics of iron deposition in human H-chain ferritin[J].Journal of the American Chemical Society, 2005, 127: 3885-3893.
[49]ZHAO Guanghua, AROSIO P, CHASTEEN N D.Iron(II) and hydrogen peroxide detoxification by human H-chain ferritin.An EPR spin-trapping study[J].Biochemistry, 2006, 45: 3429-3436.
[50]ZHANG Tuo, LIAO Xiayun, YANG Rui, et al.Different effects of iron uptake and release by phytoferritin on starch granules[J].Journal of Agricultural and Food Chemistry, 2013, 61: 8215-8223.
[51]LÜ Chenyan, BAI Yufei, YANG Senpei, et al.NADH induces iron release from pea seed ferritin: a model for interaction between coenzyme and protein components in foodstuffs[J].Food Chemistry,2013, 141(4): 3851-3858.
[52]DENG Jianjun, LI Meiliang, ZHANG Tuo, et al.Binding of proanthocyanidins to soybean (Glycine max) seed ferritin inhibiting protein degradation by protease in vitro[J].Food Research International, 2011, 44(1): 33-38.
[53]KLEM M T, YOUNG M, DOUGLAS T.Biomimetic magnetic nanoparticles[J].Materials Today, 2005, 8: 28-37.
[54]DOUGLAS T, STARK V T.Nanophase cobalt oxyhydroxide mineral synthesized within the protein cage of ferritin[J].Inorganic chemistry,2000, 39: 1828-1830.
[55]WONG K K W, MANN S.Biomimetic synthesis of cadmium sulfideferritin nanocomposites[J].Advanced Materials, 2004, 8: 928-932.
[56]YAMASHITA I, HAYASHI J, HARA M.Bio-template synthesis of uniform CdSe nanoparticles using cage-shaped protein, apoferritin[J].Chemistry Letters, 2004, 33: 1158-1159.
[57]OKUDA M, IWAHORI K, YAMASHITA I, et al.Fabrication of nickel and chromium nanoparticles using the protein cage of apoferritin[J].Biotechnology and Bioengineering, 2003, 84: 187-194.
[58]MACKLE P, CHARNOCK J M, GARNER C D, et al.Characterization of the manganese core of reconstituted ferritin by X-ray absorption spectroscopy[J].Journal of the American Chemical Society, 1993,115: 8471-8472.
[59]MELDRUM F C, DOUGLAS T, LEVI S, et al.Reconstitution of manganese oxide cores in horse spleen and recombinant ferritins[J].Journal of Inorganic Biochemistry, 1995, 58: 59-68.
[60]OKUDA M, KOBAYASHI Y, SUZUKI K, et al.Self-organized inorganic nanoparticle arrays on protein lattices[J].Nano Letters,2005, 5: 991-993.
[61]DOUGLAS T, DICKSON D, BETTERIDGE S, et al.Synthesis and structure of an iron (iii) sulfide-ferritin bioinorganic nanocomposite[J].Science, 1995, 269: 54-57.
[62]IWAHORI K, YOSHIZAWA K, MURAOKA M, et al.Fabrication of ZnSe nanoparticles in the apoferritin cavity by designing a slow chemical reaction system[J].Inorganic Chemistry, 2005, 44: 6393-6400.
[63]IWAHORI K, TAKAGI R, KISHIMOTO N, et al.A size controlled synthesis of CuS nano-particles in the protein cage, apoferritin[J].Materials Letters, 2011, 65: 3245-3247.
[64]LI Meiliang, ZHANG Tuo, YANG Haixia, et al.A novel calcium supplement prepared by phytoferritin nanocages protects against absorption inhibitors through a unique pathway[J].Bone, 2014, 64:115-123.
[65]WONG K K W, DOUGLAS T, GIDER S, et al.Biomimetic synthesis and characterization of magnetic proteins (magnetoferritin)[J].Chemistry of Materials, 1998, 10: 279-285.
[66]KRAMER R M, LI C, CARTER D C, et al.Engineered protein cages for nanomaterial synthesis[J].Journal of the American Chemical Society, 2004, 126: 13282-13286.
[67]GÁLVEZ N, FERNANDEZ B, VALERO E, et al.Apoferritin as a nanoreactor for preparing metallic nanoparticles[J].Comptes Rendus Chimie, 2008, 11: 1207-1212.
[68]UENO T, SUZUKI M, GOTO T, et al.Size-selective olefin hydrogenation by a pd nanocluster provided in an apo-ferritin cage[J].Angewandte Chemie, 2004, 116: 2581-2584.
[69]LÖNNERDAL B.Soybean ferritin: implications for iron status of vegetarians[J].The American Journal of Clinical Nutrition, 2009, 89:1680S-1685S.
[70]ZHANG Tuo, LÜ Chenyan, CHEN Lingli, et al.Encapsulation of anthocyanin molecules within a ferritin nanocage increases their stability and cell uptake efficiency[J].Food Research International,2014, 62: 183-192.
[71]CHEN Lingli, BAI Guangling, YANG Rui, et al.Encapsulation of β-carotene within ferritin nanocages greatly increases its water-solubility and thermal stability[J].Food Chemistry, 2014, 149: 307-312.
