菜籽蛋白水解物体外和细胞内抗氧化性评价及氨基酸分析研究
2014-01-30王立峰王玉梅谢慧慧鞠兴荣
王立峰,王玉梅,张 晶,谢慧慧,鞠兴荣
(南京财经大学食品科学与工程学院,江苏 南京 210023)
我国油菜种植面积和总产量占世界30%左右,居于世界首位[1]。油菜籽是重要的植物蛋白质资源,去油后的菜籽饼粕中约含有30%~45%的蛋白质,菜籽蛋白主要由12S球蛋白和2S清蛋白组成[2]。以菜籽蛋白为原料可通过降解得到小分子的菜籽多肽,某些小分子菜籽肽吸收快、耗能低、吸收率高,并且在抗氧化、降血压、抗肿瘤等方面显示重要的生物活性[3]。郭兴凤等[4]研究表明菜籽蛋白的酶水解产物具有抗氧化活性;薛照辉等[5]利用双酶分步水解菜籽清蛋白后,经Sephadex G-25凝胶层析柱分离纯化,得到分子质量降级的3个组分,经过实验表明,这些菜籽肽具有较强的还原能力及抑制羟自由基(•OH)的作用;Yoshie-Stark等[6]以菜籽分离蛋白为底物经酶水解后得到的菜籽多肽具有显著的1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力。有研究学者认为[7],菜籽肽由于富含供氢体,所以具有提供氢质子的能力,使具有高度氧化性的自由基还原,从而能终止自由基连锁反应,起到清除或抑制自由基的作用。目前评价抗氧化活性最为简便、灵敏的为抗氧化自由基吸收能力法[8](oxygen radical absortion capacity,ORAC)。Wolf等[9]建立了细胞内测定抗氧化活性的方法(cellular antioxidant capacity,CAA),从细胞层次上反映抗氧化剂的吸收代谢的情况。本实验主要是用碱性蛋白酶水解菜籽蛋白后通过聚丙烯酰胺葡聚糖凝胶柱(Sephacryl S-100HR)分级得到不同组分的菜籽蛋白水解物(rapeseed protein hydrolysates,RPHs),通过体外ORAC和细胞内CAA两种抗氧化评价方法分析各组分RPHs的抗氧化性,筛选出抗氧化性较高的组分,并对其进行氨基酸分析,确定组分中氨基酸组成,为后续菜籽肽功能性的机理研究提供一定的基础。
1 材料与方法
1.1 材料与试剂
HepG2人体肝癌细胞 上海细胞库;甘蓝型“双低”油菜籽秦优7号,购于江苏省农业科学院种子公司,样品脱壳后,石油醚索氏抽提去脂,通风橱中平铺晾干,旋风磨粉碎过100 目筛后备用。
Sephacryl S-100HR凝胶填料 美国GE公司;多肽聚丙烯酰胺凝胶电泳分子质量标准物 美国Bio-Rad公司;Alcalase 2.4L 丹麦诺维信公司;N,N’-甲叉双丙烯胺、Tris、过硫酸铵、十二烷基硫酸钠(sodium dodecylsulfate,SDS)、N,N,N’,N’-四甲基二乙胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、丙烯酰胺(acrylamide,Acr)、两性离子缓冲液(Tricine)、考马斯亮蓝R-250、溴酚蓝和β-巯基乙醇、荧光素钠盐(fluorescein sodium salt,FL)、自由基产生剂AAPH(2,2’-azobis-2-amidinopropanedihydrochloride)、抗氧化标准物质水溶性VE(6-hydroxy-2, 5, 7, 8-tetramethylchroman-2-carboxylic acid,Trolox)、二甲基亚砜(dimethyl sulfoxide,DMSO)美国Sigma公司;胎牛血清(fetal bovine serum,FBS)、双抗(青霉素10 000 U/mL,链霉素10 000 U/mL)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、DMEM高糖培养基、胰蛋白酶消化液(0.25%)、Hank平衡盐溶液(Hank’s balanced salt solution,HBSS)等细胞培养试剂 美国Gibco生物技术公司。
1.2 仪器与设备
E-812索氏抽提装置 南京晚晴化玻仪器有限公司;Beckman Coulter J6冷冻离心机 美国Beckman Coulter公司;FreeZone 2.5L台式冷冻干燥机 美国Labconco公司;Mini-P4微型垂直电泳仪 美国Bio-Rad公司;Millipore Pellicon XL小型超滤装置 美国Merck Millipore公司;SpectraMax M2e酶标仪 美国Molecular Devices公司;HERAcell 150i二氧化碳培养箱、MSCAdvantage-1.2生物安全柜 美国Thermo Scientific公司;HL-2恒流泵、HD-3紫外检测仪、BSZ-100自动收集器、XWT-S小型台式记录仪 上海沪西分析仪器厂。
1.3 方法
1.3.1 RPHs的制备
按照本实验室的方法制备。称100 g菜籽粉溶于2 000 mL的蒸馏水,调pH值为11左右,室温搅拌1 h后于4 000×g离心分离10 min,收集上清液。调节上清液的pH值为4.5,静置30 min,4 000×g离心分离10 min后弃上清液,用95%的乙醇洗涤沉淀2次,冷冻干燥得菜籽蛋白。取20 g按上述步骤所得到的菜籽蛋白溶于400 mL蒸馏水中,调节pH值为9,加入400 μL的碱性蛋白酶酶解液,温度控制在50℃,酶解过程维持pH值不变,5 h后水浴灭酶15 min,冷却后调pH值至4.5,30 min后,离心分离20 min(4℃,10 000×g),收集上清液,将其pH值调至7.0,过0.45 μm微滤膜,冷冻干燥后得RPHs。
1.3.2 Sephacryl S-100HR过滤
将得到的RPHs配成0.01 g/mL的溶液,经过由层析柱、恒流泵、自动部分收集器和紫外检测器组成的液相色谱分离层析系统,于紫外波长280 nm、洗脱流速60 mL/h的条件下先后收集得到3个不同的组分的菜籽肽,冷冻干燥后储存于-20℃,备用。
1.3.3 菜籽肽各级分的抗氧化能力指数ORAC分析
参照文献[10]方法,反应于96 孔板中进行,每个孔加入20 μL RPHs样品溶液(质量浓度为0.04 mg/mL)或者20 μL不同质量浓度的Trolox标准品,RPHs各级分样品用75 mmol/L的磷酸缓冲液稀释,之后加入200 μL的荧光指示剂(0.96 μmol/L),在酶标仪中温育后(37℃,15 min),每孔再加入20 μL现配的119 mmol/L偶氮二异丁脒盐酸盐(2,2’-azobis(2-methylpropionamide)dihydrochloride,ABAP),于波长485 nm处激发,每5 min在波长520 nm处释放测定。各样品组均设3~5个复孔。ORAC值用Trolox当量(μmol TE/g)表示。
1.3.4 Hep G2细胞的MTT毒性实验
取对数生长期Hep G2细胞,于96 孔中每孔接种104个细胞,细胞液的加入量为100 μL,于37℃、5%的CO2细胞培养箱中培养24 h后,弃去培养液,向每孔中加入100 μL不同质量浓度的样品,每个质量浓度均设5个复孔,继续培养24 h,于每孔中再加入20 μL的MTT(5 mg/mL),培养4 h后吸出旧的培养液,加入150 μL的DMSO,37℃条件下轻微振荡30 min,待充分溶解形成深蓝色结晶后,于酶标仪波长570 nm处测定OD值,对照组以等体积细胞培养液代替样品溶液。按照公式(1)计算细胞存活率。

式中:OD1为样品光密度值;OD0为对照组光密度值。
1.3.5 细胞抗氧化活性实验
采用文献[11]的方法进行细胞抗氧化活性实验,于96 孔板上按密度6×104个/每孔接种Hep G2细胞,细胞液加入量为100 μL,于细胞培养箱中(37℃、5% CO2)培养24 h后弃去旧培养液,用PBS清洗接种孔,再加入100 μL RPHs样品处理液(用同等体积的样品稀释液:25 μmol/L二氯荧光黄二乙酸酯(dichlorofluorescin diacetate,DCFH-DA)稀释),继续培养1 h后弃去旧的培养液,加入100 μL的600 μmol/L的ABAP,放入荧光酶标仪中读数,于恒温37℃,波长538 nm处激发,每5 min在波长485 nm处释放测定1 h。参照公式(2)计算细胞抗氧化能力。

式中:∫SA表示RPHs样品曲线下的积分面积;∫CA表示对照组曲线下的积分面积。样品的半数有效浓度(EC50)以lg(ƒa/ƒu)对lgρ的中效原理来计算,这里ƒa表示样品作用效应(CAA),ƒu表示1-CAA,ρ表示RPHs质量浓度。EC50值以3次平行实验计算得出,将EC50值转化为CAA值,以每克样品中相当于槲皮素的微摩尔当量来表示。
1.3.6 统计分析
相关性分析采用SPSS17.0软件中的Correlate进行分析。样品间差异显著性采用SPSS17.0软件中单因素方差分析中的最小显著性检验和Duncan’s多重比较分析,显著水平设为P<0.05。
1.3.7 RPHs各级分的凝胶电泳
电泳凝胶及缓冲液的配制参照文献[12]中Tricine-SDS-PAGE的配制方法,并做适当修改,采用16.5%分离胶和5%的浓缩胶。具体方法如下:将通过Sephacryl S-100HR凝胶柱的RPHs各级分配成10 mg/mL的溶液,与样品缓冲液按体积1∶1混合,100℃煮沸5 min,上样量为10 μL,电压100 V,时间为2~3 h后于固定液中固定20 min,考马斯亮蓝G-250染色30 min,过夜脱色,待胶片背景蓝色呈透明状时拍照,观察并分析RPHs各级分的分子质量分布。
1.3.8 氨基酸组分分析
在10 mL玻璃水解管中称取RPHs样品后,加入6 mol/L的盐酸,用氮气置换并在减压状态下使用酒精喷灯迅速封管,在110℃条件下水解反应24 h;反应结束后打开水解管,浓缩水解液,用0.02 mol/L的盐酸溶解后用去离子水稀释至50 mL;然后以1 500 r/min 离心5 min,所得上清液过0.22 μm滤器后移入2 mL样品瓶中,采用氨基酸自动分析仪中进行氨基酸组分分析。
2 结果与分析
2.1 RPHs的分离纯化
RPHs的样品液(0.01 g/mL)于60 mL/h的洗脱流速,波长2 8 0 n m的紫外检测条件下经过Sephacryl S-100HR凝胶柱层析分离,按照洗脱时间和紫外检测的OD280nm值作图,可以得到3个洗脱峰,如图1所示。分别收集所得到的3个组分,冷冻干燥后进行抗氧化分析。

图1 Sephacryl S-100HR纯化RPHs的柱层析图Fig.1 Column chromatography of RPHs on Sephacryl S-100HR
2.2 RPHs及其各组分的ORAC分析
ORAC法是目前评价抗氧化物质抗氧化活性的较为简单、有效、灵敏度高、应用范围广的方法之一,提供了稳定、可控的自由基,这些自由基与生物活动产生中的自由基相一致[13]。近年来的研究发现多通道液体处理系统和微孔板分析仪的使用所测定的实验结果更准确,实现了ORAC测定的自动化及高通量化,分析效率提高[14]。此方法已应用于生物样品、水果蔬菜和果汁饮料等多种样品的体内、外抗氧化能力分析。本研究中,RPHs及凝胶柱分离的各组分的ORAC值见图2。
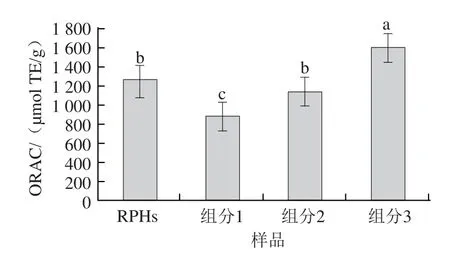
图2 RPHs与凝胶分离菜籽肽各组分的抗氧化能力Fig.2 Antioxidant activities of three fractions of RPHs
由图2可知,同其他的RPHs组分相比,组分3的ORAC值最高,达到(1 610.38±112.51)μmol TE/g。其体外抗氧化性显著高于其他组分和原始蛋白水解物。曹亚兰等[15]以ORAC值为评价指标来制备大豆抗氧化肽,结果发现,大豆蛋白经Alcalase酶解产物的ORAC最高值可达1 900.48 μmol TE/g,与本实验组分3的抗氧化性差别不大。
2.3 RPHs及其各组分对细胞毒性的影响
验证RPHs及各组分对Hep G2细胞的抑制作用是源于其潜在的细胞毒性,本研究采用MTT的方法测定了RPHs和各组分对Hep G2细胞是否具有细胞毒性作用。配制25~400 mg/L质量浓度的RPHs培养Hep G2细胞24 h后,通过与对照组细胞的OD570nm值的变化可以比较测定出样品的细胞毒性,结果见图3。

图3 RPHs及凝胶柱分离各组分对细胞毒性的影响Fig.3 Cytotoxicity of RPHs and three fractions using MTT assay
由图3可知,RPHs各组分中200、400 mg/L的质量浓度组可以显著抑制HepG2细胞的增殖;当质量浓度为400 mg/L时,样品各组分都显示了一定的细胞毒性,细胞存活率降为70%左右;当质量浓度为200 mg/L时,RPHs和组分1产生了较强的细胞毒性。组分2和组分3处理的细胞组在25~200 mg/L质量浓度范围,细胞存活率均达到75%以上,表明无明显的细胞毒性;因此,在后续实验中将以此范围作为依据,作为无细胞毒性的使用剂量。
2.4 RPHs及各组分的细胞抗氧化分析
本实验中细胞抗氧化能力的测定是直接采用不使用PBS清洗的测定方法,即加入RPHs及各组分样品培养1 h后,不使用PBS清洗细胞孔,直接加入含有ABAP的处理液进行荧光检测。RPHs及各组分细胞抗氧化能力的EC50值见图4。RPHs及其各组分抗氧化性差异显著,其中组分1的EC50最高,为(187.39±21.71)μg/mL,组分3的EC50的最低,为(57.84±3.38)μg/mL,组分3的抗氧化效果最好。

图4 RPHs及凝胶柱分离各组分细胞抗氧化的EC5500值Fig.4 EC50 values of RPHs and three fractions

图5 RPHs及凝胶柱分离各组分细胞抗氧化CAA值Fig.5 CAA values of RPHs and three fractions
RPHs及各组分的细胞抗氧化CAA值见图5。经过比较可看出组分3的CAA值最高为(124.66±2.18)μmol QE/g,相对应的组分1的CAA值最低为(28.96±0.31)μmol QE/g。
2.5 相关性分析
对RPHs及各组分的ORAC值和CAA值之间的相关性进行分析,其Pearson相关系数为0.838,相关系数的显著水平为0.001,说明细胞内抗氧化活性(CAA法)和体外抗氧化活性(ORAC法)两者之间具有极显著的相关性(P<0.05)。
2.6 RPHs及各组分的Tricine-SDS-PAGE电泳

图6 RPHs及各组分的凝胶电泳图Fig.6 Electrophoretic patterns of RPHs and three fractions
图6反映出RPHs及各组分的分子质量的排布,组分3的分子质量集中在1 423~3 496 D之间,组分2的分子质量则集中在6 512~14 437、1 423~3 496 D之间,组分1的分子质量集中在26 625 D上下,RPHs的分子质量主要集中在26 625、6 512~14 437、3 496 D这3个范围。由以上实验可看出不同组分RPHs的ORAC值变化规律与CAA值相同,其抗氧化活性大小表现为:组分3>RPHs>组分2>组分1。其中组分3显示较强的抗氧化性,其分子质量分布集中在1 423~3 496 D之间。有研究结果也显示了蛋白降解物的抗氧化性与它们的分子质量分布有着一定的关系[16-17]。Xie等[18]水解苜蓿叶蛋白得到的抗氧化肽的分子质量主要集中在1 000 D以下。Li等[19]通过水解鹰嘴豆蛋白得到抗氧化活性较高的组分的分子质量集中在940~2 622 D之间和220~940 D之间。这些结果都表明肽的分子质量分布与其抗氧化活性有着内在的联系。
2.7 氨基酸组分分析
由ORAC和CAA实验得出组分3的抗氧化性明显大于其他各组分和RPHs样品,对抗氧化性最好的组分3进行氨基酸分析。氨基酸分析结果见表1,可知组分3中Glu、Gly、Ala、Tyr、Pro等氨基酸的含量较高。多肽的抗氧化活性的强弱与氨基酸组成、种类、疏水性以及在肽链中的位置有关[20-21],研究发现Cys、Met、Tyr、Lys、Arg、Glu、Asp、Ser、Pro、Phe、Ala以及His都是具有一定抗氧化活性的氨基酸,它们在序列中出现能够不同程度的增强多肽抗氧化特性[22-23]。此外,组分3中必需氨基酸占总含量的18.23%,因此也具有比较高的营养价值。

表1 组分3的氨基酸组分分析Table1 Amino acid composition of fraction 3
3 结 论
本实验研究了RPHs及凝胶过滤各组分的抗氧化能力分析,利用体外抗氧化法(ORAC)和细胞内抗氧化法(CAA)评价其抗氧化性。结果表明,ORAC值与CAA值具有相同变化规律,其抗氧化活性大小表现为:组分3>RPHs>组分2>组分1。其中组分3抗氧化活性最强,其分子质量集中处于1 423~3 496 D之间,除此之外,菜籽蛋白水解物的抗氧化活性可能还与其氨基酸组成有关。
[1]MURRAY D.Rapeseed: a potential global source of high quality plant protein[J].Asia Pacific Food Industry, 2001, 4: 30-34.
[2]黄亮, 冯菲, 郑菲.油菜籽饼粕中蛋白和肽的制取[J].中国粮油学报,2009, 24(9): 119-123.
[3]刘清, 谢奇珍, 师建芳.菜籽蛋白活性肽研究[J].粮食与油脂,2008(3): 4-6.
[4]郭兴凤, 付元, 王炯烨, 等.菜籽蛋白酶水解产物抗氧化活性研究[J].郑州工程学院学报, 2004, 25(2): 37-39.
[5]薛照辉, 吴谋成, 严奉伟, 等.菜籽清蛋白小分子肽的制备[J].食品科学, 2006, 27(3): 104-107.
[6]YOSHIE-STARK Y, WADA Y, SCHOTT M, et al.Functional and bioactive properties of rapeseed protein concentrates and sensory analysis of food application with rapeseed protein concentrates[J].LWT-Food Science and Technology, 2006, 39(5): 503-512.
[7]汪一凡.菜籽肽的生物活性与构象研究[D].天津: 天津大学, 2010.
[8]ADOM K K, SORRRELLS M E, LIU R H.Phytochemical profiles and antioxidant activity of wheat varieties[J].Journal of Agricultural and Food Chemistry, 2003, 51(26): 7825-7834.
[9]WOLF K L, KANG X M, HE X J, et al.Cellular antioxidant activity of common fruits[J].Journal of Agricultural and Food Chemistry,2010, 58(11): 6621-6629.
[10]HUANG D J, OU B X, HAMPSCH-WOODILL M, et al.Highthroughput assay of oxygen radical absorbance capacity (ORAC)using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J].Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444.
[11]ADOM K K, LIU R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry, 2002, 50(21): 6182-6187.
[12]邓开凤, 黄元姣.Tricine-SDS-PAGE分离鼻咽癌血清多肽的方法初探[J].南昌大学学报, 2010, 50(11): 83-88.
[13]HE R, ALASHI A, MALOMO S A, et al.Antihypertensive and free radical scavenging properties of enzymatic rapeseed protein hydrolysates[J].Food Chemistry, 2013, 141(1): 153-159.
[14]RAY P D, HUANG B W, TSUJI Y.Reactive oxygen species (ROS)homeostasis and redox regulation in cellular signaling[J].Cellular Signalling, 2012, 24(5): 981-990.
[15]曹亚兰, 赵谋明, 郑赛晶, 等.以ORAC法为评价指标优化制备大豆抗氧化肽[J].食品与发酵工业, 2011, 37(10): 73-77.
[16]WANG J S, ZHAO M M, ZHAO Q Z, et al.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Food Chemistry, 2007, 101(4): 1658-1663.
[17]GUO H, KOUZUMA Y, YONEKURA M.Structures and properties of antioxidant peptides derived from royal jell protein[J].Food Chemistry, 2009, 113(1): 238-245.
[18]XIE Z J, HUANG J R, XU X M, et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008, 111(2): 370-376.
[19]LI Y H, JIANG B, ZHANG T, et al.Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate (CPH)[J].Food Chemistry, 2008, 106(2): 444-450.
[20]YANG B, YANG H S, LI J, et al.Amino acid composition, molecular weight distribution and antioxidant activity of protein hydrolysates of soy sauce lees[J].Food Chemistry, 2011, 124(2): 551-555.
[21]CHEN H M, MURAMOTO K, YAMAUCHI F, et al.Antioxidant propertied of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53.
[22]TRIANTIS T M, YANRNAKOPOULOU E, NIKOK A, et al.Chemiluminescent studies on the antioxidant activity of amino acids[J].Analytic Chimica Acta, 2007, 591(1): 106-111.
[23]WANG W Y, de MEIJIA E G.A new frontier in soy bioactive peptides that may prevent age-related chronic diseases[J].Comprehensive Reviews in Food Science and Food Safety, 2005, 4(4): 63-68.
