蜂胶中多酚类成分分析及其抗氧化活性
2014-01-30张红城赵亮亮
张红城,赵亮亮,胡 浩,董 捷*
(中国农业科学院蜜蜂研究所,国家农产品加工中心蜂产品加工分中心,北京 100093)
蜂胶是蜜蜂从胶原植物的嫩芽处采集的树脂,并混入蜜蜂上颚腺的分泌物及蜂蜡、少量花粉等加工而成的,一种具有芳香气味和黏性的胶状固体物质[1]。蜂胶具有很多功能活性[2],一群蜂一年内只能生产100~150 g蜂胶,因而蜂胶被誉为“紫色黄金”[3]。
蜂胶中主要活性成分是多酚类物质[4],不同蜂胶因采集植物、蜜蜂种群、时间、地点等的不同[5-7],其化学成分也不尽相同,导致其功能活性也会有一定的差异。许多研究表明蜂胶具有很好的抗氧化作用,与一些疾病(如高血脂、糖尿病、老年痴呆症等)的预防也有一定关系。近10 年来,氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)法被美国农业部、美国国立卫生院、美国宇航局等众多科研机构认定为衡量食品抗氧化能力的标准分析方法。目前ORAC法已广泛使用在评估食品的抗氧化能力上,但使用ORAC方法评估蜂胶体外抗氧化能力的研究却很少。细胞模型能够阐明细胞吸收、运输和代谢中的一些问题[7],因此为研究细胞水平抗氧化能力提供了一种经济、快速的方法。
本实验以9个蜂胶样品为原料,采用超声波辅助75%乙醇水溶液法进行提取。利用高效液相色谱-二极管阵列检测器(high performance liquid chromatography-diode array detector,HPLC-DAD)检测蜂胶中的多酚类成分,通过ORAC法和Hep G2细胞模型法评估不同地区蜂胶的抗氧化能力并研究蜂胶成分和抗氧化能力之间的关系。
1 材料与方法
1.1 材料与试剂
9个蜂胶样品由中国农业科学院蜜蜂研究所提供,分别来自河南新野(1号样品)、河南拓城(2号样品)、河北故城(3号样品)、河北方城(4号样品)、北京蜜蜂所(5号样品)、北京延庆(6号样品)、山西灵石(7号样品)、黑龙江宝清(8号样品)和甘肃天水(9号样品),均由农业部蜂产业体系综合试验站的当地蜂场在2012年7—8月分别采集。将所有的蜂胶样品置于-20℃条件下冷冻,待其变硬变脆后,快速转移到中草药粉碎机粉碎,粉碎后置于封口袋,-70℃冷冻贮存,待用。
3,4-二羟基苯甲醛、咖啡酸、香兰素、p-香豆酸、阿魏酸、异阿魏酸、苯甲酸、芦丁、3,4-二甲氧基肉桂酸、杨梅酮、肉桂酸、桑色素、短叶松素、槲皮素、山姜素、山奈酚、亚桂皮乙酸、芹菜素、异鼠李素、松属素、柯因、咖啡酸苯乙酯、高良姜素、山奈素、球松素、柚木柯因、肉桂酸肉桂酯、香草酸、4-甲氧基肉桂酸、水杨苷、水杨醇、水杨酸等,均为色谱纯;磷酸二氢钾、磷酸氢二钾、氢氧化钠、无水乙醇,均为分析纯;Trolox、荧光素(fluorescein,FL)、偶氮二异丁脒盐酸盐(2,2’-azobis(2-methylpropionamide)dihydrochloride,ABAP)、封板膜、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、细胞培养级二甲基亚砜(dimethyl sulfoxide,DMSO)、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCFH-DA) 美国Sigma公司;5-甲氧基短叶松素、短叶松素-3-乙酸酯 实验室自制;甲醇(色谱纯) 美国Fisher公司;甲基化-β-环糊精 比利时Acros公司;DMEM高糖培养基、磷酸盐缓冲液Hanks洗液 北京索莱宝科技有限公司;0.25 g/100 mL胰酶-EDTA消化液 美国Gibco公司;6孔、96孔细胞培养板 美国Corning-Costar公司;Hep G2(人肝癌细胞株) 中国科学院细胞库。
1.2 仪器与设备
WK-600A高速粉碎机 青州市精诚医药装备制造有限公司;AL204型分析天平 瑞士梅特勒-托利多(上海)仪器有限公司;Milli-Q Intergral纯水/超纯水一体化系统 美国Merk Millipore公司;KQ-50DB型数控超声波清洗器 昆山市超声仪器有限公司;微量移液器、5417R型冷冻离心机 德国Eppendorf公司;HZS-H型水浴摇床 哈尔滨市东明医疗仪器厂;SY21-K型电热恒温水浴锅 北京长风仪器仪表公司;LGJ-12真空冷冻干燥机 北京松源华兴科技发展有限公司;LC-6AD高效液相色谱仪(配有二极管阵列紫外检测器,CTO-10A柱温箱,SIL-自动进样器,LCsolution数据处理系统)日本岛津公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;Synergy TM HT型多功能酶标仪 美国Biotek公司;HERA-Cell 150CO2培养箱 美国Thermo公司;IX71型荧光倒置显微镜 日本Olympus公司;Cell QuantaTM流式细胞仪(488 nm激光) 美国Beckman公司。
1.3 方法
1.3.1 蜂胶75%乙醇提取物的制备
准确称取500 mg已粉碎的蜂胶样品,置于50 mL已称重的具塞锥形瓶中,分别加入10 mL 75%乙醇。40℃、100 r/min水浴摇床中提取24 h。每6 h取出锥形瓶并于超声波清洗器中,超声1 h,共超声4次。提取结束后,离心收集不同蜂胶提取液。之后取500 μL置用甲醇稀释7.5倍,经0.22 μm微孔膜过滤,待用。
1.3.2 混合标准品溶液配制
准确称取一定质量的标准品,用色谱甲醇将其超声溶解,将其配制成一定浓度的标准品储备液。根据各种标准品的出峰时间及强度,进行相应的混合。利用混合标准品工作液进行下面的色谱定性和定量分析。
1.3.3 HPLC的分析条件
Shim-Pack PREP-ODS(250 mm×4.6 mm,5 μm)色谱柱;柱温:35℃;检测波长:280 nm;流速:0.65 mL/min;进样量10 μL;流动相:B相,甲醇(含0.1%乙酸);A相,0.1%乙酸水溶液。所用的梯度洗脱程序如下:0~10 min,25%~27% B;10~45 min,27%~37% B;45~58 min,37%~49% B;58~80 min,49% B;80~125 min,49%~72% B;125~150 min,72%~85% B[8-10]。
1.3.4 样品中各组分的定量
取上述配制的混合标准品工作液,按1.3.3节色谱条件,分别以1、5、10、15、20、25 μL进样量,依次进样分析。以对照品的进样量(X,μg/L)对峰面积Y进行线性回归分析,得出各个组分的标准曲线。由标准曲线分别计算出各个产地蜂胶中各组分的含量。总黄酮含量是指已定量的黄酮类成分的含量总和;总酚酸含量是指已定量的醛类、酚酸及其酯类成分的含量总和;总多酚含量是指已定量所有成分的含量总和。
1.3.5 ORAC值测定
吸取20 μL的稀释后的样品液或空白液(缓冲液)或者Trolox标准物质溶液(6.25、12.5、25、50、100 μmol/L)加入至96 孔板(荧光测定专用)中,于每个加样孔中加入150 μL浓度为8.16×10-2μmol/L荧光素(FL)溶液,覆膜,然后在37℃酶标仪中孵育10 min。最后加入30 μL 153 mmol/L ABAP(自由基产生剂)启动反应,迅速覆膜,使用荧光酶标仪进行测定。酶标仪测定条件为:激发波长485 nm,发射波长528 nm,首先振荡5 s,然后测定,每分钟测定1次,总测定时间为50 min[11]。
ORAC值采用美国农业部的单位,即μmol Trolox当量/100 g样品。ORAC值越高,代表其抗氧化能力越强。
抗氧化能力= AUC抗氧化剂-AUC空白
荧光衰退曲线下面积(area under the curve,AUC)可以通过采用近似积分法计算,根据Wu等[11]实验中采用的公式得出。
1.3.6 MTT法检测蜂胶对Hep G2细胞的毒性
收集对数期Hep G2细胞,调整细胞悬液浓度,每孔加入200 μL,铺板使待测细胞调密度1 000~10 000/孔,(边缘孔用无菌PBS填充)。每组设5个平行样,于体积分数为5% CO2、37℃培养箱中培养使其贴壁;除去培养液,加入新的培养液与不同浓度的蜂胶提取液,于5%CO2,37℃孵育20 h;弃去培养液,小心用PBS冲2~3 遍后,再加入含MTT的培养液,每孔加入20 μL MTT溶液(即0.5% MTT),继续培养3 h;终止培养,小心吸去孔内培养液,每孔加入150 μL二甲基亚砜,振荡10 min,使结晶物充分溶解。使用酶标仪在570 nm波长处测量各孔的吸光度。
1.3.7 通过细胞模型测定蜂胶的抗氧化活性
取对数生长期的Hep G2细胞,调整细胞悬液浓度接种于6 孔细胞培养板,每个孔加入1 mL细胞悬液。于37℃、5% CO2培养箱培养24 h后去掉原培养液,用预冷的PBS清洗1次;加入10 mg/mL蜂胶溶液诱导30 min,之后去掉培养基用预冷的PBS清洗一次;加入5 mmol/L H2O2刺激30 min,去掉培养基后用预冷的PBS清洗1次;加入20 μmol/L DCFH-DA溶液,5% CO2、37℃培养箱中继续培养30 min,弃去培养液,用预冷的PBS溶液清洗3次,以充分洗去未进入细胞内的探针。最后收集v细胞并制成细胞悬液,用流式细胞仪检测荧光强度,激发波长为488 nm,发射波长为525 nm。
2 结果与分析
2.1 9个蜂胶样品中多酚类化合物组成和含量比较

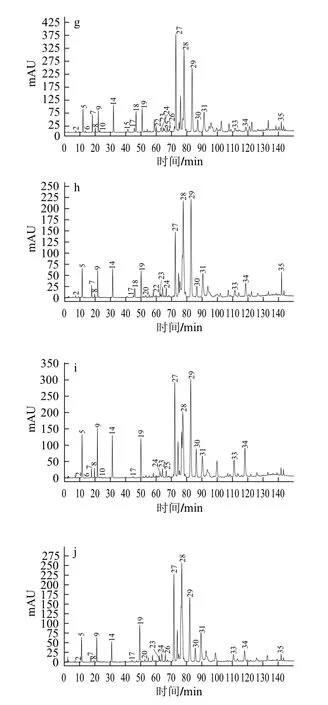
图1 不同地区蜂胶的HPLC色谱图Fig.1 Comparative HPLC chromatogram fingerprints of propolis extracts from different geographic origins
由图1可知,保留时间70 min之前,蜂胶提取物中主要成分是酚酸类物质,包括咖啡酸、p-香豆酸、异阿魏酸和3,4-二甲氧基肉桂酸等;在70~100 min之间主要成分是黄酮类物质,包括松鼠素、短叶松素-3-乙酸酯、柯因等;而100 min之后主要是球松素、高良姜素等黄酮和咖啡酸苯乙酯和肉桂酸肉桂酯等酚酸酯类物质。

表1 蜂胶提取物中多酚类成分含量Fig.1 Contents of polyphenols in propolis extracts
通过与标准品的保留时间、紫外光谱进行对比鉴定,对蜂胶样品中的24种多酚类成分进行了定性定量分析,结果如表1所示。蜂胶75%乙醇提取物中主要是一些多酚类成分,包括黄酮、酚酸及酯类物质,其中河南新野(1号)和黑龙江宝清(8号)的蜂胶样品中总多酚含量比较高,分别是230.078 mg/g和228.18 mg/g;河南拓城(2号)蜂胶样品中的总多酚含量最低只有81.91 mg/g。此外,总酚酸含量最高的是黑龙江宝清的蜂胶,其次是河北方城(4号),分别是54.87 mg/g和42.53 mg/g;总黄酮含量最高的是来自河南新野的样品,达到了194.52 mg/g。
在9个样品中,含量较高的黄酮成分包括短叶松素-3-乙酸酯、松属素、柯因、短叶松素、高良姜素、5-甲氧基短叶松素。含量较高的酚酸及酯类成分有咖啡酸苯乙酯、p-香豆酸、咖啡酸、异阿魏酸。 Claudio等[12]检测来自于亚洲地区的各蜂胶样品,其中含量较高的黄酮有柯因、松属素、短叶松素-3-乙酸酯和高良姜素,这与本研究结果相近。此外,不同产地的蜂胶的成分存在一定的差异,如p-香豆酸在来自河南拓城和河北故城(3号)的蜂胶中的含量较其他产地的蜂胶中的要高;3,4-二甲氧基肉桂酸在来自河北方城、北京延庆(6号)和黑龙江宝清(8号)的蜂胶样品中的含量较其他蜂胶样品中的多。

表2 蜂胶提取物的ORAC评估Fig.2 ORAC values of propolis extracts
2.2 9个蜂胶样品的ORAC值比较
由表2可知,各蜂胶提取物的ORAC值都很高,高于美国农业部公布的所有样品的ORAC值[13],说明蜂胶提取物的抗氧化能力非常强。由表还可看出这9种蜂胶样品的ORAC值范围为261 021~842 096 μmol Trolox/100 g。Daugsch等[14]也测定了乌拉圭蜂胶的ORAC值,其范围约为180 000~900 000 μmol Trolox/100 g,其结果与本实验结果相近。结合表1和表2可知,抗氧化能力最强的是来自黑龙江宝清的样品,其对应的总酚酸的含量也是最高的,达到54.87 mg/g;而山西灵石的ORAC值最低,其总酚酸的含量为21.06 mg/g,也是所有样品中总酚酸最低的。此外河北方城和北京延庆蜂胶的抗氧化能力在所有样品中分别为第二和第三,其总酚酸的含量也是对应的相同的位置。因此可知总酚酸含量较高的蜂胶,其ORAC值也普遍较高。蜂胶的ORAC抗氧化能力可能与酚酸类物质的含量存在一定关系。
2.3 Hep G2细胞模型法研究蜂胶的抗氧化活性
2.3.1 MTT实验检测不同质量浓度蜂胶的细胞毒性
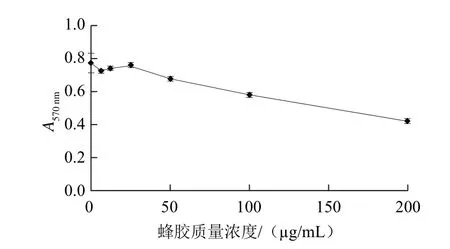
图2 不同质量浓度蜂胶的细胞毒性Fig.2 Cytotoxicity of different concentrations of propolis on Hep G2 assayed by MTT test
活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。在一定细胞数范围内,MTT结晶形成的量与活细胞数成正比。二甲基亚砜能溶解细胞中的甲瓒,用酶标仪在570 nm波长处测定其吸光度,可间接反映活细胞数量。图2反映的是经不同质量浓度(0、6.25、12.5、25、50、100 μg/mL)的蜂胶处理后的细胞存活情况,吸光度越大表示活细胞数量越多。经空白、6.25、12.5、25 μg/mL蜂胶处理后,其吸光度差异不大,即细胞存活数基本一致,说明当蜂胶质量浓度低于25 μg/mL,并不能致死细胞;当蜂胶质量浓度达到50 μg/mL时,吸光度开始明显下降,活细胞数降低,说明蜂胶在该质量浓度下可致死细胞。因此在之后的实验中,为了能更好地反映蜂胶在细胞中的作用,实验中蜂胶提取物质量浓度应低于25 μg/mL。
2.3.2 流式细胞仪检测蜂胶的细胞内抗氧化活性



图3 9个蜂胶样品对Hep G2细胞内活性氧的影响Fig.3 Effect of propolis extracts on reactive oxygen species (ROS) in Hep G2 cells
图3表示的是9个蜂胶样品处理Hep G2细胞后,通过流式细胞仪检测细胞内活性氧变化情况。当Hep G2细胞用过氧化氢处理后,过氧化氢与细胞内部的DCFH反应,产生具有绿色荧光的DCF。通过流式细胞仪测定细胞内DCF荧光强度,可以反应出细胞内的活性氧的水平。对于阳性样品,即不用蜂胶样品处理细胞,其细胞内活性氧的含量很高,,其阳性细胞率和总荧光强度分别达到了96.40%和221 104(图3c)。当细胞经蜂胶样品处理后,细胞内的活性氧都有不同程度的降低,即相比于不加蜂胶的对照样,其阳性细胞比例和总荧光强度都有明显的下降,说明这些蜂胶样品在细胞内都表现了一定的抗氧化能力。黑龙江宝清、北京蜜蜂所、甘肃天水这3种蜂胶样品处理后的荧光强度降低的最明显,都降到空白的一半以下,说明这3种蜂胶的细胞内抗氧化能力是最强的。其中,黑龙江宝清的蜂胶样品,细胞内的活性氧减少的最多,即细胞内大量的活性氧被该蜂胶样品清除,其阳性细胞比例为16.90%,与对照相比降低了79.5%,总荧光强度由之前的221 104变为77 651,降为原来的1/3(图3f),表明黑龙江宝清的蜂胶样品细胞内抗氧化能力最强。这与之前的ORAC实验结果一致,这说明细胞模型法和体外ORAC法测定蜂胶的抗氧化能力的结果具有一定的相似性。而河北故城和河南拓城的蜂胶细胞内抗氧化能力很低。其中经过河北故城的蜂胶样品处理后,其清除活性氧的效果不明显,阳性细胞比例和总荧光强度分别为85.20%和159 311,与对照相比差别不大,说明其清除活性氧的效果不明显,其细胞内抗氧化能力是这几种蜂胶样品相比是最弱的。总之从实验结果可知,9个蜂胶样品在细胞内均表现出一定的抗氧化能力。
细胞内抗氧化能力的强弱与ORAC法测定的细胞外抗氧化的结果有一定的相关性,但也存在一定的差异。两种方法显示黑龙江宝清的样品在体外和体内的抗氧化能力都是最强;而河北故城的蜂胶在处理细胞后,细胞内的活性氧降低得最少,但其总荧光强度也有一定程度的降低,说明也有一定的抗氧化能力,与ORAC法测定得到其抗氧化能力是非常强的结果不相符,这可能是河北故城蜂胶样品中有一部分活性成分没有进入细胞内发挥抗氧化作用,从而导致细胞外的抗氧化能力强,而细胞内的抗氧化能力弱。此外,北京蜜蜂所和甘肃天水的样品ORAC抗氧化能力较低,而在细胞实验中的结果则显示较高。此二者中总酚酸含量低导致了体外的抗氧化能力低,而它们的总黄酮的含量相对来说较高。因此推测蜂胶的细胞内抗氧化能力可能与黄酮类成分有关。黄酮类成分与酚酸类成分相比可能更容易进入细胞内,从而发挥抗氧化的作用,但具体机理需进一步研究。
3 结 论
通过HPLC对9个蜂胶中多酚类成分进行定性和定量分析。实验结果显示,9个蜂胶样品的主要多酚类成分是黄酮、酚酸和酯类物质。黄酮类化合物含量较高的有短叶松素-3-乙酸酯、松属素、柯因、短叶松素和高良姜素;酚酸及酯类物质含量较高的有咖啡酸苯乙酯、p-香豆酸、咖啡酸和异阿魏酸。利用ORAC法和细胞模型研究了这9个蜂胶样品的抗氧化活性性,结果表明这些蜂胶样品都具有很强的抗氧化能力。但不同的蜂胶因含有多酚类成分及含量的差异,表现出的抗氧化能力也存在一定差异。一般来说,总酚酸含量高的样品具有比较高的体外ORAC抗氧化能力。在细胞模型中,总酚酸和总黄酮含量都高的样品,细胞内抗氧化能力强;蜂胶的细胞内抗氧化能力可能与黄酮类成分有关。总体来说,蜂胶具有较强的体外和细胞水平的抗氧化能力。
[1]董捷, 张红城, 尹策, 等.蜂胶研究的最新进展[J].食品科学, 2007,28(9): 639-642.
[2]SIMONE F M, SPIVAK M.Propolis and bee health: the natural history and significance of resin use by honey bees[J].Apidologie,2010, 41(3): 295-311.
[3]曹炜, 尉亚辉.蜂产品保健原理与加工技术[M].北京: 化学工业出版社, 2002: 48-49.
[4]CHEN C N, WENG M S, WU C L, et al.Comparison of radical scavenging activity, cytotoxic effects and apoptosis induction in human melanoma cell by Taiwan propolis different source[J].Evidence-Based Complementary and Alternative Medicine, 2004, 1(2): 175-185.
[5]TRUSHEVA B, POPOVA M, KOENDHORI E B, et al.Indonesian propolis: chemical composition, biological activity and botanical origin [J].Natural Product Research: Formerly Natural Product Letters, 2011,25(6): 606-613.
[6]PATURUCUI E, CRUZ L L, MAILE R, et al.The propolis of stingless bees: terpenes from the tibia of three Frieseomelitta species[J].Journal of Insect Physiology, 2002, 48(2): 249-254.
[7]TEIXEIRA E W, DEJAIR M, NEGRI G, et al.Seasonal variation,chemical composition and antioxidant activity of Brazilian propolis samples[J].Evidence-Based Complementary and Alternative Medicine, 2010, 7(3): 307-315.
[8]KATARINA H, JOZEF L, JOZEF C.Determination of organic acid in propolis by HPLC using two columns with an on-line SPE system[J].Journal of Liquid Chromatography and Related Technologies, 2009,32(1): 125-135.
[9]GARCIA V C, FERRERES F, TOMAS B F.Study of Canadian propolis by GC-MS and HPLC[J].Zeitschrift fur Naturforschung C: A Journal of Biosciences, 1993, 48(5/6): 731-735.
[10]AHN M R, KUMAZAWA S, USUI Y, et al.Antioxidant activity and constituents of propolis collected in various areas of China[J].Food Chemistry, 2007, 101(4): 1383-1392.
[11]WU C, DUCKETT S K, NEEL J P S, et al.Influence of finishing systems on hydrophilic and lipophilic oxygen radical absorbance capacity (ORAC) in beef[J].Meat Science, 2008, 80(3): 662-667.
[12]CLAUDIO G, MARTINA S, PIERGIORGIO P, et al.Analysis of the polyphenolic fraction of propolis from different sources by liquid chromatography-tandem mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis, 2007, 45(3): 390-399.
[13]HAYTOWITZ D B, BHAGWAT S A.USDA database for the oxygen radical capacity (ORAC) of selected foods[EB/OL].(2010)[2012-05-16].http://www.ars.usda.gov/Services/docs.htm?docid=15866.
[14]DAUGSCH A, MORAES C S, FORT P, et al.Brazilian red propolischemical composition and botanical origin[J].Evidence-Based Complementary and Alternative Medicine, 2008, 5(4): 435-441.
