康宁霉素对国槐种子萌发过程中生理指标的影响
2014-01-22朱衍杰张秀省穆红梅
朱衍杰,张秀省,穆红梅
(聊城大学 农学院,山东 聊城 252059)
康宁霉素是从海洋生物中提取出的一种木霉多肽物质。木霉Trichoderma是一类重要的植物病害的生防真菌,按照传统的分类系统,其隶属于半知菌亚门Deuteromycotina丝孢纲Hyphomycetes丝孢目Hyphomycetales丝孢科 Hyphomycetaceae[1]。
Weinding首先发表了木霉对几种土壤真菌的拮抗作用的研究结果[2]。因其对多种病原真菌在体外或体内均表现出拮抗作用,所以木霉是国内外研究者研究较多的一种生防真菌[3]。多年来,人们对木霉的研究多集中于其防病作用、生物制剂的开发以及生防机制的研究等方面,对其促进植物生长方面的研究报道较为鲜见。近年来,人们发现除了在生物防治方面有重要的作用外,木霉具有植物生长调节剂的作用,一些木霉的代谢产物中含有赤霉素等物质,赤霉素能够打破种子的休眠[4],调控幼苗植株营养生长[5],所以木霉类物质在促进种子萌发及幼苗生长方面效果显著,并在诱导植物产生抗病性方面有较好的作用[6]。Chang等用以泥土或糠为基质培养的哈茨木霉处理土壤,可以提高辣椒、长春花和菊花等植物的发芽率,并出现开花早而多、植株株高及鲜质量增加的现象[7]。现有研究证明康宁霉素在一定浓度范围内可以提高皂荚种子的发芽率、发芽势等,促进了皂荚种子的萌发[8]。魏林[9]等应用哈茨木霉T2-16菌株的培养产物对豇豆种子进行浸种处理,发现该发酵产物在适宜浓度下可显著提高豇豆种子的活力指数,增进种子的萌发速率,减少物质外渗量,使豇豆种子有较强的成苗能力和生长性能。孙峰[10]用哈茨木霉RT-12发酵产物处理抗虫棉种子时发现木霉发酵产物也可以降低种子的相对电导率。魏林[11]等应用哈茨木霉T2-16菌株发酵产物,对5个杂交水稻种子进行浸种和发芽试验,发现使用木霉T2-16发酵产物浸种后,减轻了在种子萌发过程中生理代谢产生的自由基或种子吸胀过程中对细胞膜所造成的伤害,保护了细胞膜的完整性,从而减少细胞内营养大分子物质外渗,降低了种子的相对电导率。目前,关于木霉生防方面的研究主要在蔬菜和农作物上得到应用,尚未见关于园林绿化树种的相关研究报道。本文中采用新型的生物制剂来处理国槐种子,以探究木霉在促进种子萌发方面的应用潜力,为木霉制剂在园林育苗生产上的应用提供理论依据,并为国槐的繁殖栽培提供新的思路。
1 材料与方法
1.1 试验材料
以2012年采集于聊城市冠县国槐苗圃成熟的国槐种子为试验材料。
1.2 试剂与仪器
试验中用到的试剂有:康宁霉素提取液(由山东大学生命科学院微生物国家重点实验室提供),牛血清白蛋白,考马斯亮蓝G-250溶液,85%磷酸,无水乙醇,磷酸氢二钠,磷酸二氢钠,蔗糖,可溶性淀粉,蒽酮,乙酸乙酯,高氯酸,浓硫酸,石油醚,双蒸水,蒸馏水。
试验中用到的仪器有:试管(15mL)若干支,滤纸,玻璃棒,电导率仪(DDS-307),索氏脂肪提取器,水浴锅,烘箱,电子分析天平,恒温箱,紫外分光光度计,离心机,研钵,烧杯,试管,容量瓶,棕色瓶,脱脂滤纸等。
1.3 试验方法
1.3.1 国槐种子电导率的测定
采用改进的苏红[12]等的方法来测定电导率。将国槐种子用康宁霉素分别浸种6、12、18、24、30h,每阶段选取大小一致且无损伤的国槐种子3g左右,每个处理3次重复,用双蒸水冲洗数次后,用滤纸吸干表面水分,分别装入试管中,加入10mL双蒸水,在25℃下浸泡24h,同时将只装双蒸水的对照试管也置于该温度下。浸泡结束后,充分摇匀试管里的浸出液,测定浸出液和对照双蒸水的电导率,根据公式计算每个处理下单位质量国槐种子的电导率。计算公式如下:
电导率=(E1-E0)/G。
式中,“E1”表示浸出液的电导率,“E0”表示双蒸水的电导率,“G” 表示种子质量。
1.3.2 国槐种子内含物含量及抗氧化酶活性的测定
取浸种开始到发芽结束过程中不同阶段的国槐种子,进行各指标含量的测定。采用考马斯亮蓝法测定种子内的蛋白含量;用蒽酮法测定种子内可溶性糖和淀粉的含量;采用索氏提取器法测定种子内粗脂肪含量,采用紫外吸收法测定种子萌发过程中CAT酶活性[13];采用愈创木酚法、氮蓝四唑法分别测定种子萌发过程中POD、SOD保护酶的活性[14]。
2 结果与分析
2.1 不同浸种时间对国槐种子电导率的影响
国槐种子经过处理后,种子细胞膜的完整性会发生一些变化,可由种子电导率的变化显现出来,不同浸种时间对国槐种子电导率的影响如图1所示。由图 1可以看出,康宁霉素浸种24h时的电导率略低于其它浸种时间的处理,且与对照相比,随着康宁霉素质量浓度的降低电导率呈现先降低后升高的趋势,并在康宁霉素质量浓度为0.3mg/L时,种子的电导率最低,分别为23.11、19.73、13.94、9.11、17.03 μs·cm-1g-1,且与对照相比存在显著差异(p<0.05)。在最适质量浓度下,其余各浸种时段中国槐种子的电导率均高于浸种24h的国槐种子,说明康宁霉素在浸种24h下可以在一定程度上降低种子的电导率,减少种子内有机物质等的外渗,对种子的细胞膜产生一定程度上的保护作用,可以保持种子细胞膜的完整性。

图1 不同康宁霉素处理对国槐种子电导率的影响Fig.1 Effect of different T.koningii treatments on electrical conductivity of S.japonica seeds
2.2 不同浸种时间对国槐种子内含物含量的影响
不同浸种时间对国槐种子内可溶性蛋白、可溶性糖、淀粉、粗脂肪含量的影响如图 2~5所示。由图2~5可知,从浸种到种子发芽结束的整个过程中,种子内可溶性蛋白、可溶性糖、淀粉、粗脂肪含量的变化规律与种子电导率的变化规律相吻合。随着浸种和发芽的进行,种子内各物质的含量大体呈先增加后减少的趋势,并且在浸种24h时种子内各物质含量最大,在发芽第7天时种子内各物质含量开始出现明显变化,发芽第14天时,种子内各物质的含量降至最低。另外,浸种过程中,随着康宁霉素质量浓度的降低,国槐种子内各物质含量呈先升高后降低的趋势,在康宁霉素质量浓度为0.3mg/L时各物质含量最高,种子内有机物质流失较少,且在此质量浓度下与对照相比差异显著(p<0.05)。发芽过程中,经康宁霉素处理后,种子内各物质含量在发芽第7天时开始出现明显变化,发芽第14天时可溶性糖和脂肪消耗速度开始减慢,可溶性蛋白、淀粉消耗速度加快,但与对照相比,各质量浓度之间差异不显著(p>0.05),种子内含有的各物质含量大体上在300~0.3mg/L范围内呈下降趋势,在0.3~0.003mg/L范围内呈增加趋势,在康宁霉素质量浓度为0.3mg/L时种子内各物质含量最少。
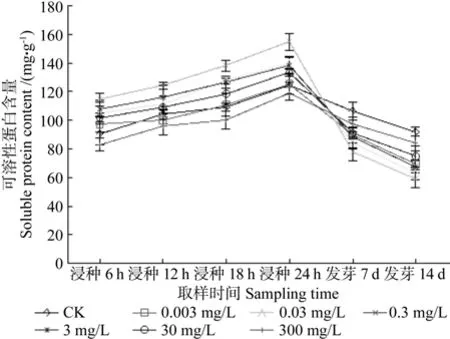
图2 不同康宁霉素处理对国槐种子中可溶性蛋白含量的影响Fig.2 Effect of different T.koningii treatments on soluble protein content in S.japonica seeds

图3 不同康宁霉素处理对国槐种子中可溶性糖含量的影响Fig.3 Effect of different T.koningii treatments on soluble sugar content in S.japonica seeds

图4 不同康宁霉素处理对国槐种子中淀粉含量的影响Fig.4 Effect of different T.koningii treatments on starch content in S.japonica seeds

图5 不同康宁霉素处理对国槐种子中粗脂肪含量的影响Fig.5 Effect of different T.koningii treatments on crude fat content in S.japonica seeds
2.3 不同浸种时间对国槐种子内抗氧化酶活性的影响
在国槐种子中保护酶活性测定中,不同质量浓度康宁霉素处理后种子内各抗氧化酶活性不同,且不同阶段下的变化规律也不同,如图 6~8所示。

图6 不同康宁霉素处理对国槐种子中POD活性的影响Fig.6 Effect of different T.koningii treatments on POD activity in S.japonica seeds

图7 不同康宁霉素处理对国槐种子中CAT活性的影响Fig.7 Effect of different T.koningii treatments on CAT activity in S.japonica seeds

图8 不同康宁霉素处理对国槐种子中SOD比活性的变化Fig.8 Effect of different T.koningii treatments on SOD speci fi c activity in S.japonica seeds
由图 6~8可知,在浸种过程中,国槐种子内过氧化物酶、过氧化氢酶、超氧化物歧化酶活性变化不明显,且各质量浓度之间差异不显著(p>0.05)。整体上,在康宁霉素300~0.3mg/L的范围内呈增加趋势,比对照的酶活性要高,在0.3~0.003mg/L的范围内POD、CAT、SOD比活性又呈下降趋势。在发芽第7天和第14天时,POD、CAT、SOD比活性最大出现在0.3mg/L,在此质量浓度下与对照相比,差异显著(p<0.05)。此时康宁霉素在300~0.3mg/L的范围内,随着康宁霉素质量浓度的降低,国槐种子内的保护酶活性随之升高,当康宁霉素质量浓度到达0.3mg/L时,国槐种子内的保护酶活性到达最大。另外,在康宁霉素质量浓度为300mg/L时,其种子内POD、SOD比活性比对照低。说明,康宁霉素在一定质量浓度范围内可以提高酶的活性,也可以降低其活性。
3 结论与讨论
魏林[15]等用哈茨木霉T2-16代谢产物对花生种子浸种处理后,发现其降低了种子外渗液的相对电导率,可能是因为减少或修复了细胞膜的损伤,改变了种子膜磷脂的物理状态,限制了过多的水分进入种子,这样减小了对种子细胞膜造成的损伤,有利于保持细胞膜的完整性,减少营养物质的外渗。刘登望[16]等用哈茨木霉拌种使花生蛋白质含量、亚油酸含量增加,油分含量增幅较大。POD、PPO、SOD均为植物细胞内清除活性氧伤害的保护酶,其活性的提高有助于提高植物的抗病性[17]。SOD是生物体内超氧阴离子自由基的清除剂,能有效地防止它们对生物体的损害,几乎参与了生物体对各种逆境的生理生化反应,是生物体内一种很重要的抗氧化酶类[18]。魏林[19]等应用哈茨木霉T2-16菌株发酵产物,对豇豆种子进行浸种处理,分析了发酵产物对种子萌发过程中主要生理生化过程的影响。结果表明,该发酵产物可增强豇豆体内 SOD、CAT、POD等保护酶活性。
本研究结果与前人的研究结果具有一致性。康宁霉素处理国槐种子后,其电导率发生了变化,种子内各种有机物质也出现不同程度的降低与升高。这说明使用康宁霉素对国槐种子进行浸种处理,在一定时间和质量浓度范围内保留了种子内大部分的物质,减少了种子内营养物质的外渗,降低了种子的电导率,使大部分营养物质能够用于种子的萌发和幼苗的生长。试验结果表明,康宁霉素在浸种24h时,可以极大地降低种子的电导率,保护细胞膜的完整性以及防止营养物质的外渗,并且以康宁霉素质量浓度为0.3mg/L的处理效果最好。另外,其浸种过程中种子内保护酶活性的变化不是很明显,但在萌发过程中国槐种子种保护酶的活性显著提高。这说明康宁霉素可以提高国槐种子中保护酶的活性,进而提高国槐种子在萌发过程中的抗病性,其机理还需要进一步的研究。
[1] 朱双杰,高智谋.木霉对植物的促生作用及其机制[J].菌物研究,2006,4(3): 107-111.
[2] Weinding R.Studies on a lethal principle effective in the parasitic action ofTrichoderma lignorumonRhizictonia solaniand other soil fungi [J].Phytopathology,1932,22: 837-845.
[3] 梁志怀,魏 林,罗赫荣, 等.哈茨木霉发酵产物多豇豆萌发及苗期生长的影响[J].湖南农业科学,2004,(1):18-20.
[4] 申瑞雪,潜伟平,刘江华,等.不同温度下赤霉素处理对乌饭树与短尾越橘种子发芽的影响[J].经济林研究,2012,30(4):14-18.
[5] 唐 辉,韦 霄,梁惠凌,等.外源激素对银杏高位嫁接及其枝梢生长的影响[J].中南林业科技大学学报,2007,27(1):86-87.
[6] 胡 琼.木霉对植物促生作用的研究进展[J].北方园艺,2010,(7): 197-200.
[7] Chang Y C,Baker R,Chet I.Increased growth of plants in the biological control agentTrichoderma harzianum[J].Plant Disease,1986,70(2):145-148.
[8] 朱衍杰,张秀省,穆红梅,等.康宁霉素对皂荚种子发芽的影响[J].种子,2013,32(11):8-10,15.
[9] 魏 林,梁志怀,罗赫荣,等.木霉代谢产物对豇豆种子活力及幼苗生长特性的影响[J].湖南农业科学,2004,(6):14-16,18.
[10] 孙 锋.木霉发酵产物对抗虫棉种子萌发及苗期生长的影响[J].作物杂志,2009,(2):33-35.
[11] 魏 林,梁志怀,罗赫荣.哈茨木霉T2-16发酵产物对水稻种子活力的影响[J].种子,2005,24(11):4-6,50.
[12] 宋 红,宋 刚,王 玲.红松种子超干贮藏研究[J].种子,2009,28(6): 30-33.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14] 武应霞,毕会涛,李继东,等.ABA及其合成抑制剂对喜树幼苗喜树碱及抗氧化酶的影响[J].经济林研究,2013,31(3):77-80.
[15] 魏 林,梁志怀,曹福祥,等.哈茨木霉T2-16代谢产物对花生种子活力和抗黄曲霉侵染能力的影响[J].中国油料作物学报,2009,31(3):370-373.
[16] 刘登望,周 山,刘升锐,等.不同类型拌种剂对花生及其根际微生物的影响[J].生态学报,2011,31(22):6777-6787.
[17] 屈海泳,罗 曼,蒋立科,等.T90-1木霉菌的筛选和对草莓灰霉病病菌作用机制的研究[J].微生物学报,2004,40(2):244-247.
[18] 段如雁,韦小丽,孟宪帅.不同光照条件下花榈木幼苗的生理生化响应及生长效应[J].中南林业科技大学学报,2013,33(5):30-34.
[19] 魏 林,梁志怀,曹福祥,等.哈茨木霉T2-16发酵产物对豇豆种子细胞膜及细胞保护酶系统的影响[J].种子,2011,30(3):47-49.
